乏燃料后处理碱性流程的研究进展
韩 哲,高 原,王春晖,邱 杰,*,何 辉,矫彩山
1.西安交通大学 核科学与技术学院,陕西 西安 710049;2.中国原子能科学研究院 放射化学研究所,北京 102413;3.哈尔滨工程大学 核科学与技术学院,黑龙江 哈尔滨 150001
核电是一种稳定、清洁、高效的能源。安全有序地推动核电的发展,将有助于我国“双碳”目标的实现。随着核电的发展,具有强放射性的乏燃料也日益增多。根据我国核电的发展情况,预计至2030年,乏燃料累计总量将达2.4万吨[1]。乏燃料中95%(质量分数,下同)以上是未反应的铀,还含有约3%~5%的裂变产物(FP)、1%的钚以及少量的次锕系元素[2]。若是采用一次通过的核燃料循环方式,即不对乏燃料进行后处理,铀资源的利用率还不到1%;若是采用闭式核燃料循环的方式,即把乏燃料进行后处理,将铀、钚等元素分离出来并循环使用,则既可以减小乏燃料的体积,又可以将铀资源的利用率提高到60%以上[3]。所以乏燃料后处理本质上是一个实现核废物最小化和铀资源利用最大化的过程。在水溶液中进行乏燃料后处理称为湿法后处理技术[4-5]。湿法后处理技术具有成本低、去污因子高等优点,主要包括沉淀法、溶剂萃取法、离子交换法等方法。

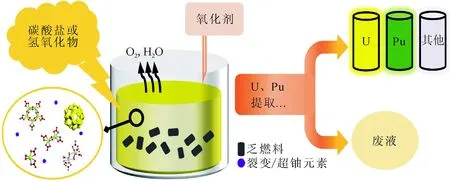
图1 乏燃料后处理碱性流程的示意图Fig.1 Schematic representation of alkaline process of SNF reprocessing
1 乏燃料后处理碱性流程的技术路线
目前关于乏燃料后处理碱性流程的研究尚不多,主要是日本、美国、俄罗斯、韩国等国家的研究人员开展了初步的研究工作。下面首先介绍各个国家建议的碱性流程的技术路线。各个流程所采用的溶解液和元素分离方法列于表1。
1.1 日本
1995年,日本东京工业大学的Tomiyasu等[20]针对PUREX流程使用浓硝酸作为介质进行乏燃料溶解与铀钚分离所带来的问题,报道了一种相对温和的乏燃料后处理方法。该方法主要包括如下工艺环节:用稀硝酸或稀盐酸代替浓硝酸在ClO2或臭氧等氧化剂的帮助下溶解乏燃料;加入碳酸盐溶液使pH值增大至9左右,在这一过程中,稀土元素、Cm、Ru、Rh、Pd、Sr、Nb、Zr、Mo、Sn、Ba等元素可能会以沉淀形式析出,后续再从沉淀中回收铂族元素;通过离子交换法除去Cs,得到含有U、Pu、Np、Am等元素的溶液。在1998年发表的一篇文章中,他们又对该方法的部分工艺进行了调整[21]。即通过加入四苯硼钠(sodium tetraphenylboron, STPB)使Cs形成沉淀,除去沉淀后,再加入NaOH或氨水使溶液pH增大至12~13左右,使U、Np、Pu以氢氧化物沉淀的形式析出而被回收。
在上述工作的基础上,他们在2001年首次报道了在碱性条件下溶解乏燃料、然后通过使裂片和锕系元素分步沉淀而将其分别回收的后处理方法[11]。该方法包括如下主要工艺环节:在Na2CO3-NaHCO3溶液中进行乏燃料的阳极溶解,在溶解过程中Sr、稀土、Zr、Mo、Ba、Rb、Tc、Ru、Rh、Pd、Am、Cm等元素可能会形成氢氧化物或碳酸盐沉淀而析出;在溶解液中加入四苯硼钠以使溶解的Cs形成沉淀析出;加入NaOH使U、Np、Pu等形成氢氧化物沉淀而被回收;加入四苯基氯化膦(tetraphenylphosphonium chloride, TPPCl)使Tc转化为沉淀;通入CO2使Na+转变为NaHCO3沉淀而回收Na,以减少废物的量。2006年,他们还报道了通过离子交换法分离U、Pu的方法[18]。即使碳酸盐溶液中的U和Pu吸附在酰胺肟树脂上,然后利用稀硝酸将其从树脂上淋洗下来,再在淋洗液中加入氨水使之转变为沉淀以便回收。
1.2 美国
自2004年起,美国洛斯阿拉莫斯国家实验室的Peper等[22-23]围绕碱性流程开展了一些基础研究,比如他们研究了UO2在碳酸盐溶液中的溶解行为,发现在溶液中加入氧化剂H2O2可以有效地促进UO2的氧化溶解,并在此基础上研究了铀在碳酸盐-H2O2溶液中的存在形态[24]。这部分内容将在下文详细介绍。2011年,美国西北太平洋国家实验室的Soderquist等[13]报道了三种具有不同燃耗的真实乏燃料在(NH4)2CO3-H2O2混合溶液中的溶解情况及对溶解液进行核素组分离处理的工艺流程(图2)。如图2所示,他们采用饱和(NH4)2CO3和w=30%H2O2的混合溶液溶解乏燃料。溶解完成后,将溶解液过滤。对于滤渣,用稀硝酸溶解其中的氢氧化物和碳酸盐沉淀,剩余的不溶固体被标记为贵金属组分。对于滤液,通过加热的方式使大部分(NH4)2CO3分解。在加热过程中,溶液中的大部分超铀和裂片元素会形成氢氧化物或碳酸盐沉淀。将溶液过滤,分别用稀硝酸和氨水洗涤滤渣后,所得洗涤液被标记为Sr组分,残留固体被标记为裂变产物组分。对于滤液,利用离子交换法去除Cs后,所得溶液被标记为U组分。用饱和(NH4)2CO3溶液淋洗树脂柱,流出的淋洗液被标记为Cs组分。通过上述处理流程,他们发现乏燃料中98%以上的组分可以在(NH4)2CO3-H2O2溶液中溶解。在随后除去大部分碳酸盐的过程中,溶解液中95%以上的Pu、Am和Cm及大部分裂片元素会以沉淀形式析出,从而实现在溶解这一环节就可以有效地净化溶解液。他们指出溶液中的U可进一步通过离子交换法、萃取法等方法回收,而(NH4)2CO3等试剂可以通过蒸发法回收再利用。因此,他们认为此流程与PUREX流程相比,溶液的放射性更小、工艺流程更简单。
除了碳酸盐体系,美国圣母大学Burns教授的研究团队自2005年起还报道了铀酰离子在LiOH、NaOH或KOH等氢氧化物溶液和H2O2的混合溶液中所形成配合物的结构、形成机理和性质[25-28]。他们发现铀酰离子可以与溶液中的氢氧根、过氧根等配位而形成铀过氧簇(图3中的黄色笼状小球)。铀过氧簇在溶液中以巨型阴离子的形式存在,其分子尺寸在1~4 nm,相对分子质量高达45 000,要远大于溶液中的其它组分[27-28]。基于铀过氧簇的形成条件和性质,他们在2014年报道了将铀酰离子转变为铀过氧簇、然后利用铀簇合物与溶液中其它组分的尺寸差别来分离铀的超滤法[19]。后续他们还使用模拟乏燃料(simulated spent nuclear fuel)开展了验证实验,提出了基于铀簇合物的乏燃料后处理方法(图3)[15]。该方法主要包括利用碱、双氧水和水的混合溶液来溶解乏燃料、通过超滤法除去非铀元素等工艺环节。

图3 美国圣母大学的研究人员提出的基于铀过氧簇的乏燃料后处理超滤法的示意图[15]Fig.3 Schematic representation of the ultrafiltration method which is a SNF reprocessing method based on uranyl peroxide clusters and proposed by researchers from the University of Notre Dame[15]
1.3 俄罗斯
自2008年以来,俄罗斯门捷列夫化工大学的Stepanov等研究人员报道了系列关于碱性流程的工作[10,16,29-40]。他们认为沉淀法难以实现高的净化系数,建议通过溶剂萃取法来提取核素,并把相应的后处理工艺称之为CARBEX流程(carbonate extraction)[16]。CARBEX流程包括短流程与长流程两种[10,16]。短流程包括以下后处理工艺:(1) 将乏燃料在高温氧化处理,使其中的UO2氧化为U3O8,并使乏燃料芯块转变为粉末,以便于溶解;(2) 将乏燃料溶解在碳酸盐-H2O2溶液中,此时U形成可溶性的碳酸铀酰配合物和碳酸过氧铀酰配合物;(3) 采用季铵盐作为萃取剂,从溶解液中萃取U(Ⅵ)和Pu(Ⅵ)的配合物;(4) 从有机相中提取U(Ⅵ)和Pu(Ⅵ)的碳酸盐配合物,并将其转化为UO2和PuO2陶瓷燃料。长流程除了包括上述工艺环节外,还包括从碳酸盐溶液中提取其它有价值的成分,比如Np、Am、Cm等次锕系元素及三价稀土元素等裂片元素。
Stepanov等[40]最初提出CARBEX流程时,主要是建议利用这种后处理方法来处理基于UO2的乏燃料,后来他们又把处理对象拓展到MOX乏燃料和其它后处理流程产生的废物,并根据处理对象的性质对流程进行了调整,提出了ELECTROCARBEX和CARBOFLUOREX等流程。其中ELECTROCARBEX流程是针对在熔盐中用高温电化学方法处理乏燃料时产生的PuO2阴极沉积物,主要包括PuO2阴极沉积物的阳极溶解和后续的利用溶剂萃取法提取Pu(Ⅵ)等工艺环节。CARBOFLUOREX流程是针对采用氟化挥发法处理乏燃料时产生的氟化灰。氟化灰中主要含有未被完全氟化的U和Pu化合物及非挥发性的裂片元素。该流程主要包括用碳酸盐-H2O2溶液从氟化灰中浸取U和Pu以及后续的利用溶剂萃取法提取U和Pu等工艺环节。
1.4 韩国
2009年,韩国原子能研究院的Kim等[12]报道了一种采用碳酸盐-H2O2溶液溶解乏燃料、通过沉淀法来回收铀的乏燃料后处理设想,并把这一方法称为COL流程(carbonate-based oxidative leaching precipitation process)(图4)。如图4所示,该路线主要包括四个环节:乏燃料在Na2CO3-H2O2溶液中的溶解;利用沉淀法去除Cs、Tc等可溶性裂片元素;通过酸化溶解液使铀转化为过氧化物沉淀(水丝铀矿,UO2(O2)·4H2O)的方法回收铀;通过电解法回收Na2CO3、NaOH和HNO3等试剂并循环使用。

图4 韩国原子能研究院的研究人员提出的乏燃料后处理碱性流程的技术路线[12]Fig.4 Schematic flow diagram of the alkaline process proposed by researchers from Korea Atomic Energy Research Institute[12]
通过上述内容,可以发现乏燃料后处理碱性流程与PUREX流程等后处理方法的主要区别在于使用碳酸盐或氢氧化物等碱性物质的溶液作为介质取代浓硝酸来进行乏燃料的氧化溶解与元素的分离。根据日本、美国、俄罗斯及韩国的研究人员提出的技术路线,可以发现碱性流程主要包括:乏燃料在碱性条件下的氧化溶解、铀钚等锕系元素和关键裂片元素的分离、碳酸盐等试剂的回收等工艺环节。针对这些环节,科研人员已开展了一些研究工作,下文将介绍这些工作的进展。
2 铀氧化物、模拟乏燃料和乏燃料在碱性溶液中的溶解行为
乏燃料的溶解程度和速率是判断一种湿法后处理方法是否具有应用价值的首要因素。对于碱性流程,已报道的研究大多选用碳酸盐[22]或氢氧化物[14-15]这两种碱性物质的溶液作为溶解液。乏燃料中最主要的成分是UO2。但UO2在纯碳酸盐或氢氧化物溶液中的溶解性并不好。研究人员发现可以通过电化学方法或直接在溶液中加入氧化剂的方式促进UO2在碱性条件下的氧化溶解。关于UO2在碳酸盐溶液中氧化溶解行为的研究并不少,但是早期大多数研究是将UO2置于类似深地质库存储条件下,观察U的缓慢浸出情况和相转变行为,目的是想了解和预测乏燃料在长期存储时的稳定性[41-43]。21世纪初,科研人员以乏燃料后处理为背景开始研究UO2在碱性溶液中的溶解行为[22,44]。这些研究表明UO2在氧化条件下可以完全溶于碱性溶液,在碱性条件下进行乏燃料溶解与铀分离具有一定的可行性。为了了解裂变产物和超铀元素在碱性溶液中的溶解行为,科研人员通常是根据乏燃料的化学组分,选用UO2及主要裂片元素的氧化物作为原料来制备模拟乏燃料,通过研究其在碱性条件下的溶解情况来推测乏燃料的溶解行为。这是因为乏燃料具有非常强的放射性,直接利用乏燃料开展实验是极具挑战性的。通过调研,我们发现目前只有Soderquist等[13,17]研究了乏燃料在碳酸盐溶液中的溶解行为。下文将介绍关于铀氧化物、模拟乏燃料和乏燃料的溶解行为的研究进展。
2.1 铀氧化物和模拟乏燃料在碱性电解质中的阳极溶解行为
Asanuma等[11,18,44]分别将UO2芯块和含有13种裂片元素(Sr、Zr、Mo、Ru、Rh、Pd、Ag、Ba、La、Ce、Pr、Nd、Sm)的模拟乏燃料芯块用导电胶粘在碳棒下方制备成了阳极,并以碳酸盐溶液作为电解质(图5),开展了电化学溶解实验。在文献[44]中,他们发现纯UO2和模拟乏燃料芯块在Na2CO3或NaHCO3溶液中均可以通过阳极氧化的方式而溶解。但在相同条件下,模拟乏燃料芯块的溶解速率比纯UO2芯块的溶解速率要快的多,且两者在Na2CO3溶液中的溶解速率比在NaHCO3溶液中要快。根据电解质溶液的元素分析结果[11],他们发现稀土和碱土金属元素在溶解过程中全部转变为沉淀,绝大部分贵金属也形成了沉淀,而Zr主要留在溶解液中。根据锕系元素的氧化还原电势,他们推测PuO2和NpO2的溶解机理与UO2一样,而Am和Cm在溶解过程中会形成沉淀。2006年,他们还报道了该模拟乏燃料在(NH4)2CO3溶液中的阳极溶解实验[18]。将芯块作为阳极、w=10%的(NH4)2CO3溶液作为电解质,使芯块在电位为1.0 V、温度为323 K的条件下溶解。他们计算出的芯块溶解速率常数为3.1×10-6mol/(cm2·min)。该溶解速率常数与UO2芯块在5 mol/L HNO3和0.01 mol/L HNO2的混合溶液中的溶解速率常数相当。此外,他们发现芯块的溶解速率和电流效率在溶解过程中会逐渐减小,这是由电极表面的纯UO2增多导致的。还发现溶解过程中碱土金属和稀土元素在芯块的表面形成了沉淀,这说明芯块的阳极溶解与裂片元素沉淀的形成可能是同步发生的。

图5 日本东京工业大学的研究人员设计的以模拟乏燃料芯块作为阳极(a)的电解池(b)[18]Fig.5 Simulated spent nuclear fuel cell as anode(a) and electrolytic cell(b) designed by Tokyo Institute of Technology[18]
Kim等[45]自2010年起报道了不同电位和溶液pH等条件对UO2和模拟乏燃料在碳酸盐溶液中的阳极溶解过程的影响。具体来说,他们发现当施加的电位不低于+4 V时,UO2芯块在碳酸盐溶液中可以有效溶解,还发现其在碳酸盐溶液中的腐蚀电位、溶解速率和电流效率随pH值的增加而降低。他们还对比研究了UO2和模拟乏燃料在NaCl或碳酸盐溶液中的阳极溶解行为,发现随着碳酸盐溶液pH值的减小,电极表面的腐蚀产物由UO2CO3转变为UO2HCO3,腐蚀电位也同时降低[46]。而在NaCl溶液中,当pH值减小时,腐蚀产物对循环伏安曲线没有影响。
2.2 铀氧化物在碳酸盐-H2O2溶液中的溶解行为
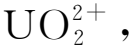

40 mg UO2,1 mol/L K2CO3,0.1 mol/L氧化剂,总溶液体积2 mL

Smith等[48]还研究了铀的氧化形态对铀溶解行为的影响。将5 mmol的UO2、U3O8和UO3粉末分别放在0.1 L的含有1 mol/L(NH4)2CO3和0.1 mol/L H2O2的溶液后,他们发现UO3表现为迅速完全溶解,UO2需要40 min才能完全溶解,U3O8的溶解速率比UO2要快一些,但是最终只能溶解80%左右。上文提到俄罗斯建议把乏燃料进行氧化处理以把乏燃料中的铀转化为U3O8,以便于溶解。但是根据Smith等[48]的实验结果,可以发现U3O8在碳酸盐-H2O2溶液中的溶解并不完全。所以未来需要开展更多的实验来明确U3O8在碱性溶液中的氧化溶解行为。
Hou等[49]系统研究了固液比、H2O2的浓度、碳酸盐的浓度、抗衡阳离子类型及溶液pH值对UO2粉末溶解行为的影响,发现其中溶液pH值和H2O2浓度的影响更为明显(图7)。还发现与Na2CO3相比,UO2粉末在(NH4)2CO3溶液中的溶解效果更好一些,这也与Peper等[22]的研究结果一致。此外,文献[50]还探究了温度和压力对UO2在NaHCO3和H2O2混合溶液中溶解的影响,发现温度和压力的升高有助于UO2的溶解。

H2O2浓度,mol/L:■——0.2,●——0.5,▲——1.0,▼——1.5
2.3 模拟乏燃料在碳酸盐-H2O2溶液中的溶解行为
不同模拟乏燃料在不同溶解液中的溶解情况列于表2。文献[12]在2009年报道了含有U、Np和12种裂片元素(Cs、Sr、Ba、La、Ce、Nd、Ru、Pd、Re(代替Tc)、Zr、Mo、Te)的模拟乏燃料在Na2CO3-H2O2溶液中的溶解行为。他们指出UO2可以被H2O2氧化并形成铀酰-过氧-碳酸配合物而溶解在碳酸盐-H2O2溶液中。根据NpO2在Na2CO3-H2O2溶液中的溶解实验结果(图8)和超铀氧化物的氧化还原电势,他们认为Np、Pu、Am等超铀元素的氧化物在碳酸盐和H2O2溶液中是不溶的。通过溶解实验,还发现裂片元素中只有Cs、Re、Te和Mo溶解[51]。其中Re、Te和Cs在10~20 min内可以基本溶解在0.5 mol/LNa2CO3和0.5 mol/L H2O2的混合溶液中,其溶解度分别高达(98±2)%(质量分数,下同)、(98±2)%和(93±2)%;而MoO2在该混合溶液中溶解得比较慢,2 h后溶解度为(26±2)%。这些结果说明,大部分裂变产物难以溶于碱性溶液。通过对比研究碳酸盐浓度、H2O2浓度、溶液pH值等条件对模拟乏燃料的影响,他们还发现溶液pH值是影响氧化溶解的最重要因素。当pH在10~12之间时,在实现UO2有效溶解的同时,还可有效减少裂变产物的溶解。

表2 模拟乏燃料和真实乏燃料在不同溶解液中的溶解情况Table 2 Dissolution behaviors of simulated spent fuel and real spent fuel in different dissolution solution
图8 NpO2在含有或不含H2O2的0.5 mol/L Na2CO3溶液中的溶解度[12]Fig.8 Solubility of NpO2 in 0.5 mol/L Na2CO3solution with or without H2O2[12]
2010年,Chung等[52]报道了含有16种元素(U、Ce、Gd、La、Nd、Pr、Sm、Eu、Y、Mo、Pd、Ru、Zr、Ba、Sr、Te)的模拟乏燃料在Na2CO3-H2O2溶液中的溶解行为。他们对制备的模拟乏燃料分别进行了氧化和还原处理。根据粉末X射线衍射(XRD)的表征结果,他们发现对于经过氧化处理的燃料,U主要以U3O8的形式存在;而对于经过还原处理的燃料,U主要以UO2的形式存在。还发现经过还原处理的模拟乏燃料在Na2CO3-H2O2溶液中的溶解速率比经过氧化处理的要快。与Lee等[51]的研究结果不同的是,他们发现将经过还原处理的模拟乏燃料在含有0.5 mol/L Na2CO3和2 mol/L H2O2的溶液中溶解2 h后,只有约20%(质量分数,下同)的Mo和不到5%的Ba、Sr溶解,Te等其它裂片元素几乎没有溶解。
Boyarintsev等[53]在2019年也报道了模拟乏燃料在碱性溶液中的溶解情况。他们用U3O8、CeO2、MoO3、ZrO2、Sm2O3、Y2O3、SnO、SrO、Cs2CO3和BaCO3粉末制备了模拟乏燃料,并将模拟乏燃料在空气气氛中和500 ℃高温下加热4 h。XRD数据证明U在模拟乏燃料中主要以U3O8的形式存在。他们先在模拟乏燃料中加入NaOH溶液以溶解其中的Mo和Cs,以使后续的萃取过程更简单。通过调节固液比和NaOH的浓度,他们发现通过一次浸取最多可使99.9%的Mo和26%的Cs溶解。然后再加入含有1 mol/L Na2CO3和0.2 mol/L H2O2的混合溶液(液固比为2.7),在70 ℃的超声条件下溶解90 min后,溶解液中U的质量浓度为142.5 g/L,Y、Ln、Ce和Zr的质量浓度为10~60 mg/L,Sn、Sr、Ba的质量浓度分别为5、9、15 mg/L。与Kim等[12]的研究结果相比,发现超声会促进U的溶解。
由上述可知,不同文献报道的裂片元素的溶解情况并不一致,这可能是由模拟乏燃料的制备工艺不同导致的,因此需要进一步地开展相关研究来揭示裂片元素在碱性条件下的真实溶解行为。
2.4 乏燃料在碳酸盐-H2O2溶液中的溶解行为
2010年,Soderquist等[17]报道了燃耗为45 GWd/Mt(以U计)的压水堆乏燃料分别在12 mol/L HNO3溶液及饱和(NH4)2CO3与w=30%H2O2的混合溶液中的溶解行为(表2)。发现其在两种溶液中的溶解情况相似,除了由Mo、Tc、Ru、Rh、Pd五种元素形成的贵金属相(noble metal phase)不溶解外,其它组分在两种溶液中均可以溶解。不同的地方在于Tc的溶解程度,碳酸盐-H2O2溶液中Tc的质量分数只有HNO3溶解液中的25%左右。上文已经提到,他们在2011年还进一步报道了三种具有不同燃耗的乏燃料在(NH4)2CO3-H2O2溶液中的溶解行为[13],这一工作也发现除了贵金属相外,乏燃料中的其它裂变产物和超铀元素均可以溶解。
通过上述实验结果,可以发现真实乏燃料中裂变产物和超铀元素在碳酸盐-H2O2溶液中的溶解行为与模拟乏燃料中的并不一致。Soderquist等[17]认为这可能与乏燃料的微观结构有关。他们指出只有当模拟乏燃料中的超铀元素和裂片元素均匀地分散在U的周围,而不是以大氧化物颗粒的形式存在时,模拟乏燃料才可以客观地模拟真实乏燃料。
2.5 铀氧化物和模拟乏燃料在碱金属氢氧化物-H2O2溶液中的溶解行为
除了碳酸盐和H2O2的溶液,美国圣母大学Burns教授团队的Hickam等[14]还研究了UO2和模拟乏燃料在不同碱金属氢氧化物和H2O2混合溶液中的溶解行为。2018年,他们报道了关于UO2在不同碱金属氢氧化物溶液中的溶解行为,发现UO2溶解后会形成多种具有不同纳米笼状结构的铀过氧簇[14]。元素分析的结果表明溶解液中碱金属元素与U元素的摩尔比为1∶1,这一结果说明溶液中碱金属离子的浓度决定了UO2的溶解度。他们还发现UO2粉末在不同碱金属氢氧化物溶液中的溶解度顺序为LiOH>NaOH>KOH(图9),其中在LiOH溶液中的溶解度可高达4.2×105ppm(1 ppm=10-6),接近UO2在浓硝酸溶液中的溶解度。上文提到,U在碳酸盐-H2O2溶液中的溶解度最大只有142.5 g/L左右。所以说UO2在碱金属氢氧化物和H2O2混合溶液中的溶解性要更好一些。
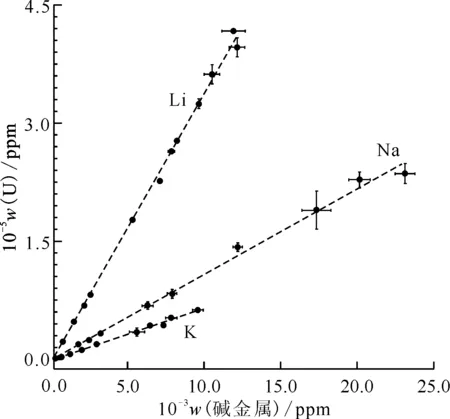
图9 UO2在不同碱金属氢氧化物溶液中溶解后,溶液中U的浓度随碱金属阳离子浓度的变化曲线[14]Fig.9 Concentration of U in solution following dissolution of UO2 versus concentration of alkali in solution[14]
Hickam等[54]在2019年还报道了H2O2和碱金属离子的浓度对UN和UO2在碱金属氢氧化物溶液中溶解行为的影响。如图10所示,他们发现只有在加入高浓度H2O2时,溶解液中Li+的浓度与U的摩尔浓度比为1∶1,此时UO2和UN溶解后倾向于生成铀过氧簇。当H2O2的浓度降低时,在Li+浓度较低的溶液中,U的浓度随Li+浓度的增加而增加;但在Li+浓度较高的溶液中,U的浓度随Li+浓度的增加变化不大。此时U在溶解液中以五聚体或单体等小配合物的形式存在。
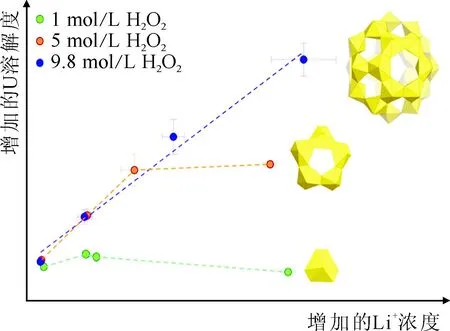
图10 加入200 μL 1、5、9.8 mol/L H2O2时,溶解液中U浓度随Li+浓度的变化曲线[54]Fig.10 Concentration of Li+ versus U for 200 μL of 1, 5, and 9.8 mol/L H2O2 addition experiments[54]
此外,Wylie等[15]在2016年报道了含有17种元素(U、Ba、Cs、Ce、Eu、Gd、La、Mo、Nd、Pa、Pr、Ru、Sm、Sr、Te、Y、Zr)的模拟乏燃料在LiOH(2.4 mol/L)和H2O2(w=30%)混合溶液中的溶解情况。除去不溶残渣后,他们分别利用电感耦合等离子体发射光谱仪(ICP-OES)和电感耦合等离子体质谱仪(ICP-MS)表征了溶解液,发现上述17种元素中只有U、Ba、Cs、Mo、Nd、Sr和Te这七种元素出现在溶液中。这些表征结果说明其它裂变产物元素没有溶解或者在溶解过程中转变为了沉淀,也说明模拟乏燃料在碱金属氢氧化物和H2O2的混合溶液中溶解后所得溶解液的组分相对比较简单。
由上述内容,可以了解到目前科研人员已经系统研究了氧化剂种类及其浓度、碳酸盐种类及其浓度、pH、温度、压力等因素对UO2在碳酸盐溶液中溶解行为的影响,并初步研究了模拟乏燃料和真实乏燃料在碳酸盐溶液中的溶解行为。通过这些研究可以发现真实乏燃料中裂片元素和超铀元素的溶解行为与模拟乏燃料中的并不相同,需要进一步开展工作来揭示裂片元素和超铀元素在碳酸盐溶液中的真实溶解情况。除了碳酸盐体系,科研人员还初步研究了UO2、UN和模拟乏燃料在碱金属氢氧化物和H2O2混合溶液中的溶解行为,发现其在LiOH溶液中的溶解度接近其在浓硝酸中的溶解度,比在碳酸盐中的溶解性要好。因此未来有必要开展更多工作来研究乏燃料在碱金属氢氧化物和H2O2溶液中的溶解行为和相应的元素分离技术。
3 锕系和裂片元素在碱性条件下的分离
在上文介绍各国提出的碱性流程的技术路线时,已经提到科研人员建议通过沉淀法、离子交换法、萃取法、超滤法等方法把铀、钚等锕系元素及Cs、Tc等裂片元素从溶解液中分离出来。相关研究具体介绍如下。
3.1 沉淀法
多个国家建议的乏燃料后处理碱性流程中均涉及了通过沉淀法来实现元素的分离。比如由日本的Asanuma等[11]和韩国的Kim等[12]提出的碱性流程中,均是建议通过沉淀法分离Cs、U和Tc等元素。美国的Soderquist等[13]对真实乏燃料的溶解液进行核素分组处理时,也使用了沉淀法。各国的科研人员也针对沉淀法开展了相关的研究工作[11-13]。
Asanuma等[11]制备了含有铀和裂片元素的溶液,研究了U和裂片元素的沉淀分离行为,实验结果列于表3。具体来说,他们将17种裂片元素的化合物(Sr(NO3)2、Y(NO3)3、ZrO(NO3)2、Rh(NO3)3、Pd(NO3)2、Ba(NO3)2、La(NO3)3、(NH4)2Ce(NO3)6、Pr(NO3)3、Nd(NO3)3、Sm(NO3)3、CsNO3、RbNO3、H6TeO6、Re2O7、Na2MoO4、RuNO(NO3)3)溶于1 mol/L HNO3,并将所得溶液与硝酸铀酰溶液混合,其中混合溶液中U(Ⅵ)离子的浓度为1 mol/L。再在溶液中加入碳酸盐溶液使pH增大到9左右,发现大部分裂片元素以沉淀的形式析出,并用该溶液来模拟乏燃料阳极溶解后形成的溶解液。通过在溶液中进一步加入四苯硼钠,他们发现可使100%的Cs沉淀出来,同时也会使约0.6%的U与Cs共沉淀出来。加入NaOH后,99.8%的U会形成沉淀,同时溶液中残留的Zr也会与U一起沉淀出来。这就导致分离出来的U不纯,需要通过其它工艺进一步去除Zr。此外他们还利用Re代替Tc,模拟了Tc的沉淀实验,发现加入四苯基氯化膦后可使100%的Re转变为沉淀而析出。

表3 日本东京工业大学的研究人员采用沉淀法回收核素的实验结果[11]Table 3 Experimental results of radionuclide recovery by precipitation method conducted by researchers at Tokyo Institute of Technology[11]
针对通过加入H2O2使U转化为水丝铀矿沉淀而分离U的设想,Kim等[55]系统研究了pH、离子强度、铀酰离子和H2O2浓度等条件对水丝铀矿的沉淀动力学的影响,并在2010年报道了相关结果。沉淀产生的水丝铀矿颗粒的形貌示于图11。他们发现U的浓度和离子强度对沉淀形成的诱导期和沉淀速率影响最大。还发现随着pH值和离子强度的增加,形成沉淀的诱导期延长,单个沉淀颗粒的尺寸减小,但是单个颗粒趋向于聚集形成更大沉淀。2014年,他们还报道了水丝铀矿沉淀在水溶液中不同pH(1.7~5.7)和温度(25~80 ℃)下的稳定性研究[56],发现其在蒸馏水中即使是在温度升高的条件下也比较稳定;但是在酸性条件下,当温度高于40 ℃时,水丝铀矿发生部分溶解,且当温度越高、溶液的酸度越大时,其溶解程度越大。

图11 UO4沉淀的扫描电子显微镜照片(含500 ppm铀的溶液在1.0 mol/L H2O2、pH=1、离子强度为0.5 mol/L的条件下沉淀180 min)[55]Fig.11 SEM photograph of UO4 particles precipitated at 180 min in a 500 ppm uranium solution at 1.0 mol/L H2O2, pH=1, and an ionic strength of 0.5 mol/L[55]
针对乏燃料溶解液中Cs、Tc等可溶裂片元素的沉淀法去除,Lee等[57]制备了含有Cs、Re(代替Tc)、Te、Mo、Zr、Sr和Nd七种裂片元素的Na2CO3-H2O2溶液,然后研究了分别使用四苯硼钠和四苯基氯化膦作为沉淀剂,去除Cs和Re的行为。实验结果表明四苯硼钠、四苯基氯化膦是很好的沉淀剂,可以选择性地沉淀Cs和Re,沉淀反应在5 min内均可完成。这与Asanuma等[11,18,44]的研究结果一致。他们也研究了溶液浓度、pH值等条件对沉淀反应的影响,发现pH值是最重要的因素。在较低的pH下,Mo会与Cs或Re共沉淀出来;当pH高于9时,不会发生Mo共沉淀的现象,四苯硼钠和四苯基氯化膦会分别使Cs和Re有效地沉淀出来。他们还发现Cs和Re的沉淀率分别依赖于四苯硼钠与Cs和四苯基氯化膦与Re的浓度比值。
3.2 离子交换法
除了沉淀法外,Soderquist等[13]采用的核素分组处理的工艺流程中还涉及了离子交换法。他们利用阳离子交换树脂从乏燃料溶解液中除去Cs+。具体来说,他们发现溶解液中超过98%的137Cs进入了Cs组分。这说明通过离子交换法可以有效地去除Cs。有意思的是,约一半的90Sr和11%的125Sb也进入了Cs组分。
日本的Nogami等[58]在2004年报道了酰胺肟树脂对碳酸盐溶液中的Pu(Ⅳ)、Pu(Ⅵ)和U(Ⅵ)离子的吸附行为。发现该树脂对三种离子的选择性满足如下顺序:Pu(Ⅳ)>Pu(Ⅵ);U(Ⅵ)>Pu(Ⅵ)。他们还制备了含有U(Ⅵ)和裂片元素离子Ru(Ⅲ)、Pd(Ⅱ)、Zr(Ⅳ)、Mo(Ⅵ)和Re(Ⅶ)(模拟Tc(Ⅶ))的碳酸盐溶液,并将其pH调控在9,然后使该溶液流经酰胺肟树脂柱,发现只有U(Ⅵ)离子被树脂吸附。这一结果说明,可以利用树脂把U从含有裂片元素离子的溶液中分离出来。Asanuma等[18]在此工作的基础上对碱性流程的技术路线进行了调整,建议通过利用酰胺肟树脂从乏燃料溶解液中吸附U、Pu以来实现其分离。
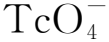
医用同位素99Mo大多是通过将经过辐照的U-Al合金靶溶解在NaOH等碱性溶液中,再将其从溶解液中提取出来。提取Mo元素后所产生的残渣中含有大量的高浓缩U,工业上通常是利用PUREX流程来回收U。2015年,Stassen等[60]首次报道了通过碱性流程来回收U的结果。他们利用(NH4)2CO3(1 mol/L)和H2O2(w=30%)的混合溶液在60 ℃下溶解残渣,然后使溶解液流经氧化铝柱子,利用离子交换法来回收U。通过三个循环后,可以实现U的全部回收,但是137Cs、106Ru和125Sb的去污因子比较低,在1~10之间。所以需要采用其它方法来除去这些核素、提高去污因子。
3.3 萃取法
早在1971年,Ueno等[61]首次报道了利用季铵盐从碳酸盐溶液中萃取裂片元素和锕系元素的实验结果。具体来说,他们采用甲基三辛基氯化铵作为萃取剂,研究了其对26种元素(U、Pu、Th、Pa、Np、Am、Cm、Ce、Sm、Eu、Tm、Lu、I、Tc、Zr、Nb、Ru、Mo、Se、Mn、Fe、Co、Ca、Sr、Ba、Cs)离子在0.1~2 mol/L Na2CO3溶液中的萃取行为,发现分配比随着元素种类和Na2CO3溶液浓度的不同而在10-3~103之间变化。整体来说,分配比随着Na2CO3溶液浓度的增加而减小。当Na2CO3溶液的浓度固定时,I(Ⅰ)、U(Ⅵ)、Pu(Ⅳ)等离子的分配比较大,而Cs(Ⅰ)、Sr(Ⅱ)、Am(Ⅲ)等离子的较小。
后续相关的报道不多。直到2008年,Stepanov等[16]报道乏燃料后处理的CARBEX流程时,建议通过萃取法从乏燃料的碳酸盐-H2O2溶解液中分离U、Pu和关键裂片元素。在2011年发表的一篇综述[10]中,他们进一步指出甲基三烷基铵(MTAA)是从碳酸盐溶液中萃取锕系元素的最适宜萃取剂。根据电子吸收光谱的结果,他们认为:在碳酸盐溶液中,MTAA与U的配合物反应后主要形成了(R4N)4[UO2(CO3)3]、(R4N)4[UO2-(O)2(CO3)2]和(R4N)6[(UO2)2(CO3)4]等配合物并转移到有机相中;在碳酸氢盐的溶液中,则主要形成配合物(R4N)2[UO2(CO3)2],其中R4N是指季铵盐。这些实验结果一方面说明MTAA具有从碳酸盐溶液中萃取U的能力,另一方面也说明铀酰离子与碳酸根和过氧根反应后可以形成多种配合物,其在碳酸盐-H2O2溶液中的化学形态比较复杂。此外,Boyarintsev等[53]在2019年报道了使用三辛基甲基碳酸铵(图12)作为萃取剂从模拟乏燃料的碳酸盐-H2O2溶解液中萃取U的结果,发现经过两步萃取处理后,裂片元素的去污因子在103~105之间。这些实验结果说明利用萃取法从碳酸盐-H2O2溶解液中萃取U是一种简单、有效的方法。

图12 萃取剂三辛基甲基碳酸铵结构式[53]Fig.12 Structure of methyltrioctylammonium carbonate[53]
Stepanov等[10]还研究了MTAA对Pu的萃取行为。乏燃料在碳酸盐-H2O2溶液中氧化溶解后,Pu在溶液中可以Pu(Ⅳ)和Pu(Ⅵ)的形式存在。他们发现当碳酸盐溶液中同时含有U(Ⅵ)和Pu(Ⅳ)时,MTAA基本不能萃取Pu(Ⅳ)。U(Ⅵ)的分配比(DU(Ⅵ))及U和Pu间的分离系数βU(Ⅵ)/Pu(Ⅳ)随有机相和水相体积比的增加而增大(表4)。其中βU(Ⅵ)/Pu(Ⅳ)的值高达 3 167,说明U(Ⅵ)和Pu(Ⅳ)之间可实现完全分离。但当碳酸盐溶液中同时含有U(Ⅵ)和Pu(Ⅵ)时,MTAA可同时萃取两种离子,βU(Ⅵ)/Pu(Ⅵ)的值在比较宽泛的Pu(Ⅵ)浓度范围内均很低。这些实验结果说明可通过调控Pu的价态为+4价,来实现U与可溶裂片元素和Pu(Ⅳ)的分离,然后把Pu(Ⅳ)氧化为Pu(Ⅵ)后,则可进一步实现Pu(Ⅵ)与裂片元素间的分离。

表4 有机相和水相的体积比(O/W)对U(Ⅵ)和Pu(Ⅳ)的分离系数的影响[10]Table 4 Effect of the organic/water phase ratio(O/W) on the separation coefficients of U(Ⅵ) and Pu(Ⅳ)[10]
Np在碳酸盐-H2O2溶液中通常以Np(Ⅴ)和Np(Ⅵ)混合价态的形式存在。Boyarintsev等[62]在2020年报道了采用三辛基甲基碳酸铵作为萃取剂从Na2CO3溶液中萃取Np(Ⅴ)和Np(Ⅵ)的实验结果。他们发现当Np的起始质量浓度为0.23 g/L时,分配比DNp(Ⅵ,Ⅴ)随着Na2CO3溶液的浓度从0.05 mol/L增加至1.5 mol/L而逐渐从194减小至0.4。通过对lgDNp(Ⅵ,Ⅴ)随lgc(Na2CO3)的变化曲线进行斜率分析,并结合溶液的紫外-可见光谱,他们认为Np(Ⅴ)和Np(Ⅵ)离子可能以(R4N)2-[NpⅥO2(CO3)2]、(R4N)3[NpⅤO2(CO3)2]、(R4N)6-[NpⅥO2(CO3)4]、(R4N)2[NpⅥO2(CO3)2]·2(R4N)2CO3、(R4N)5[NpⅤO2(CO3)3]、(R4N)7-[NpⅤO2(CO3)4]或(R4N)3[NpⅤO2(CO3)2]·(1~2)(R4N)2CO3的形式被萃取。
Am在碳酸盐-H2O2溶液中以Am(Ⅲ)碳酸盐配合物的形式存在。Boyarintsev等[63]在2020年还报道了采用三辛基甲基碳酸铵作为萃取剂分别从Na2CO3溶液和Na2CO3-H2O2溶液中萃取微量Am(Ⅲ)的实验结果。他们研究了Na2CO3、H2O2和萃取剂的浓度对Am萃取率的影响,发现分配比DAm(Ⅲ)随着萃取剂浓度的增加而变大,但随着Na2CO3溶液浓度的增加而减小。当Na2CO3溶液的浓度较低且萃取剂的浓度较高时,DAm(Ⅲ)的最大值>200;在相反条件下,DAm(Ⅲ)的最小值为0.01。通过对lgDAm(Ⅲ)随lgc(Na2CO3)的变化曲线进行斜率分析,他们认为Am(Ⅲ)离子是以R4N[Am(CO3)2]和(R4N)3[Am(CO3)3]的形式被萃取。

3.4 超滤法
目前关于超滤法的工作还非常有限,只有Wylie等[15,19]开展了一些工作。在文献[19]中,他们利用硝酸铀酰作为样品进行实验,通过使之与H2O2和LiOH等试剂反应而把铀酰离子转化为铀过氧簇,并通过小角X射线散射、拉曼光谱和电喷雾质谱等表征手段证实了铀过氧簇在溶液中的存在。然后使溶液分别流经三种具有不同分子量截留值(3、8、20K-PEG)的超滤膜,发现铀的截留率分别为95%、85%和67%。而当硝酸铀酰溶液直接流经这三种超滤膜时,没有U被截留。这些实验结果说明,可以利用铀过氧簇较大的尺寸来发展超滤法等铀分离方法。在这个工作的基础上,他们使用含有17种元素(U、Ba、Cs、Ce、Eu、Gd、La、Mo、Nd、Pa、Pr、Ru、Sm、Sr、Te、Y、Zr)的模拟乏燃料作为样品进一步验证了超滤法的可行性[15]。使用LiOH(2.4 mol/L)和H2O2(w=30%)的混合溶液溶解样品。除去不溶残渣后,用超纯水稀释溶解液,并在溶液中加入适量乙二胺四乙酸钾以配位Cs+、Sr2+、Ba2+等阳离子,然后使溶液流经分子量截留值为5K-PEG的超滤膜。发现经过一次溶解和超滤处理后,与最初的模拟乏燃料相比,去除了超过95%的裂片元素。这些实验结果说明通过利用U与裂变产物在碱性条件下的溶解性差异,以及利用铀簇合物与可溶裂片元素离子的尺寸差异采用超滤法处理溶解液,可以有效地去除裂片元素。
4 试剂的回收
倘若能把碱性流程中使用的碳酸盐等试剂回收,一方面可以减少废液的量,另一方面也可以循环利用一些化学试剂,从而使得乏燃料后处理工艺更环保、更经济。所以科研人员也针对这些组分的回收利用开展了一些工作。Asanuma等[11]通过在NaOH溶液中通入CO2,研究了Na的回收情况。发现在5 ℃的条件下,可以将70%左右的Na+转变为NaHCO3而回收。Kim等[64-66]针对基于碳酸盐-H2O2体系的后处理流程,设计了一套含有阳离子交换膜和气体吸收器的电解装置(图13)。该装置以水丝铀矿的形式回收U的同时,可以在连续操作中完全回收溶液中的碳酸盐,并去除残留的H2O2。此外,Kim等[66]还设计了含有阴离子交换膜和阳离子交换膜的电渗析装置来回收废液中的HNO3和NaOH。这些实验结果证明可以从碱性流程的碳酸盐-H2O2废液中回收有用试剂,减少二次废物的产生,也说明基于碳酸盐-H2O2体系的碱性后处理方法是一种环境友好的方法。

图13 从铀酰过氧碳酸配合物的溶液中回收碳酸钠盐的装置示意图[64]Fig.13 Schematic diagram of an apparatus used for electrolytic decarbonation and recycling of a sodium carbonate salt from a uranyl peroxocarbonate complex solution[64]
除了上述针对碱性流程的研究[11,64-66],Na2CO3作为一种常用化工产品,其在常规化工过程中的回收技术也得到了充分研究。这些研究对于碱性流程中碳酸盐回收方法的研究有着重要的借鉴意义。通过调研,发现结晶法是最常用的回收Na2CO3的方法[67-71]。比如蔡兴旺[67]利用NaHCO3在水溶液中的溶解度比Na2CO3低的特点,往溶液中通入CO2将Na2CO3转化为NaHCO3晶体析出,后续将NaHCO3晶体煅烧后,得到了无水Na2CO3。通过该方法,Na2CO3的回收率可达85%。除了这种方法,研究人员还研究了利用萃取结晶法回收Na2CO3的可行性[68-71]。所谓萃取结晶法是指向饱和盐溶液中加入某种有机萃取剂,利用该萃取剂将待结晶无机盐溶液中的水萃取出来;或者是萃取剂进入了饱和盐水溶液中,减小了无机盐在水中的溶解度,从而使无机盐从过饱和水溶液中结晶析出。比如,Taboada等[68]使用聚乙二醇(PEG)作为有机萃取剂,提出了从粗碱水溶液中提取无水Na2CO3的概念流程。具体来说,他们发现在313.15 K和真空条件下,Na2CO3-PEG-H2O体系可形成两种液相和一种固相,其中固相为无水Na2CO3。该研究表明通过使用PEG作为萃取剂,可以直接生成无水Na2CO3,无需经过煅烧过程。文献[69]使用正丁醇作为萃取剂,研究了其萃取Na2CO3的可行性。在此基础上,他们开发了撞击流旋转填料床这种新的反应器,实现了高达72.08%的Na2CO3回收率[70]。煤矸石制备白炭黑过程中产生的碳分溶液中也含有一定的Na2CO3,孙宇斐等[71]研究了采用萃取结晶法从该溶液中回收Na2CO3的过程。他们在碳分溶液中分别加入无水乙醇、95%乙醇、正丁醇、仲辛醇及异丙醇几种萃取剂后,发现95%乙醇可基本满足充分结晶Na2CO3的要求。通过上述介绍可以发现,与传统通过蒸发的结晶法相比,通过萃取结晶法可直接得到无水Na2CO3,省略了煅烧的步骤,是一种能耗更低的方法。所以未来有必要研究萃取结晶法在碱性流程中回收碳酸盐的可行性。
5 结论与展望
综上所述,相比于PUREX流程,碱性流程具有腐蚀性低、经济性高、可能适于处理高燃耗乏燃料等诸多优点,是一种具有重要发展潜力的乏燃料后处理方法。日本、美国、俄罗斯和韩国等国家的科研人员已提出了多种碱性流程技术路线,并针对乏燃料溶解、元素分离等主要工艺环节开展了系列研究工作。目前大部分工作集中在碳酸盐-H2O2体系,主要研究了UO2的氧化溶解行为,也初步研究了模拟乏燃料和真实乏燃料的溶解行为。关于后续U、Pu等元素的分离提取,科研人员已提出了沉淀法、萃取法、离子交换法、超滤法等多种方法。此外,还针对碳酸盐等试剂的回收再利用方面开展了初步的研究。根据已有的研究成果,关于碳酸盐-H2O2体系的研究相对成熟,该体系是最有可能被开发的体系。
与PUREX流程等后处理方法相比,碱性流程也有一些不足,比如乏燃料在碱性条件下的溶解度不高、溶解速率比较慢。由于大部分裂变产物和超铀元素在碱性条件下并不溶解或转变为碳酸盐与氢氧化物沉淀,如何在强放射性条件下进行固液分离、再从得到的强放射性固体中分别提取超铀元素和关键裂片元素,也是一些具有挑战性的工艺环节。此外,目前关于U、Pu、关键裂片元素等元素在碱性条件下的分离技术、高放废物的处理与处置、堆后铀钚的纯化与转化等方面的研究尚不成熟,该领域还存在诸多问题和挑战。
(1) 关于乏燃料在碳酸盐-H2O2溶液中的溶解,尤其是关于超铀元素和裂变元素在溶液中的溶解性,目前还存在实验结果不一致的情况。需进一步开展Pu、Np、Am等超铀元素和Mo、Ba、Sr等裂变元素在碱性条件下的溶解实验,明确它们真实的溶解度和溶解速率。在条件具备时,也需使用真实乏燃料开展溶解实验,进一步明确其在碱性溶解液中的溶解度和溶解速率。
(2) 关于U、Pu等元素的分离与提取,科研人员虽然提出了诸如沉淀法、萃取法、离子交换法等多种分离方法。但需开展更多的工作来评估和验证这些分离方法在乏燃料后处理中的可行性,并在此基础上进一步优化、完善可行性分离方法的工艺路线。目前的研究结果表明,萃取法在U、Pu分离上优势较为明显,但需在萃取剂的类型和萃取剂对裂片元素的选择性方面开展进一步的研究。
(3) 关于碳酸盐等试剂回收、废物的处理与处置、U与Pu的进一步纯化、化学转化和循环利用等方面的研究工作还不多。对于已开展的试剂回收工作,部分实验比较简单,所处理的溶液与碱性流程产生的废液在组分和放射性等方面差别较大。需针对碱性流程产生废液的组分和性质,开展试剂回收利用及废物处理处置的研究。其中碳酸盐试剂的回收可以借鉴常规化工过程中使用的回收方法,比如萃取结晶法等。目前还缺乏U与Pu的纯化、转化及利用等方面的研究,需进一步开展相关工作。
正如CARBEX流程的提出者Stepanov等[10]提到的,CARBEX流程的每个环节都是一个几乎没有被探索过的领域(Each declared stage of the CARBEX process is a scarcely explored field)。碱性流程作为一种新的后处理方法,目前还不完善,有必要围绕这一流程开展系列研究工作,填补相关基础研究的空白,为实现该后处理方法的应用提供科学基础。

