Brønsted-Lewis双酸性低共熔溶剂催化松香聚合反应
于亚莉,于凤丽
(青岛科技大学 化学与分子工程学院,山东 青岛 266042)
我国松香产量约占世界总产量的40%,出口贸易量占全球50%左右。松香的主要成分为枞酸型树脂酸,因枞酸中含有碳碳双键在空气中易被氧化[1],这使得松香在相关领域中应用时产生了一些缺陷和局限性。因此,人们对松香进行改性,以提高它的使用价值。聚合松香是一种重要的松香改性产品,它具有软化点高,色泽浅,酸值低,抗氧化性好等优点[2],广泛应用于涂料、黏合剂、油墨、造纸、橡胶、食品添加剂、生物材料等[3-5]。
早期人们使用Brønsted酸(H2SO4、HF 等)或Lewis酸(AlCl3、ZnCl2等)催化松香聚合反应[6],由于这些催化剂存在严重腐蚀设备、污染环境、不可重复使用等问题。2007 年,LI 等[7]使用固体酸BO33-/ZrO2/Mo-MCM-41做催化剂,但是,这些催化剂存在容易中毒或失活、分离时易流失、传质和扩散阻力较大、单位面积酸中心数量相对较少且分布不均匀以及催化剂制备时重现性较差等缺点,制约上述催化剂工业上的推广应用。2009年,Brønsted-Lewis酸性离子液体被用来催化松香聚合反应。LIU 等通过合成Brønsted-Lewis 酸性离子液体[HSO3-(CH2)3-NEt3]Cl-ZnCl2[8],[HO3S-(CH2)3-mim]Cl-ZnCl2[1]催化松香聚合反应,得到了软化点分别为134 ℃和118 ℃的聚合松香。2016年,YANG 等[2]制备了Sm0.33[TEAPS]2PW12O40杂多离子液体,得到了软化点为120.1 ℃的聚合松香。近年来,聚合松香的研究较少,能查到的文献仅限于此,故研究聚合松香具有较高的工业价值。
近年来,离子液体因其优良的特性被人们广泛研究。离子液体具有低饱和蒸气压,热稳定性,不易燃,低熔点,结构可设计等优点[9-12],然而离子液体作为催化剂存在一些不可避免的缺点,例如,制备成本高,毒性高,制备过程复杂及纯化困难等[13-14]。低共熔溶剂是指在较低温度下,按一定比例把两种或者两种以上的组分进行简单的混合后,通过氢键供体(HBD)和氢键受体(HBA)之间的氢键作用而形成的均态透明的液态共熔盐[15]。低共熔溶剂是一种新型的绿色溶剂,被认为是离子液体的“类似物”[16]。低共熔溶剂不仅具备离子液体的优点,也弥补了离子液体的缺点[17]。它具有原料成本低,制备简单[18],原子利用率100%,无毒,生物可降解等优点[19-22],已被广泛研究于催化剂,有机合成,电化学,生物质处理等领域[23-25]。
本工作合成了4 种Brønsted-Lewis酸性低共熔溶剂,筛选出活性最高的催化剂ZnCl2/2CH3COOH 并利用FT-IR,Py-FT,1H NMR 对 其结构进行了表征,采用热重对催化剂的热稳定性进行了分析。
1 实验部分
1.1 试剂与仪器
松香、氯化锌(ZnCl2),上海泰坦科技股份有限公司;无水甲酸(HCOOH)、丙酸(C3H6O2),阿拉丁化学试剂有限公司;乙酸(C2H4O2)、正辛烷(C8H18),国药化学试剂有限公司;苯丙酸(C9H10O2),上海麦克林生化科技有限公司;甲苯(C7H8),烟台远东精细化工有限公司。
傅里叶变换红外光谱仪,Nicolet 510P 型,美国Nicolet公司;核磁共振波谱仪,Bruker AV500型,德国Bruker公司;热分析仪,Netzsch-Sta449 F5型,德国Netzsch公司;实验室pH 计,FE20型,上海梅特勒-托利多仪器有限公司;集热式恒温加热磁力搅拌器,DF-101S,郑州英峪予华仪器有限公司;软化点测定仪,郑州英峪予华仪器有限公司。
1.2 催化剂制备
本工作制备的低共熔溶剂ZnCl2/2HCOOH、ZnCl2/2CH3COOH、ZnCl2/2CH3CH2COOH 和ZnCl2/2PhCH2CH2COOH,以ZnCl2/2CH3COOH为例:将ZnCl2和CH3COOH 以1∶2的物质的量的比加入50 mL三口圆底烧瓶中,100 ℃油浴加热,磁力搅拌2 h,白色的固体逐渐溶解,形成无色透明液体,便得到酸性低共熔溶剂。DES的主要特点为其凝固点低于任何单个组分的凝固点,通过液氮冷凝法测得低共熔溶剂ZnCl2/2CH3COOH 的玻璃转化温度为-32 ℃,乙酸的凝固点为16.6 ℃,氯化锌的凝固点为283 ℃。由此证明低共熔溶剂ZnCl2/2CH3COOH 成功制备。
1.3 催化反应
称取15 g的松香于100 mL 三口圆底烧瓶中,加入5.4 mL的甲苯和12.6 mL 的正辛烷,油浴加热至70 ℃溶解,完全溶解后加入5 g酸性低共熔溶剂,升温至110 ℃油浴加热,保持该温度并以800 r·min-1的转速机械搅拌10 h。反应完成后,催化剂与反应产物完全分离,将上层含有聚合松香的溶液倾倒而出,下层催化剂无需进一步处理直接用于下一次反应。上层液体通过常压蒸馏与减压蒸馏蒸出溶剂与未反应的松香。软化点采用环球法在SYD-2806G 电脑数控沥青软化点测定仪上测定,酸值采用化学滴定法测得。
2 结果与讨论
2.1 催化剂的催化活性
松香的聚合反应是个典型的酸催化反应,本工作采用不同的B酸和L 酸ZnCl2进行自组装,合成了一系列具有B-L双酸性低共熔溶剂,考察了此类催化剂在松香聚合反应中的催化活性,见表1。从表1可以看出,松香聚合反应需要适宜的酸强度。样品1~4中的催化剂为不同ZnCl2与B 酸在物质的量比为1∶2时制备的低共熔溶剂,其中样品2催化反应得到聚合松香的软化点最高为139.4 ℃,同时考察了无催化剂(样品7)或采用CH3COOH (样品5)、ZnCl2(样品6)作为催化剂时,体系中二聚产物的含量均较低,软化点分别为90.2、98.7 和122.9 ℃。综上所述,ZnCl2/2CH3COOH 的催化活性最好。并对其制备的聚合松香中Zn原子的含量进行电感耦合等离子体(ICP)的表征,其含量为0.085 3%。由此可推断出,在反应过程中少量催化剂残留在聚合松香中,但由于其含量较低,故而不影响聚合松香的实用性。
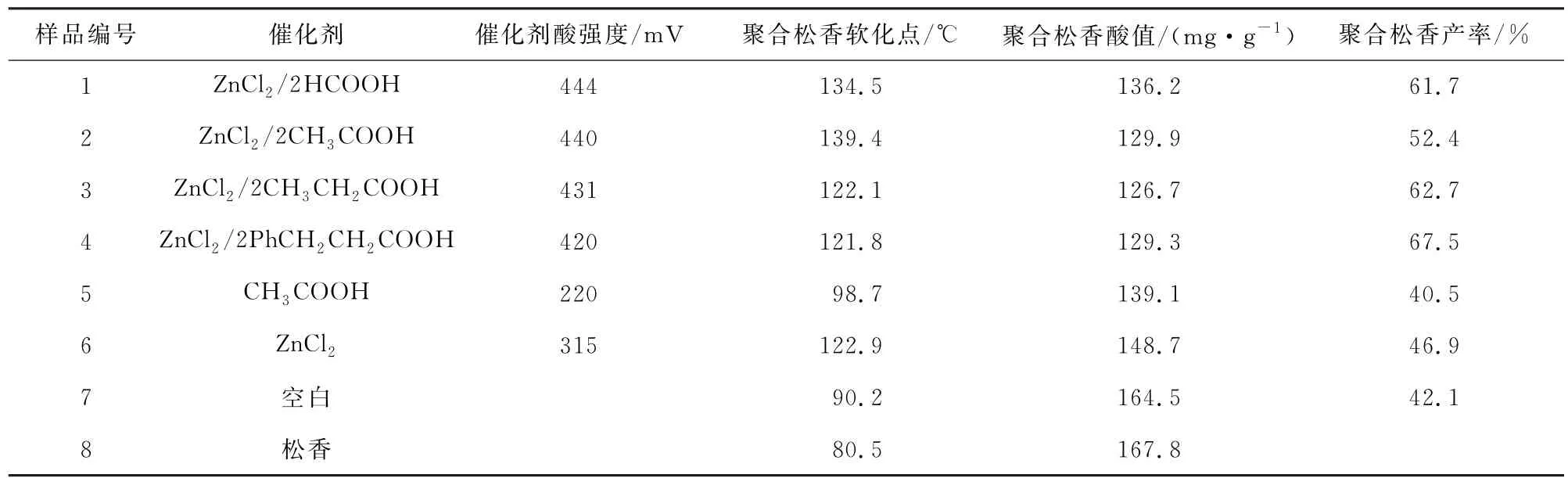
表1 不同催化剂的催化活性Table 1 Catalytic performance of different catalyst
2.2 催化剂的表征
2.2.1 催化剂ZnCl2/2CH3COOH 的红外表征
ZnCl2、CH3COOH、ZnCl2/2CH3COOH 的 红外光谱图见图1。

图1 ZnCl2、CH3COOH 和ZnCl2/2CH3COOH 的红外谱图Fig.1 FT-IR spectra of ZnCl2,CH3COOH and ZnCl2/2CH3COOH
在CH3COOH 的红外光谱图中,1 408 cm-1处的特征峰为C—H 键的弯曲振动,1 016 cm-1和1 298 cm-1处的特征峰对应于C—C 键的伸缩振动,ZnCl2/2CH3COOH 的红外光谱图中也存在这些特征峰。3 070、1 708 cm-1处的峰为CH3COOH羧基中—OH 的伸缩振动和C=O 键的伸缩振动。合成DES后,C=O 与—OH 的特征峰发生了蓝移,表明CH3COOH 与ZnCl2之间形成了氢键。图2为ZnCl2/2CH3COOH 吸附吡啶后的红外谱图。图中1 450 cm-1处的峰为L 酸位点化学吸附吡啶的特征吸收峰,1 540 cm-1处的峰为B酸位点化学吸附吡啶的特征吸收峰,表明催化剂同时具有Lewis酸性和Brønsted酸性。
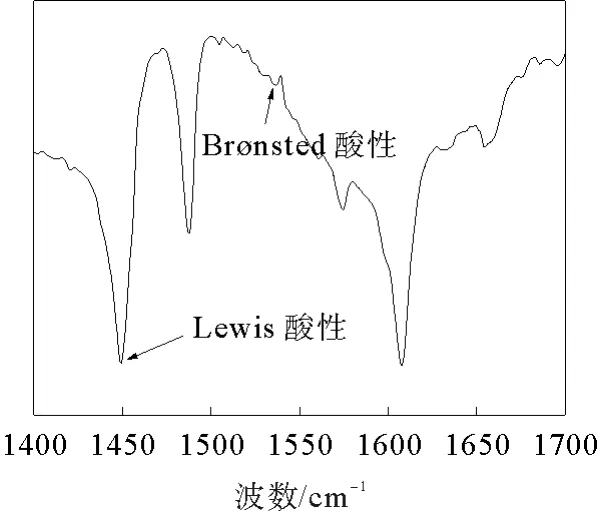
图2 ZnCl2/2CH3COOH 吸附吡啶后的红外谱图Fig.2 FT-IR spectrum of ZnCl2/2CH3COOH
2.2.2 催化剂ZnCl2/CH3COOH 的核磁表征
CH3COOH、ZnCl2/2CH3COOH 的核磁表征,进一步确定ZnCl2和CH3COOH 之间的相互作用,见图3。从图3可以看出,12~14处的峰发生了微小的移动,其他的峰位置均没有发生移动。12~14处的峰为CH3COOH 中—OH 的活泼氢的峰,再次验证CH3COOH 与ZnCl2之间形成了氢键,但是活泼氢的位移较小,说明CH3COOH 与ZnCl2之间形成的氢键较弱,暗示两者之间可能存在其他可形成DES的相互作用力。后由量化计算证明CH3COOH 与ZnCl2之间还存在较强的配位键。
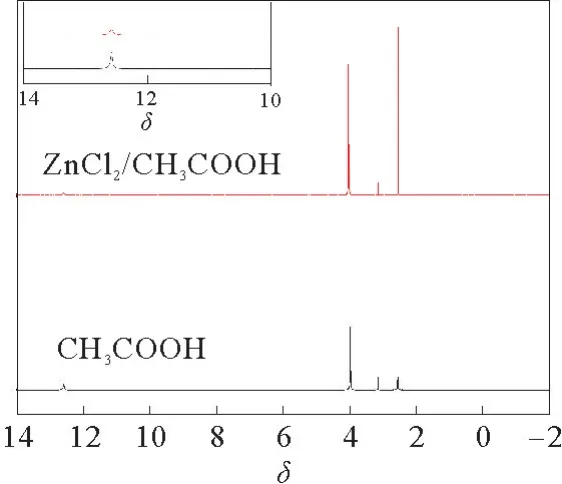
图3 ZnCl2/2CH3COOH 和CH3COOH 的核磁谱图Fig.3 1H NMR spectra of catalysts ZnCl2/2CH3COOH and CH3COOH
2.3 不同物质的量比的催化剂对松香聚合反应的影响
表2考察了不同物质的量的比的n(ZnCl2)∶n(CH3COOH)合成的DES的催化性能研究,从表2可以看出,聚合松香的性能与DES的酸强度密切相关,当其物质的量的比逐渐增加时,DESs的酸强度也逐渐增大,但其催化反应后聚合松香的软化点先增大后减小,而酸值呈现先减小后增大的趋势。当催化剂的物质的量的比为1∶2时,聚合松香的性能最佳。因此,选择n(ZnCl2)∶n(CH3COOH)=1∶2为该催化剂的最佳物质的量的比。
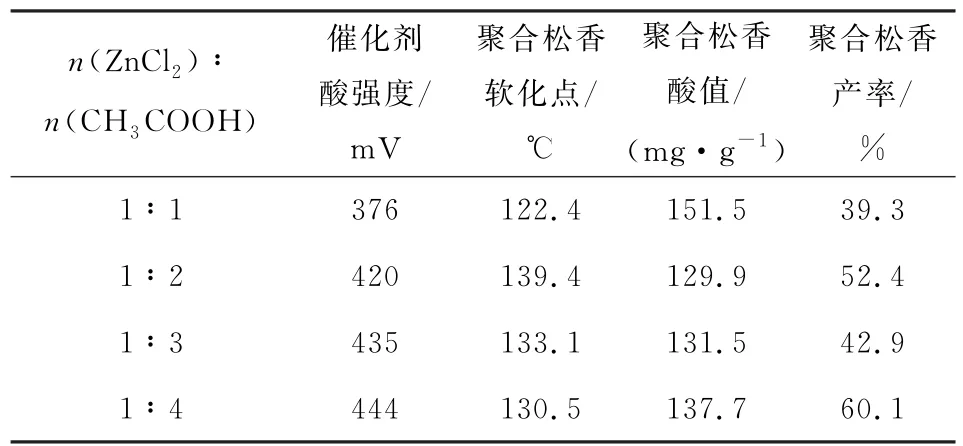
表2 不同物质的量的比DESs的催化活性Table 2 Catalytic performance of DESs with different molar ratio
2.2.3 催化剂ZnCl2/2CH3COOH 的热重表征
图4为催化剂ZnCl2/2CH3COOH 与回收后催化剂的热重谱图。从图4可以看出,110 ℃以下的失重为ZnCl2中吸附水分损失导致的,110~150 ℃之间的失重为部分CH3COOH 的挥发。将回收后的催化剂与新鲜的催化剂对比发现,回收后的催化剂具有更好的热稳定性,可能是因为在反应过程中,催化剂与少量松香结合后减缓了乙酸的挥发,使得ZnCl2/2CH3COOH 的结构更加稳定。

图4 ZnCl2/2CH3COOH 的热重谱图Fig.4 Thermogravimetric analysis of ZnCl2/2CH3COOH
2.4 反应条件优化
2.4.1 催化剂用量对松香聚合反应的影响
催化剂用量对反应的影响见图5。当催化剂的用量增加时,聚合松香的软化点先增加后减小,其酸值先减小后增大。表明适当增加催化剂的用量,有利于松香聚合反应。当催化剂的用量为5 g时,聚合松香的软化点达到最大值为139.4 ℃,其酸值最小,为129.9 mg·g-1。继续增加催化剂的用量,聚合松香的性能降低,可能是过量的催化剂也会导致树脂酸的氧化加剧。故催化剂的最佳用量为5 g。

图5 催化剂用量对反应的影响Fig.5 Influence of catalyst dosage on the reaction
2.4.2 反应温度对松香聚合反应的影响
为了进一步研究松香聚合反应的影响因素,考察了温度对反应体系的影响规律,见图6。从图6可以看出,随着温度的增加,聚合松香的软化点在逐渐增大,其酸值在逐渐降低。当反应温度达到110℃时,聚合松香的软化点为139.4 ℃,酸值为129.9 mg·g-1。由于催化剂ZnCl2/2CH3COOH 在110℃以后会有部分CH3COOH 挥发,故不能继续升高温度考察其对反应的影响。综上所述,该反应的最佳反应温度为110 ℃。
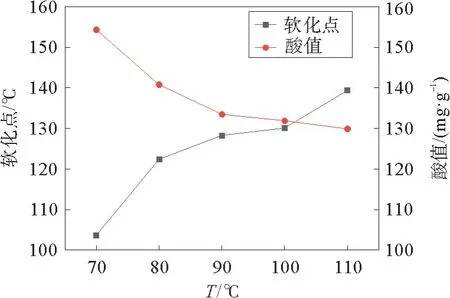
图6 温度对反应的影响Fig.6 Influence of temperature on the reaction
2.4.3 反应时间对松香聚合反应的影响
在T=110 ℃、n(催化剂)=0.2 mol、m(松香)=15 g,反应溶剂为V(正辛烷)∶V(甲苯)=7∶3时,考察了反应时间对松香聚合反应的研究,见图7。
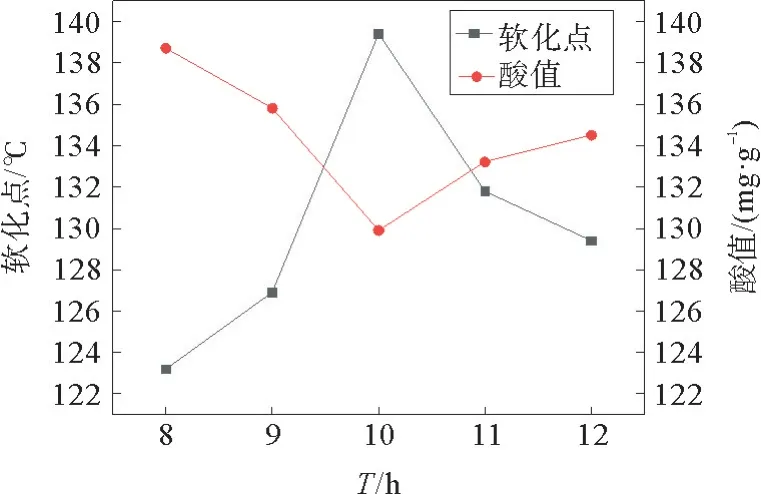
图7 时间对反应的影响Fig.7 Influence of time on the reaction
从图7可以看出,在一定的范围内,随着时间的增加,聚合松香的软化点在逐渐增加,酸值在逐渐减小。当反应时间达到10 h时,聚合松香的软化点达到最大值为139.4 ℃,酸值达到最小值129.9 mg·g-1。当继续增加反应时间,聚合松香的软化点开始逐渐降低,酸值也开始逐渐增大。可能是由于反应时间过长,树脂酸的氧化加剧,不利于聚合松香的生成所致。综上所述,由原料松香通过二聚反应生成聚合松香产物较合适的反应时间需控制在10 h。
2.5 催化剂的回收
反应结束后,反应产物与催化剂分离后,可将催化剂用于下一次反应。图8为ZnCl2/2CH3COOH催化剂在最佳反应条件下催化松香聚合反应的重复使用性能。由图8可见,当催化剂循环使用5次后,聚合松香的软化点略有降低,酸值略有升高。图9为催化剂回收前后的红外谱图。从图9可以看出,回收前后红外谱图特征峰基本一致,说明催化剂的结构未被破坏。因此,该催化剂具有良好的重复使用性能和结构稳定性。

图8 催化剂的重复使用性能Fig.8 Reuse performance of the catalyst
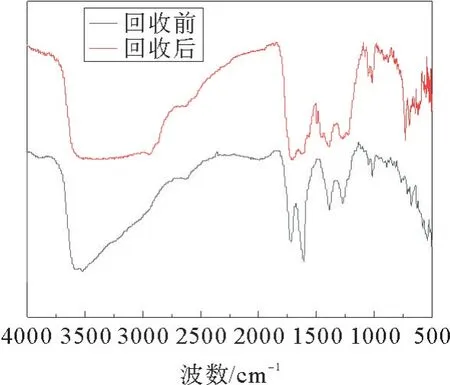
图9 催化剂回收前后的红外谱图Fig.9 FT-IR spectra of fresh and reused catalysts
2.6 理论研究
2.6.1 DESs的结构分析
本工作在B3LYP-D3/6-311++G**水平下,对低共熔溶剂ZnCl2/2CH3COOH 的结构进行了验证,其结果如图10所示,计算的结构中没有虚频,表明其结构是稳定的。在 DES 分子中,两个CH3COOH 分子分布在ZnCl2的两侧。ZnCl2分子中的Cl原子与CH3COOH 上的H 原子形成了新的共价键,如6Cl…4H、7Cl…19H,其键长为2.049 Å,由于其长度远小于范德华半径,因此可以确定为氢键。这与前面的红外谱图和核磁谱图相一致。此外,ZnCl2中的Zn原子与CH3COOH 上的O 原子之间形成了配位键(如2O…5Zn、13O…5Zn),键长为2.077 Å,可能是由于ZnCl2与CH3COOH 之间起到主要作用的共价键为Zn原子与O 原子连接的配位键,故导致核磁谱图中活泼氢的位移较小。

图10 ZnCl2/2CH3COOH2 的结构Fig.10 Structure of ZnCl2/2CH3COOH
2.6.2 DESs的静电势分析
图11为静电势图,通过静电势(ESP)分析考察了ZnCl2与CH3COOH 之间的非共价键体系。静电势主要通过分析原子周围的电子云密度判断分子之间的结合方式,其中红色区域代表电正性区域,蓝色区域代表电负性区域。ESP 分析表明,CH3COOH 分子中—OH 上的H 原子和O 原子电正性较强,ZnCl2分子中的Cl原子和Zn原子电负性较强,在低共熔溶剂ZnCl2/2CH3COOH 形成的过程中,CH3COOH 分子中电正性较强的区域进攻ZnCl2分子中电负性较强的区域。ESP分析与上述结构分析一致。
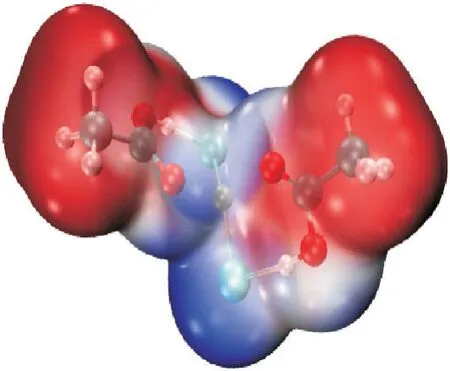
图11 ZnCl2/2CH3COOH 的静电势图Fig.11 ESP mapping of ZnCl2/2CH3COOH
2.6.3 DES催化松香聚合反应的机理
ZnCl2/2CH3COOH 活化枞酸的示意图见图12。从图12可以看出,将催化剂ZnCl2/2CH3COOH 靠近枞酸树脂分子,由于枞酸树脂中的共轭双键具有电负性,低共熔溶剂中的Zn原子具有电正性,故枞酸树脂与低共熔溶剂ZnCl2/2CH3COOH 之间形成了配位键 (如1C…69Zn、3C…69Zn)。在枞酸树脂与催化剂之间配位键的形成过程中,低共熔溶剂ZnCl2/2CH3COOH 中的氢键如(70Cl…56H、71Cl…68H)和配位键(如54O…69Zn)的键长均变长,由此可以看出,低共熔溶剂ZnCl2/2CH3COOH 可以催化松香聚合反应。

图12 ZnCl2/2CH3COOH 活化枞酸的示意图Fig.12 Activation of abietic acid with ZnCl2/2CH3COOH
3 结论
对合成的酸性低共熔溶剂ZnCl2/2CH3COOH的结构进行表征证明,催化剂ZnCl2/2CH3COOH同时具有Brønsted酸性和Lewis酸性,为催化松香聚合反应体系提供了适宜的酸强度,制备出软化点为139.4 ℃的聚合松香。该催化剂原料成本低,制备简单,原子利用率100%,无需后处理,且具有良好的循环使用性能。

