不同衰弱评估工具对老年射血分数保留的心力衰竭患者的临床意义
程曦 查志敏 王向明 姜苏蓉 郭妍
210029 南京医科大学第一附属医院老年心血管科
随着世界各地人口老龄化逐渐加剧,衰弱的发生率逐年上升,全球老年社区居民平均每年每1 000人中会有43人发生衰弱[1]。已有许多研究证实,衰弱是老年人死亡的一个重要危险因素,同时还会导致残疾、跌倒、骨折、生活质量下降等一系列问题[2]。与衰弱一样,慢性心力衰竭也与年龄密切相关,老年心力衰竭患者常常有更差的临床结局,如更高的再住院率及死亡率,相关的医疗费用也更高[3],其中射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)是老年心力衰竭患者中最常见的类型[4]。衰弱常与HFpEF共存,增加患者的全因死亡风险,识别此类患者并进行早期药物或非药物的干预可延缓或逆转他们的衰弱状态,降低不良临床结局的发生率,改善预后[5]。因此,选择合适的衰弱评估工具对老年HFpEF患者进行衰弱筛查十分重要。
目前国内外常用的衰弱评估工具有很多,但尚无公认的“金标准”,没有一种方法能全面涵盖衰弱的所有重要领域,比较不同衰弱评估工具在不同人群中应用的相关研究仍较少。本研究旨在对国际上较常用的四种衰弱评估工具:临床衰弱量表(Clinical Frailty Scale,CFS)、衰弱筛查量表(Frailty Screening Inventory,FRAIL)、衰弱表型量表(Fried Frailty Phenotype,Fried)和衰弱指数(Frailty Index,FI)在老年HFpEF患者衰弱筛查中的一致性和适用性进行评价,以期为老年HFpEF患者选择合适的衰弱评估工具提供参考,进而早期干预,预防或延缓失能。
1 对象和方法
1.1 研究对象
本研究为单中心横断面研究。连续入选2021年9月至2023年2月在南京医科大学第一附属医院老年心血管科住院的患者207例,其中17例因衰弱相关数据不全被排除,最终共有190例纳入研究,男性122例(64.2%),女性68例(35.8%),年龄60~100(79.2±11.0)岁。根据《射血分数保留的心力衰竭诊断与治疗中国专家共识2023》[6]中的HFpEF诊断标准分为HFpEF组61例(32.1%)与非HFpEF组129例(67.9%)。纳入标准:(1)年龄≥60岁;(2)住院时间>24 h;(3)神志清楚,能完成衰弱评估相关内容,并签署知情同意书。排除标准:(1)长期卧床、失语、痴呆、精神异常、恶性肿瘤需定期来院放化疗者以及完全失能不能完成衰弱评估者;(2)急性心力衰竭或左心室射血分数<50%的心力衰竭患者;(3)严重的肝肾功能衰竭或多器官功能衰竭者;(4)拒绝签署知情同意书者。本研究已经南京医科大学第一附属医院伦理委员会批准(伦理审查编号:2021-SR-522)。
1.2 研究方法
1.2.1 一般资料收集 收集患者的基本信息,包括年龄、性别、身高、体重、体质指数、吸烟史(>20支/年即认为有吸烟史)、入院当天的收缩压与舒张压、多重用药(同时服用药物≥5种)、高血压、糖尿病、心房颤动情况。所有入选患者在入院次日抽取清晨空腹血,检测N末端B型利钠肽原水平。在患者入院后的48 h内进行临床资料的收集并进行衰弱评估。
1.2.2 衰弱评估及分组 使用以下五种工具来评估老年患者的衰弱程度:
(1)CFS:CFS量表根据衰弱程度的不同将患者的情况分为9级,从低到高依次为非常健康、健康、维持健康、脆弱易损伤、轻度衰弱、中度衰弱、严重衰弱、非常严重的衰弱、终末期。等级越高,衰弱程度越重,以1~4级为非衰弱,5~9级为衰弱[7]。
(2)FRAIL:FRAIL量表包含5项内容:①疲乏:过去4周内大部分时间或所有时间感到疲乏;②阻力增加或耐力减退:在不需要他人帮助及不使用任何辅助工具的情况下,中途不休息爬1层楼梯有困难;③自由活动下降:在不需要他人帮助及不使用任何辅助工具的情况下走完100米有困难;④疾病:存在5种以上疾病;⑤体重下降:1年内体重下降≥5%。以上具备0~2项者定义为非衰弱,3~5项者定义为衰弱[8]。
(3)Fried:Fried量表包括:①不明原因的体重下降;②疲乏;③握力下降;④行走速度下降;⑤躯体活动能力降低。符合3项或3项以上为衰弱,<3项为非衰弱[9]。
(4)FI:FI涉及≥30种健康变量,包括躯体、功能、心理及社会等多方面,健康缺陷的数量越多则表明越衰弱。根据Searle等[10]提出的基于老年综合评估(CGA)制订FI的标准程序,本研究构建了一个包含37个变量的FI量表[11],FI≥0.25定义为衰弱。
(5)综合衰弱指数(combined index,CI):将上述四种评估工具综合来构建一个新的评估工具——CI,即四种工具中至少有三种工具定义为衰弱,则受试者被定义为衰弱。我们假设CI为衰弱评估的“金标准”,该方法在Sze等[12]和Liang等[13]的研究中也曾使用过。
1.2.3 其他资料 使用握力计测量握力,嘱受试者站立,双臂自然下垂置于身体两侧,双脚分开与肩同宽,单手尽最大力气紧握测力计手柄,双手均测量2次,记录4次读数中的最高值。采用简易精神状态评价量表(Mini-Mental State Examination,MMSE)评估认知功能,MMSE≤24分为认知功能缺陷,以上为正常。使用微型营养评估量表(Mini-Nutritional Assessment Short-Form,MNA-SF)评估营养风险,0~7分提示营养不良,8~11分提示有营养不良风险,12~14分提示营养状况良好。采用简版老年抑郁量表(15-item Geriatric Depression Scale,GDS-15)评估抑郁状态,0~4分不考虑抑郁,5~9分可能抑郁,10~15分为抑郁。使用阿森斯失眠量表(Athens Insomnia Scale,AIS)评估睡眠障碍情况,0~3分无睡眠障碍,4~6分可疑失眠,>6分为失眠。
1.3 统计学方法

2 结果
2.1 不同人群患者一般情况比较
HFpEF组男性37例(60.7%),女性24例(39.3%),年龄63~100(85.8±9.3)岁;非HFpEF组男性85例(65.9%),女性44例(34.1%),年龄60~98(76.1±10.4)岁。HFpEF组的年龄、心房颤动比例、N末端B型利钠肽原水平、GDS-15评分高于非HFpEF组,吸烟史比例、体质指数、舒张压、握力、MMSE评分、MNA-SF评分低于非HFpEF组,差异有统计学意义(均为P<0.05);两组的性别、收缩压、多重用药比例、高血压比例、糖尿病比例、AIS评分无统计学差异(均为P>0.05)。无论使用何种评估工具,HFpEF组中衰弱的患病率均高于非HFpEF组(均为P<0.001),见表1。

表1 HFpEF组与非HFpEF组一般情况比较
2.2 不同衰弱评估工具在不同人群中的评估表现
在整体人群中,CFS、FRAIL、Fried、FI量表所评估的衰弱患者比例分别为38.9%、35.8%、37.4%、46.3%;在HFpEF患者中,CFS、FRAIL、Fried、FI量表所评估的衰弱患者比例分别为70.5%、70.5%、72.1%、68.9%;在非HFpEF患者中,CFS、FRAIL、Fried、FI量表所评估的衰弱患者比例分别为24.0%、19.4%、20.9%、35.7%,见图1。不同的衰弱评估工具所评估的衰弱患病率各不相同,在整体人群中,共有22.1%(42例)的患者同时被CFS、FRAIL、Fried、FI量表评估为衰弱,HFpEF组中为45.9%(28例),非HFpEF组中为10.9%(14例),见图2。

HFpEF:射血分数保留的心力衰竭;CFS:临床衰弱量表;FRAIL:FRAIL量表;Fried:衰弱表型量表;FI:衰弱指数

HFpEF:射血分数保留的心力衰竭;CFS:临床衰弱量表;FRAIL:FRAIL量表;Fried:衰弱表型量表;FI:衰弱指数
2.3 不同衰弱评估工具对不同人群衰弱评估结果的一致性比较
分别进行CFS、FRAIL、Fried、FI量表与CI之间的一致性比较,结果显示,在整体人群中Kappa值分别为0.846、0.861、0.874、0.418;在HFpEF组中,Kappa值分别为0.778、0.778、0.813、0.231;在非HFpEF组中,Kappa值分别为0.864、0.851、0.856、0.379。FI量表与CI一致性相比其他量表较差,且FI量表在HFpEF组中与CI异质性明显(P=0.07),见表2。

表2 不同衰弱评估工具与CI之间的一致性比较
2.4 ROC曲线分析不同人群中不同衰弱评估工具的敏感度、特异度和AUC
以CI为“金标准”,在整体人群中,CFS、FRAIL、Fried和FI量表的AUC分别为0.960、0.972、0.978和0.806,敏感度最高的量表为CFS(98.44%),特异度最高的量表为FRAIL(93.65%);在HFpEF组中,CFS、FRAIL、Fried和FI量表的AUC分别为0.888、0.897、0.956和0.753,Fried量表敏感度最高(100.00%),FI量表特异度最高(95.45%);在非HFpEF组中,CFS、FRAIL、Fried和FI量表的AUC分别为0.975、0.984、0.980和0.791,CFS、FRAIL量表敏感度最高(100.00%),Fried量表特异度最高(96.15%),见图3、表3。
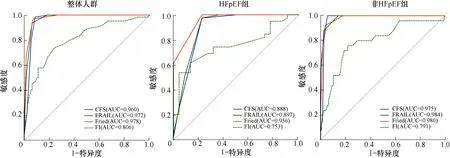
HFpEF:射血分数保留的心力衰竭;CFS:临床衰弱量表;FRAIL:FRAIL量表;Fried:衰弱表型量表;FI:衰弱指数;AUC:受试者工作特征曲线下面积
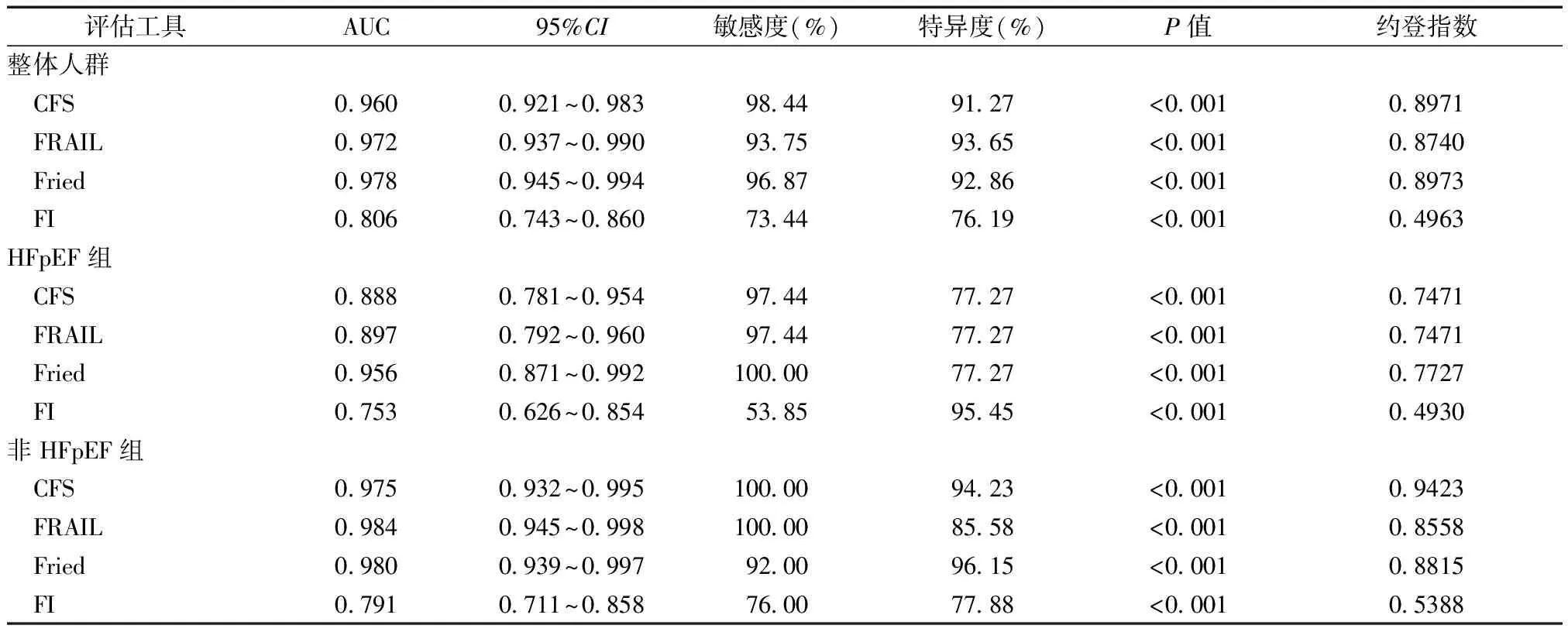
表3 不同衰弱评估工具在不同人群中识别衰弱的敏感度、特异度及AUC
3 讨论
衰弱与慢性心力衰竭均是老年人群中十分常见的临床综合征,两者常常共存[14]。衰弱程度越高,患者的身体功能、日常生活能力、营养状况越差,发生心力衰竭加重、心力衰竭住院、全因住院、心血管疾病死亡、全因死亡的风险更高[15-16]。慢性心力衰竭根据患者的左心室射血分数分为三类:射血分数降低的心力衰竭(HFrEF)、射血分数轻度降低的心力衰竭(HFmrEF)和HFpEF[6]。老年人群中最常见类型为HFpEF,目前有关老年HFpEF合并衰弱人群的相关研究较少。
衰弱的诊断主要依靠量表评定,Buta等[17]通过系统分析筛查了67种衰弱评估工具,其中引用最多的两种是Fried和FI。汤雯等[18]研究发现,目前最多用于心血管疾病的衰弱评估工具包括Fried、CFS、FI及FRAIL量表。近年来,不断有研究关注于探索新的衰弱评估工具,如Yamada等[19]制定的基于衰弱的预后标准(frailty-based prognostic criteria)及Gilbert等[20]基于ICD-10代码所制订的医院衰弱风险评分(Hospital Frailty Risk Score,HFRS),衰弱生物标志物如生长分化因子15(GDF-15)也可用于评估患者的衰弱程度并具有预测不良结局的作用,可考虑作为未来新型衰弱评估工具的一部分[5]。但针对HFpEF人群的衰弱评估量表尚未统一。本研究采用目前临床研究中广泛使用的CFS、FRAIL、Fried、FI四种衰弱筛查与评估方法,拟定CI作为“金标准”,来比较在老年HFpEF人群中不同评估量表的优劣。结果显示,针对同一群体,所使用的衰弱评估工具不同,衰弱的患病率也各不相同,这与先前的研究结果一致[14]。老年HFpEF患者中衰弱的患病率为68.9%至72.1%不等,明显高于整体人群(35.8%~46.3%)及非HFpEF患者(20.9%~35.7%)。
在本研究整体老年人群中,CFS量表具有最高的敏感度(98.44%)和较高的特异度(91.27%),FRAIL量表具有最高的特异度(93.65%)和较高的敏感度(93.75%),两者与CI之间的一致性均较高(Kappa值=0.846、0.861);在非HFpEF人群中,CFS量表与FRAIL量表同时具有最高的敏感度,但CFS量表的特异度与Kappa值均优于FRAIL量表。CFS是一项由专业医护人员完成的简单快速的衰弱筛查工具,采用简单的临床参数,纳入患者的认知损害和功能情况,避免了受患者主观因素的影响。FRAIL量表是在结合衰弱循环理论、累计缺陷模型及功能模型基础上形成的一种自我报告式衰弱评估工具,存在患者主观因素导致的偏倚。既往已有研究证实,CFS量表是一种简单良好的衰弱筛查工具,对衰弱的不良临床结局也有良好的预测作用。综合比较,本研究认为对于一般老年人群及非HFpEF患者,CFS量表可作为优先考虑的衰弱筛查工具。
在老年HFpEF人群中,Fried量表具有最高的敏感度(100.00%)与可接受的特异度(77.27%),而FI量表具有最高的特异度(95.45%),但没有良好的敏感度(55.85%),且Fried量表与CI之间的一致性明显优于FI。这与以往一些研究结果不一致,可能与本研究中HFpEF组患者平均年龄较高有关,FI相比于Fried量表扩展了认知、心理、共病、睡眠等多维健康变量,包含自我报告式问卷内容,高龄老人存在更多的认知功能障碍等问题,以致无法准确判断自己的身体状况;另一方面,高龄老人对于自身健康状况期望值更高,回答一些主观问题时可能更倾向于选择符合自身期望的偏正向的答案。Fried量表通过身体表型从生理层面上诊断衰弱,具有坚实的生物学因果理论基础,可预测包括死亡率在内的多种临床负性事件,是当前应用最广泛的衰弱评估工具[15]。本研究建议对老年HFpEF患者可优先采用Fried量表作为评估工具。
本研究仍有局限:(1)单中心研究,纳入人群为老年心血管科病房住院患者,总体经济条件较好,整体年龄偏大,男性比例较多,样本量有限,心力衰竭患者比例较少,纳入人群存在一定偏倚;(2)横断面研究,未进行不同衰弱评估工具对不良预后事件的预测作用比较;(3)排除了严重认知功能障碍及听力障碍患者,因此不能适用于上述衰弱患者。
综上所述,老年HFpEF人群中衰弱的发生率较高。四种衰弱评估工具中Fried量表对老年HFpEF患者适用性更好,CFS量表对老年整体人群及非HFpEF人群更具优势。
利益冲突:无