PET-CT联合内质网应激标志物检测在非小细胞肺癌化疗效果和预后评估中的应用
陈婧姼,邢 影,杨俊泉
(唐山市人民医院(唐山市肿瘤医院)放化一科,河北 唐山 063000)
影像学方法在晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的临床决策中扮演着至关重要的角色[1]。计算机断层扫描(computed tomography,CT)通过测量肿瘤大小的变化来评估治疗效果,成为该领域的金标准。实体瘤缓解评估标准(Response Evaluation Criteria in Solid Tumours,RECIST)基于CT检查进行标准化评估,由于其简便性和高重复性而广受认可[2]。然而,对肿瘤病灶大小的测量在早期治疗反应的评估中的作用相当有限[3]。近年来,氟代氟脱氧葡萄糖(18F-FDG)正电子发射断层扫描(positron emission tomography,PET)/CT(PET/CT)常用于包括NSCLC在内的多种癌症的早期治疗反应的评估和预测,其在肿瘤临床中的重要性日益凸显[4]。尽管以PET/CT为代表的混合成像技术有了长足的进步,但由于其检查的分辨率和特异性有限,仍存在相当的局限性。因此,需要结合非侵入性检测方法来提供更准确的早期治疗反应评估。
肿瘤内部的异常微环境干扰了细胞内质网的蛋白质折叠能力,导致细胞出现内质网应激(Endoplasmic reticulum stress,ERS)状态,而ERS的持续激活常导致细胞更可能发生恶性转变[5]。最近的研究[6]表明,ERS不仅直接影响肿瘤进展,还通过参与其他重要的生物学过程间接影响肿瘤生长。但是,ERS相关标志物在NSCLC中的生物学特性和临床预后中作用仍缺乏研究。因此,本研究旨在评估血清中ERS相关标志物与18F-FDG PET/CT联合应用于接受一线化疗的晚期NSCLC患者的治疗反应评估和预后监测中的作用。
1 资料与方法
1.1 一般资料
对2017年9月至2022年6月于唐山市人民医院放化一科病理诊断为NSCLC的患者临床资料进行回顾性分析,该时期内的患者均在治疗前2周内接受18F-FDG PET/CT扫描,根据PET/CT及其他影像学检查结果按第7版肺癌TNM分期系统进行分期,且都接受了一线化疗和必要时的额外放疗。
纳入标准为:1)18~75岁;2)临床分期Ⅲ或Ⅳ期;3)美国东部肿瘤协作组活动状态(Eastern Cooperative Oncology Group performance status,ECOG PS)评分0~1分;4)无其他恶性肿瘤病史;5)无急性感染或自身免疫性疾病;6)接受≥4个周期的一线铂类双重化疗。
提取并分析入选患者包括年龄、性别、ECOG PS、吸烟史、病变类型、组织学类型和临床分期在内的数据资料。
1.2 18F-FDG PET/CT扫描和图像分析
在PET/CT扫描仪(美国GE Healthcare公司)上进行18F-FDG PET/CT。患者在接受平均5.5 MBq·kg-1的18F-FDG静脉注射之前,禁食6 h并确保血糖水平<11.1 mmol·L-1。注射1 h后,开始全身PET和CT扫描,范围为头骨底部到大腿近端。CT导出衰减校正之后,通过有序子集期望最大化算法重建PET图像,重建层厚度为4.25 mm,图像矩阵尺寸为128 dpi。CT、PET和融合图像显示在Xeleris工作站(美国GE Healthcare公司)上,由2名经验丰富的诊断专家分别独立地审查PET/CT图像。使用标准摄取值(standard uptake value,SUV)来量化组织对18F-FDG的摄取,并且感兴趣区域(ROI)内的SUV的最高像素值被定义为SUVmax。
1.3 ERS标志物测定
患者在治疗前1周内接受血液ERS相关标志物检查。使用ELISA试剂盒(维百奥(北京)生物科技有限公司)测定血清Tribbles同源蛋白3(TRIB3)、葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)和C/EBP同源蛋白(C/EBP homologous protein,CHOP)水平,批内和批间变异系数(CV)分别为<8%和<10%。
1.4 治疗反应和随访评价标准
治疗完成4周后,采用RECIST1.1评估肿瘤缓解情况和治疗反应。对治疗有反应者分为完全缓解(CR)和部分缓解(PR),无反应者分为疾病稳定(SD)和疾病进展(PD)。客观缓解率=(CR+PR)例数/总例数×100%。
治疗后前2年每3个月随访1次,接下来2年每6个月随访1次。患者总生存期(OS)为治疗开始到死亡或最终随访时间,无进展生存期(PFS)为从治疗开始到诊断为局部复发/远处转移或最终随访时间。
通过病历和电话访谈收集患者随访数据,中位随访时间为16.1个月(4.7~53.2个月),最后一次随访日期是2022年12月10日。
1.5 统计学方法
使用SPSS22.0软件对研究数据进行统计分析。采用Spearman相关系数检验评估SUVmax和ERS指标之间的相关性,通过逻辑回归模型评估各变量和治疗反应的相关性。构建受试者工作特征曲线(ROC),以获得SUVmax和ERS标志物用于识别治疗反应者的最佳临界值,采用Delong检验比较3种ERS标志物的曲线下面积(AUC)。采用Kaplan-Meier曲线和对数秩检验评估患者生存率。以P<0.05为差异有统计学意义。
2 结果
2.1 入选患者临床特征
研究期间,共有84名符合入选标准且对研究知情同意的NSCLC患者参加了本研究,入选患者的基线临床特征见表1。

表1 基线临床特征
2.2 SUVmax与ERS标志物的相关性分析
相关性分析显示,CHOP(r=-0.284,P=0.007)和TRB3(r=0.387,P=0.005)与SUVmax显示出明显的相关性,而GRP78与SUVmax无显著相关性(r=0.086,P=0.443),见图1。

图1 SUVmax与ERS标志物的相关曲线
2.3 SUVmax与ERS标志物的ROC曲线
以SUVmax为指针识别早期治疗反应者的AUC为0.720,最佳截断值为11.47(敏感性72.5%,特异性63.7%),而以CHOP、TRB3和GRP78为指针识别早期治疗反应者的AUC分别为0.786、0.615和0.536,最佳截断值分别为1.73(敏感性65.3%,特异性84.6%)、9.67(敏感性65.2%,特异性56.2%)和124(敏感性46.4%,特异性67.5%),见图2。Delong检验结果表明,CHOP的AUC高于TRB3(ΔAUC=0.167,P=0.004)和GRP78(ΔAUC=0.255,P<0.001)。
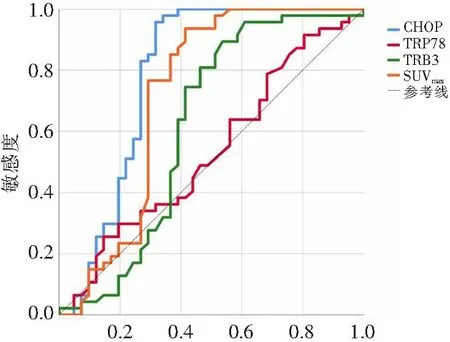
1-特异性图2 SUVmax与ERS标志物的ROC曲线
2.4 治疗反应影响因素的单因素和多因素分析
84名NSCLC患者中CR、PR、SD和PD例数分别为2例(2.4%)、43例(51.2%)、34例(40.5%)和5例(6.0%)。与CR+PR组(客观缓解组)相比,SD+PD组中TNM分期Ⅳ期、ECOG PS评分1分、TRB3>9.67 pg·mL-1、CHOP≤1.73 ng·mL-1和SUVmax>11.47的例数显著增加(P<0.05)。
单因素分析结果显示,年龄>65岁、TNM分期Ⅳ期、ECOG PS评分1分、CEA升高、TRB3>9.67 pg·mL-1、CHOP≤1.73 ng·mL-1和SUVmax>11.47与低客观缓解率有关(P<0.05)。多因素分析结果显示,SUVmax(OR:1.217,95%CI:1.090~1.525,P=0.002)、CHOP(OR:0.140,95%CI:0.062~0.454,P<0.001)和临床分期(OR:1.283,95%CI:1.112~1.718,P=0.009)是客观缓解率的独立预测因素,见表2。
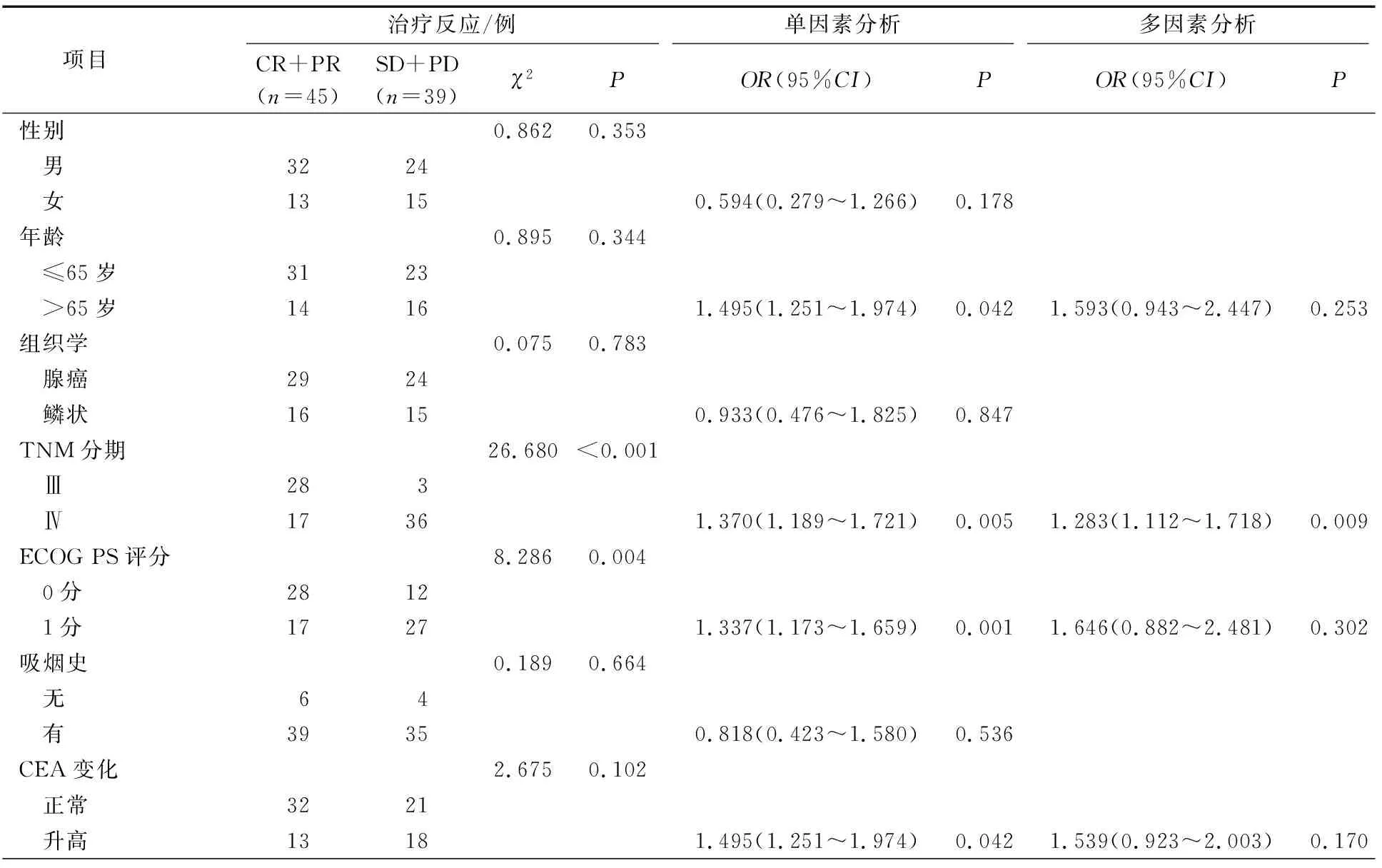
表2 治疗反应影响因素的单因素和多因素分析
2.5 SUV_CHOP评分对治疗反应和生存率的预测价值
前述分析结果显示,SUVmax和CHOP相关性强,且均为NSCLC患者治疗反应的独立影响因素,为了进一步区分治疗结局不同的患者,利用SUVmax和CHOP指标构建一个称为SUV_CHOP的评系统:0分,低SUVmax(≤11.47)、高CHOP(>1.73 ng·mL-1);1分,低SUVmax、低CHOP(≤1.73 ng·mL-1)或高SUVmax(>11.47)、高CHOP;2分,高SUVmax、低CHOP。
根据SUV_CHOP,84名NSCLC患者可分为0分(n=20),1分(n=33)和2分(n=31)3个亚组。比较各亚组之间客观缓解率的差异,0分患者客观缓解率最高,为90%(18/20),而2分患者客观缓解率最低,仅为22.6%(7/31),1分患者的客观缓解率处于中间水平,为60.6%(20/33)。
以SUV_CHOP评分为分组依据,绘制Kaplan-Meier生存曲线,分析SUV_CHOP评分对NSCLC患者的预后价值。得分为0分、1分和2分的患者的中位PFS分别为18.9、13.6和10.6个月(P<0.001),中位OS分别为28.3、19.4和13.4个月(P<0.001),见图3。

图3 不同SUV_CHOP评分患者的Kaplan-Meier生存曲线
3 讨论
SUVmax是通过PET/CT获取的其中一个最为关键的参数,能够准确测量肿瘤的代谢活性并为预后提供有价值的信息。虽然细胞和分子机制尚不清楚,但有研究[7]指出SUVmax与NSCLC癌症增殖和进展相关的生物因素(如Ki-67和VEGF)密切相关。在一项由LI等[8]进行的大型前瞻性研究中,调查了178例NSCLC患者的Ki-67表达和肿瘤FDG摄取之间的关系,结果发现SUVmax与肿瘤组织中的Ki-67分数呈正相关。Ki-67的过表达通常表明活跃的增殖活性和侵袭性生物学行为。另一方面,XIANG等[9]研究发现SUVmax在VEGF高表达患者中显著升高,而VEGF在肿瘤血管生成、侵袭和转移中扮演着关键角色。这些研究结果表明,SUVmax能够反映肿瘤的增殖和血管生成状况,并与预后密切相关。在NSCLC中,多项研究已经证明SUVmax具有预后意义。MALLICK等[10]的研究发现,相比于SUVmax较低的患者,SUVmax≥10的患者更容易发生癌症复发,且生存期较短。更重要的是,他们得出结论SUVmax是一个比TNM分期更强大的独立预后因素。与这些建议一致,本研究证实高SUVmax是化疗反应差的重要预测标志。其机制可能与ERS有关,因为先前的研究通过单细胞RNA测序技术证实SUVmax可能受到肿瘤细胞中ERS相关因子ATF3和NR4A1的调控,这有助于解释高SUVmax与化疗效果差相关的潜在机制[11]。
内质网中的蛋白质合成、修饰和折叠过程是决定细胞功能和命运的关键环节。在多种肿瘤类型中,不同的致癌、转录和代谢异常共同产生了不利的微环境,破坏了恶性和间质细胞中的内质网稳态[12]。这些变化引发了持续的内质网应激状态,这种状态已被证明可以控制癌细胞的多种促肿瘤属性,同时动态地重新编程先天和适应性免疫细胞的功能[13]。因此,内质网应激传感器及其下游信号通路的异常激活已成为肿瘤生长和转移,以及对化疗、靶向治疗和免疫治疗反应的关键调节因子。
CHOP是介导内质网应激诱导的细胞凋亡的特异性转录因子,它在正常细胞中低表达,但在内质网应激中被IRE1α、PERK和ATF6激活,导致mRNA和蛋白表达水平显著增加[14]。大量研究[15]表明,CHOP的过表达可以阻断细胞分裂周期,负调节细胞生长,并诱导细胞凋亡,因此,CHOP被认为是内质网应激最重要的特异性促凋亡因子。最近的研究[16]发现,CHOP过表达通过Bcl-2/JNK途径增强人NSCLC细胞对顺铂的敏感性,表明CHOP可能影响肿瘤治疗反应。此外,CHOP已被证明与NSCLC的临床结局相关,在对107名接受化疗的晚期肺鳞癌患者的回顾性评估中,低CHOP(<2.07 ng·mL-1)可以独立预测不良OS[17]。本研究的数据与这些发现一致,并表明治疗前的低CHOP(≤1.73 ng·mL-1)是不良化疗反应和不良PFS以及OS的重要预测因素。
综上所述,SUVmax代表了原发肿瘤的局部代谢状态,而CHOP则反映了宿主的内质网应激反应。综合评价这两个因素可能更准确、更有效地预测化疗疗效和预后。本研究验证了SUVmax和CHOP之间微弱但显著的负相关关系。因此,本研究建立了一个基于SUVmax和CHOP的评分系统,并证明了其在预测PFS和OS方面的价值,凸显了其潜在的预后意义。在基线情况下,SUVmax≤11.47且CHOP>1.73 ng·mL-1(评分0分)的患者表现出3组中最长的PFS和OS,而治疗前SUVmax>11.47且CHOP≤1.73 ng·mL-1(评分2分)的患者则表现出最差的治疗结果,其OS和PFS明显较差。本研究的另一个亮点是SUV_CHOP评分与一线化疗反应之间的关系。SUV_CHOP评分有望成为治疗反应和预后的预测因子,并可能有助于为晚期患者选择合适的治疗策略。评分为0分的患者对化疗更为敏感,目前以铂类为基础的双重化疗可能是其最佳治疗策略,应该尽早实施化疗。然而,评分为2分的患者对化疗相对不敏感,预后更差,对于这些患者应考虑替代治疗策略,如分子靶向治疗和免疫治疗。

