基于NF-κB信号通路分析电针对腰椎间盘突出症大鼠模型炎症反应的影响
欧阳礼,张萌芮,彭彩钰,张云燕
1.海口市中医医院,海南 海口 570216;2.广西中医药大学,广西 南宁 530001
腰椎间盘突出症是一种常见的脊柱退行性疾病,具体表现为髓核突出损害腰神经根,导致患者出现麻木、放射状疼痛等运动和感觉障碍[1]。该病的发病率较高,研究认为其发病机制主要是由炎症和髓核对神经根的机械压迫引起[2]。目前,手术和保守治疗是该病的主要治疗方法。然而,随着生活方式的改变以及生活质量的提高,椎间盘切除术的手术风险和长期疗效逐渐成为人们关注的问题[3]。中医对腰椎间盘突出症的治疗方法有着多样、连续与无创等特点。在过去的10多年里,电针治疗软组织损伤以及神经损害的前瞻性研究不断增多,证实了在疼痛的状态下电针可以激活患者的神经系统,改善痛觉感受[4]。但目前关于电针治疗腰椎间盘突出症患者的作用机制还不够明确。NF-κB作为一种非常普遍的转录因子,在细胞质中广泛存在,并且可以参与多种免疫反应、炎性反应、细胞增殖与细胞凋亡等有关基因的调节[5]。有研究认为NF-κB信号通路参与腰椎间盘退变的过程,抑制其通路活化,可有效降低患者体内的炎症因子水平,减轻患者的疼痛症状[6]。但目前并未有研究明确指出电针可通过调控NF-κB通路改善腰椎间盘突出症状。因此,本研究主要探究电针通过腰椎间盘突出症模型大鼠NF-κB通路改善炎症反应的作用。
1 材料与方法
1.1 实验动物与分组
选取40只SD大鼠作为研究对象,体质量260 g左右,凯学生物科技(上海)有限公司[生产许可证号:SCXK(沪)2019-0001],饲养于无菌环境中,温度:27 ℃左右;湿度:55%左右,自由进食,适应性喂养1周后进行实验。将其随机分为正常对照组、模型组、假手术组与电针组,每组各10只。本研究经本院医学伦理委员会审批[审批号:HKSZYYYLL-2022(科)-14]。
1.2 仪器与试剂
75%乙醇(国药集团化学试剂有限公司);1%戊巴比妥(上海市第六人民医院动物中心实验室);PCR仪、电泳仪和酶标仪(大龙兴创实验仪器有限公司);兔抗NF-κB p65抗体和兔抗IKBa单克隆抗体、兔抗IKK-β抗体(美国Thermo公司);组织匀浆机(深圳欣博盛生物科技有限公司);离心机和凝胶成像仪(上海无陌光学仪器有限公司)。
1.3 模型制备
模型组和电针组大鼠采用自体髓核移植方法[7],首先腹腔注射1%戊巴比妥(40 mg/kg),背部消毒后剪开背部筋膜,切开右侧L4~S1的棘突,暴露右侧L5背根神经节,切开椎间盘取髓核2 mg,L5DRG及硬膜外腔附近,避免造成机械性压迫,再逐层缝合肌肉与皮肤,构建腰椎间盘突出症模型。假手术组:方法与模型组和电针组相同,在不放置髓核的情况下,从尾部椎间盘取出2 mg髓核,然后逐层缝合肌肉和皮肤。除正常组外,患者在手术后立即置于隔热灯下,并常规重新武装2 h。6 h后,给予食物和水。手术后,腹腔注射10万单位青霉素以防止感染。术后3 d每天用碘伏消毒伤口。
1.4 给药方法
将电针组大鼠固定于固定器上,定位肾俞、大肠俞、环跳与阳陵泉。用75%酒精消毒3遍,选用0.30 mm×25 mm的针灸针直刺进针,进针深度约10~15 mm。接上电针,使肾俞和大肠俞相连,环跳和阳陵泉相连,将低频电子脉冲治疗仪调至连续波(2 Hz,1 mA)模式,每次治疗20 min。在成功建模后的第3天开始治疗,1次/d。其他大鼠在未经治疗的情况下正常喂养[8-9]。
1.5 大鼠后肢热痛刺激缩爪阈值测定
于造模前1 d、造模后3 d和7 d的下午进行测定。使用PL-200型热痛测试仪,将各组大鼠放入检测盒中,打开热光源开关,使热光源检测盒底部的玻璃板上并使其聚集到大鼠右足底中央部,直径大约为4 mm。此时开始计时,致其缩爪停止计时。每只大鼠共检测3次,每次间隔时间10 min,取3次的平均值,然后将大鼠造模前、造模后的热痛刺激缩爪阈值进行统计学分析。
1.6 HE染色观察腰脊神经根形态学变化
处死大鼠后去L5脊神经根放于脱水盒中用酒精进行脱水,将组织块放入溶于酒精和石蜡的透明剂中进行包埋,放入培养箱中。石蜡完全浸入组织块后,连续5 μm切片,然后脱水,脱水后进行染色,最后封片观察各组大鼠腰L5脊神经根的形态结构变化。
1.7 ELISA测定血清TNF-α、IL-1β和IL-6表达
将各组大鼠静脉血液迅速注入EDTA试管中混匀,离心后置于-80 ℃环境中待检,采用ELISA法检测大鼠血清TNF-α、IL-1β和IL-6表达。
1.8 WB测定大鼠NF-κB信号通路蛋白表达
取大鼠L2~L3节段处脊髓背角,将其加入裂解液提取蛋白并采用BCA试剂盒进行蛋白浓度测定,进行定量,然后灌胶,加足够电泳液进行上样,然后进行电泳、转膜,将膜用TBS浸湿后摇动封闭1 h,加IKK-β、NF-κB p65、IkBa抗体(1∶1 000)、4 ℃孵育过夜后加入二抗(1∶3 000) ,37 ℃放置30 min,进行化学发光反应,然后浸入显影液中显色、最后凝胶成像,使用β-actin作为内参。
1.9 PCR检测IKK-β、NF-κB p65及IkBa mRNA表达
提取组织于无酶匀浆器中、加入TRIzol试剂提取总RNA,按逆转录试剂盒说明书要求,将提取的总RNA反转录成cDNA,然后再进行扩增,以β-actin为内参,检测相对表达:ΔCt=目的基因Ct-内参基因Ct。引物序列见表1。

表1 引物序列
1.10 统计学处理
2 结果
2.1 各组大鼠热痛刺激缩爪阈值比较
与造模前比较,造模后3 d模型组和电针组热痛刺激缩爪阈值降低,符合腰椎间盘突出症对痛觉敏感的特点,造模成功,造模后7 d电针组阈值有所升高(P<0.05)。见表2。

表2 各组大鼠后肢热痛刺激缩爪阈值比较
2.2 各组腰脊神经根形态学比较
对照组神经纤维大小相同,神经纤维排列整齐,细胞无明显肿胀;假手术组脊髓神经根无细胞肿胀,无细胞浸润,无明显形态学改变;模型组神经纤维大小不同,排列松散,纤维肿胀;电针组排列松散、纤维肿胀改善,纤维裸露减少。见图1。

注:箭头所指为神经纤维裸露。
2.3 各组血清TNF-α、IL-1β和IL-6表达比较
与对照组比较,模型组、电针组TNF-α、IL-1β和IL-6表达较高,与模型组比较,电针组TNF-α、IL-1β和IL-6表达较低(P<0.05)。见表3。

表3 各组大鼠TNF-α、IL-1β及IL-6比较
2.4 各组大鼠IKK-β、NF-κB p65及IkBa蛋白表达比较
与对照组比较,模型组、电针组IKK-β、NF-κB p65及IkBa蛋白表达较高,与模型组比较,电针组IKK-β、NF-κB p65及IkBa蛋白表达较低(P<0.05)。见表4、图2。
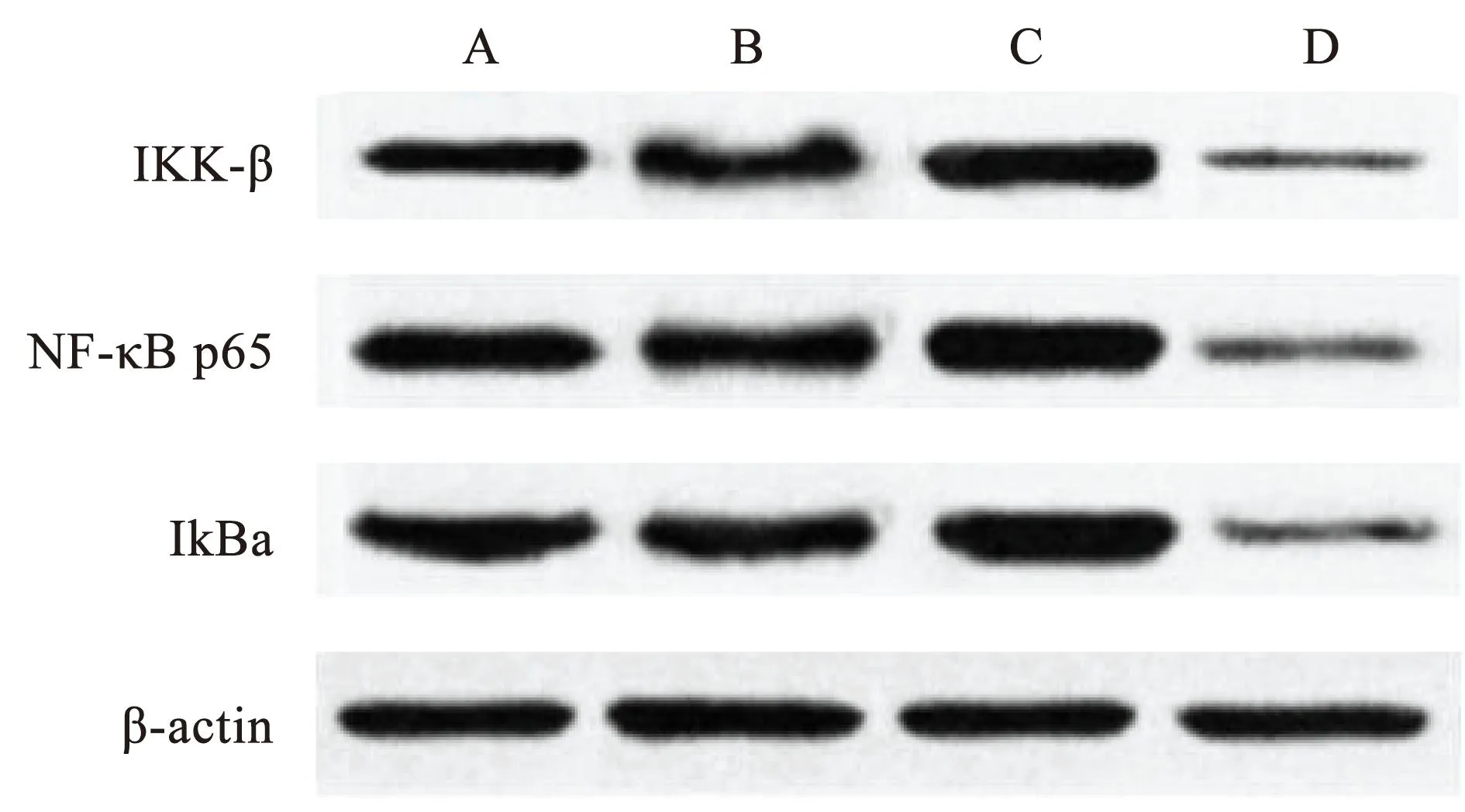
注:A.对照组;B.假手术组;C.模型组;D.电针组。

表4 各组大鼠IKK-β、NF-κB p65及IkBa蛋白表达比较
2.5 各组大鼠IKK-β、NF-κB p65及IkBa mRNA表达比较
与对照组比较,模型组、电针组IKK-β、NF-κB p65及IkBa mRNA表达较高,与模型组比较,电针组IKK-β、NF-κB p65及IkBa mRNA表达较低(P<0.05)。见表5。

表5 各组大鼠IKK-β、NF-κB p65及IkBa mRNA表达比较
3 讨论
腰椎间盘突出症是十分常见的临床疾病,属脊柱退行性疾病,可由生物细胞学、免疫以及年龄等因素引起。该病是在腰椎间盘发生病变的基础上,由于外力或者其他因素导致纤维化破裂、髓核突出等病理变化,会引发脊柱损伤甚至残疾,影响人们正常的工作和生活[10-11]。而腰椎间盘突出症属中医“腰痛”“痹证”等范畴,早在《黄帝内经》中对该病就有过专门的论述:“感于寒,则患者关节……寒湿推于气而为疾也”。在《黄帝内经》中也有记载,治疗时应以月亮的盈亏计算针刺的次数,针后即效[12]。以上均指出腰椎间盘突出症的发病主要是由于腰扭伤或腰身慢性劳损、肾精不足导致肌静脉营养丧失,风、寒与湿的侵袭导致气滞血瘀,经络堵塞,从而引发疾病。对于本病的治疗,应优先考虑非手术治疗方案,如药物治疗、物理治疗、针灸与按摩等,可以有效缓解患者的症状,提高患者的生活质量[13-14]。环跳穴为足少阳胆经与足太阳膀胱经之交会穴,能够疏通腰背部经络,且其周围有臀下神经、坐骨神经分布,对其进行刺激能够缓解患者疼痛[15]。肾俞穴和大肠俞等位置处于足太阳膀胱经,沿背部循行,与腰椎间盘突出症的发生联系紧密,刺激局部可促进炎性因子的代谢及局部血液循环进而缓解症状[16]。目前该病的发病机制还不明确,炎症反应论和自身免疫论较为普遍,而NF-κB信号通路在损伤应答、炎症反应及免疫调控等病理方面具有重要作用。研究发现腰椎间盘突出的发病过程中,NF-κB信号通路得到激活,上调大量的炎性因子表达,若抑制该通路则可以降低炎症水平,缓解疼痛反应[17-18]。因此,本研究拟基于大鼠模型探究电针对腰椎间盘突出症炎症反应的影响及相关机制。见图3。

图3 信号通路作用图
本研究首先对各组大鼠的热痛刺激缩爪阈值进行观察,结果显示:与造模前比较,建模3 d后,模型组和电针组的热痛刺激引起的爪缩回阈值均降低,与腰椎间盘突出症对疼痛敏感的特征一致,表明建模成功,造模后7 d电针组阈值有所升高,说明电针可以改善大鼠的疼痛敏感。其次,本研究针对大鼠的腰脊神经根的病理学变化进行观察,结果显示对照组神经纤维大小相同,神经纤维排列整齐,细胞无明显肿胀;假手术组脊髓神经根无细胞肿胀,无细胞浸润,无明显形态学改变;模型组神经纤维大小不同,排列松散,纤维肿胀;电针组排列松散、纤维肿胀改善,纤维裸露减少。说明电针可改善神经纤维肿胀情况,减少髓鞘节段脱失,改善腰椎间盘突出症大鼠脊神经根的炎症反应。有研究认为在一定程度上电针可以促进神经轴突再生,促进脊髓中生长因子的表达[19],本研究也进一步证明了电针的治疗效果。除此之外,研究认为疾病发生时会引发慢性腰痛,而自身的免疫反应以及慢性炎症因子可能在其中起着一定的作用。例如,TNF-α可以分解介质并促进细胞外基质的降解,同时TNF-α还可诱导神经生长因子使血管神经系统发生炎症反应并诱发疼痛[20]。因此,本研究重点检测了大鼠血清炎症因子表达,结果显示:与对照组比较,模型组、电针组TNF-α、IL-1β和IL-6表达较高,与模型组比较,电针组TNF-α、IL-1β和IL-6表达较低,说明电针可以改善腰椎间盘突出症大鼠炎症反应。NF-κB通路的激活会诱导IL-1 β、TNF-α炎症因子的表达增加引起腰椎间盘髓核组织的炎症反应和腰椎间盘的退行性改变,导致腰椎间盘突出,炎症介质直接刺激周围神经组织产生症状;其次该通路还会诱导腰椎间盘髓核细胞大量凋亡,从而阻止细胞外基质的合成,最终导致腰椎间盘突出症的退行性变性[21-22]。此外,该通路活化会激活IκB,促使NF-κB p65进入到细胞核内,促进炎症介质高表达,加剧炎症反应[23]。NF-κB的活性可由蛋白IKBa所调控,通常情况下IKBa与NF-κB结合时NF-κB通路并不被激活,但炎性因子TNF-α可以通过活化IKK激酶而使IKBa降解,IKBa被降解后相应的NF-ΚB转录因子也不再受抑制,其在被激活后于胞内进行转录[24]。因此,本研究对NF-κB通路相关蛋白表达及mRNA表达进行了检测,结果显示:与对照组比较,模型组、电针组IKK-β、NF-κB p65、IkBa蛋白及mRNA表达较高,与模型组比较,电针组IKK-β、NF-κB p65、IkBa蛋白及mRNA表达较低。说明电针或许可以通过抑制NF-κB通路达到改善腰椎间盘突出症的目的。
综上所述,NF-κB通路在腰椎间盘突出症的发生发展中起到了重要作用,电针可通过调控NF-κB通路来改善腰椎间盘大鼠的炎症反应,且具有镇痛和调节免疫的作用,可作为临床治疗手段。