各年龄段人群血清神经元特异性烯醇化酶与外周动脉硬化的相关性分析
张小琴,辜建伟,杨云凤,李芸,刘菊华
(川北医学院附属医院,1.老年科;2健康管理中心,四川 南充 637000)
外周动脉硬化是心血管事件的独立危险因素,可作为心力衰竭、心肌梗死、脑卒中等心脑血管事件的独立预测因子[1-5]。外周动脉硬化的发病机制较复杂,可能与基质微环境与血管稳态失衡密切相关,细胞外基质(Extracellular matrix,ECM)破坏或血管炎症反应都会导致血管稳态失衡,促进细胞外基质重塑、基质蛋白含量及血管壁结构改变,使血管硬度增加,最终导致动脉硬化的发生与发展[6]。神经元特异性烯醇化酶(neuron specific enolase,NSE)是一种多功能蛋白质,其血清水平与肺癌特别是小细胞肺癌的发生密切相关,而被广泛用于健康筛查[7]。研究[8]显示,NSE还具有降解细胞外基质,促进炎症的发生等作用。因此,猜测血清NSE水平可能与外周动脉硬化相关。但目前关于NSE与动脉硬化的相关研究较少,更缺乏大样本临床研究。本研究旨在分析各年龄段人群血清NSE水平与肱-踝脉搏波传导速度(brachial ankle pulse wave velocity,baPWV)的相关性,了解血清NSE水平对外周动脉硬化的影响。
1 资料与方法
1.1 一般资料
选取2021年3月1日至2021年10月30日于川北医学院体检中心进行常规体检的人群为研究对象。纳入标准:(1)年龄>18岁;(2)对研究目的了解且自愿配合。排除标准:(1)有严重血管病变及下肢血管支架植入术后;(2)急性缺血性、出血性卒中患者;(3)有颅脑损伤患者;(4)患有严重心、肝、肾功能不全患者;(5)未控制的恶性肿瘤患者;(6)明确诊断为肺癌、颅内肿瘤的患者;(7)收集指标缺项者。
1.2 方法
1.2.1 一般临床资料收集 通过调查问卷及一般体格检查收集研究对象的一般资料,包括年龄、性别、身高、体质量、体质量指数(BMI)、收缩压(SBP)、舒张压(DBP)、心率(HR)、高血压、糖尿病病史及吸烟史。
1.2.2 实验室指标 收集研究人群体检当日的空腹血糖(FPG)、同型半胱氨酸(Hcy)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-c)、肌酐(Cr)、尿酸(UA)、白细胞(WBC)、超敏C反应蛋白(Hs-CRP)、中性粒细胞计数与淋巴细胞计数,通过计算中性粒细胞计数与淋巴细胞计数的比值得出中性粒细胞与淋巴细胞比(NLR)。利用免疫化学发光法测定血清NSE浓度,测量仪器为医院检验科所用Cobas E602分析仪(罗氏,瑞士)。
1.2.3 baPWV测定 采用日本欧姆龙科林公司生产的BP-203RPEⅢ型全自动动脉硬化检测仪检测baPWV检查室室温保持22~25 ℃,测量前嘱受试者不吸烟,休息时间>5 min,检查前录入受试者性别、年龄、身高、体质量,嘱其穿薄衣,检测开始后受试者保持安静,去枕平卧,双手手心向上置于身体两侧,将四肢血压袖带缚于上臂及下肢踝部,上臂袖带气囊标志处对准肱动脉,袖带下缘距肘窝横纹2~3 cm,下肢袖带气囊标志位于下肢内侧,袖带下缘距内踝1~2 cm,心音采集装置放于受检者心前区,左右腕部夹好心电采集装置,读取结果。本研究取左、右两侧baPWV的平均值进行分析,参考指南[9],baPWV<1 400 cm/s为外周动脉硬度正常;baPWV≥1 400 cm/s为外周动脉硬化。
1.3 统计学分析
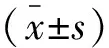
2 结果
2.1 不同年龄段研究人群的临床资料分析
本研究共纳入7 338名研究对象,年龄(47.53±11.64)岁;其中男性4 810例(65.5%),女性2 528例(34.5%)。研究对象根据年龄分组,青年组(年龄≤44岁,n=2 847),中年组(年龄45~59岁,n=3 614),老年组(年龄≥60岁,n=877)。不同年龄组间性别、BMI、SBP、DBP、HR、高血压、糖尿病病史、吸烟史、FPG、Hcy、TG、TC、LDL-c、Cr、UA、WBC、Hs-CRP、NLR、NSE、baPWV比较,差异均有统计学意义(P<0.05)。见表1。
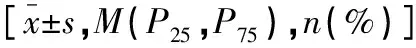
表1 不同年龄组研究对象临床资料与实验室资料特征
2.2 不同年龄组baPWV与各项指标的相关性分析
青年组中,baPWV与上表中各项指标均有相关性(P<0.05);中年组中,除TC、LDL-c两个指标外,baPWV与其余指标均相关(P<0.05);老年组中,除BMI、TC、LDL-c、HDL-c、UA外,baPWV与其余指标均相关(P<0.05)。见表2。
2.3 baPWV与各项指标的逐步线性回归分析
将各年龄组单因素线性回归分析中与baPWV水平相关的变量纳入逐步线性回归分析。结果显示,青年组中,baPWV与血清NSE水平、性别、糖尿病、SBP、TG、WBC、Hs-CRP、NLR相关(P<0.05);中年组中,baPWV与血清NSE水平、高血压、SBP、HR、TG、Cr、Hs-CRP相关(P<0.05);老年组中,baPWV与血清NSE水平、HR、高血压、SBP、Hs-CRP相关(P<0.05);其中年龄越大,baPWV与血清NSE的相关性越高。见表3。
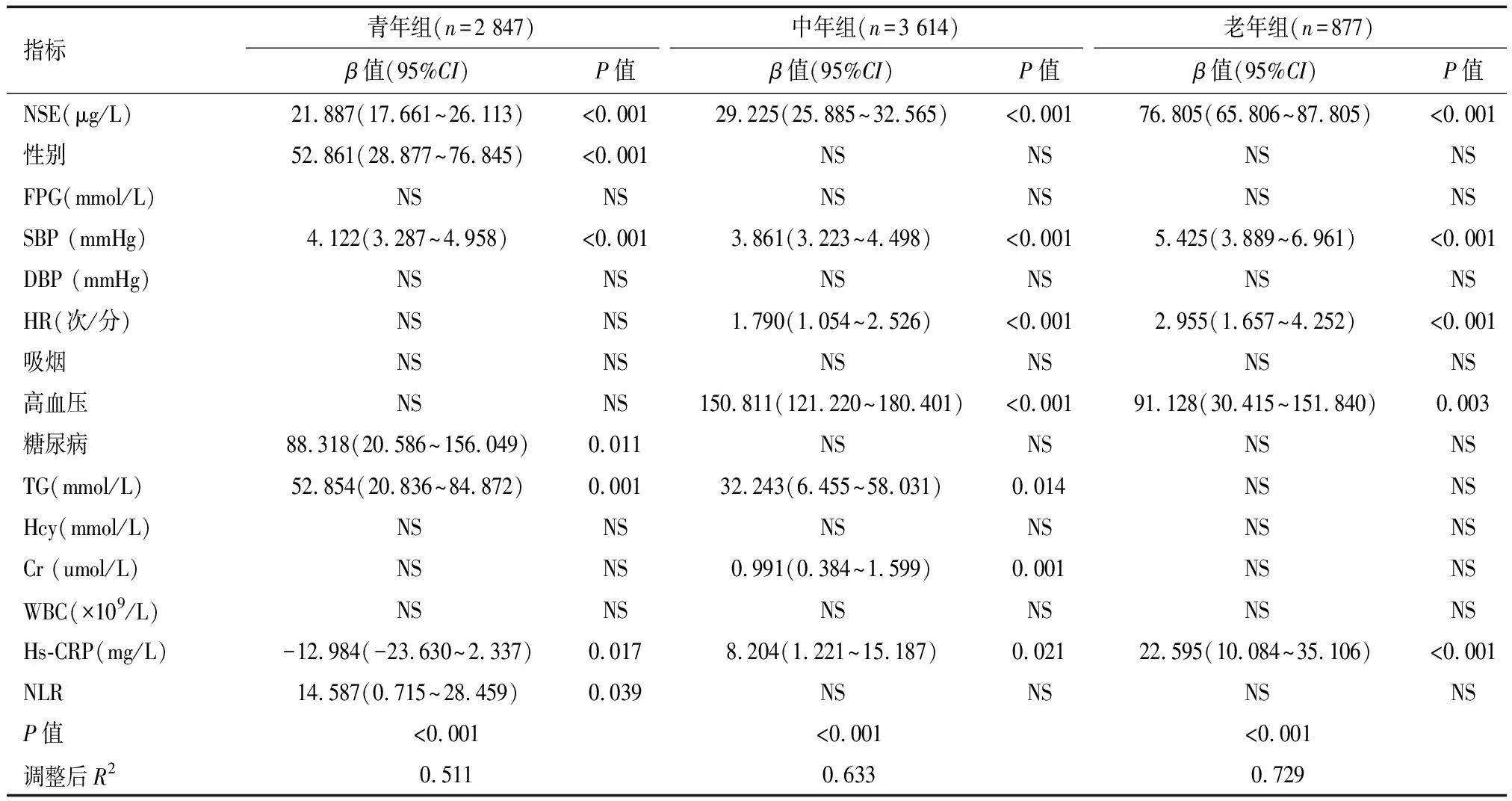
表3 不同年龄组ba-PWV与各项指标的逐步线性回归分析
2.4 二元Logistic回归分析血清NSE浓度与外周动脉硬化相关性
baPWV为评估外周动脉硬度的可靠指标,当baPWV≥1 400 cm/s时可考虑被检查者存在外周动脉硬化。为进一步分析血清NSE浓度对外周动脉硬化的影响,本研究以是否为外周动脉硬化为因变量,赋值:1=外周动脉硬化(baPWV≥1 400 cm/s),0=外周动脉硬度正常(baPWV<1 400 cm/s),将患者临床资料及实验室指标作为自变量,进行二元Logistic回归分析,筛选影响外周动脉硬化的危险因素。青年组,外周动脉硬化的危险因素包括血清NSE浓度、性别、BMI、HR、吸烟、高血压、糖尿病、FPG、SBP、DBP、TC、TG、LDL-c、Hcy、Cr、UA、WBC、Hs-CRP(P<0.05),HDL-c是外周动脉硬化的保护因素(P<0.05);中年组,外周动脉硬化的危险因素包括血清NSE浓度、性别、BMI、HR、吸烟、高血压、糖尿病、FPG、SBP、DBP、TG、Hcy、Cr、UA、WBC、Hs-CRP、NLR(P<0.05),HDL-c仍是外周动脉硬化的保护因素(P<0.05);老年组,外周动脉硬化的危险因素包括血清NSE浓度、HR、吸烟、高血压、糖尿病、FPG、SBP、DBP、TG、Cr、WBC(P<0.05)。见表4。

表4 二元Logistic回归分析影响外周动脉硬化的危险因素
NS:差异无统计学意义。
2.5 各年龄组血清NES四分位水平与外周动脉硬化的比值
为进一步分析随着血清NSE浓度梯度的增加,不同年龄段研究人群发生外周动脉硬化的风险是否会逐步增加,本研究进一步将研究人群按血清NSE浓度四分位数进行分组。在青年组,血清NSE四分位数分组为Q1组:<10.33 μg/L,Q2组:10.33~11.84 μg/L,Q3组:11.85~14.06 μg/L,Q4组:>14.06 μg/L,调整相关影响因素后,随着血清NSE浓度递增,其发生外周动脉硬化的风险无显著增加(P>0.05)。在中年组,血清NSE四分位数分组为Q1组:<11.94 μg/L,Q2组:11.94~14.20 μg/L,Q3组:14.21~16.55 μg/L,Q4组:>16.55μg/L,调整相关影响因素后,与Q1组相比,Q2、Q3、Q4各组发生外周动脉硬化的OR值逐步递增,其OR值(95%CI)分别为:5.129(1.461~18.002)、28.636(8.570~95.684)、30.410(8.814~104.913)(P<0.05)。在老年组,血清NSE四分位数分组为Q1组:<15.31 μg/L,Q2组:15.31~17.42 μg/L,Q3组:17.43~17.99 μg/L,Q4组:>17.99 μg/L,调整相关影响因素后,与Q1组相比,Q2、Q3、Q4各组发生外周动脉硬化的OR值逐步递增,其OR(95%CI)分别为:14.564(1.648~128.718)、85.098(9.993~724.657)、544.224(59.425~4 984.111)(P<0.05)。见表5。
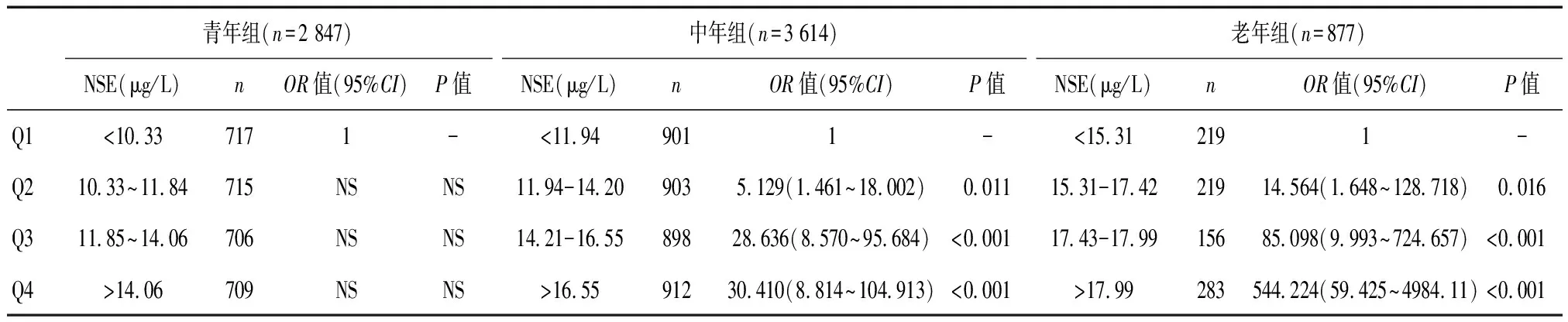
表5 各年龄组血清NES水平与外周动脉硬化的比值比
Q1、Q2、Q3、Q4分别为不同年龄组NSE的四分位分组;NS:无统计学意义;-:作为比较参考值,未纳入统计;青年组校正危险因素:性别、体重指数、空腹血糖、收缩压、舒张压、心率、胆固醇、甘油三酯、低密度脂蛋白、高密度脂蛋白、同型半胱氨酸、肌酐、尿酸、白细胞、超敏C反应蛋白、吸烟、高血压、糖尿病;中年组校正危险因素:性别、体重指数、空腹血糖、收缩压、舒张压、心率、甘油三酯 、高密度脂蛋白、同型半胱氨酸、肌酐、尿酸 、白细胞、超敏C反应蛋白、NLR、吸烟、高血压、糖尿病;老年组校正危险因素:空腹血糖、收缩压、舒张压、心率、甘油三酯 、肌酐、白细胞、NLR、吸烟、高血压、糖尿病。
3 讨论
外周动脉硬化是指除心脏大血管及脑血管外的血管硬化,是外周动脉疾病的主要病因,也是外周动脉疾病的重要类型。动脉硬化的成因复杂,目前认为动脉硬化是衰老的结果,与年龄密切相关[10],在其发生发展的过程中受到多种因素的影响。Shah等[11]对1159名糖尿病患者的随访研究发现,甘油三酯和糖尿病病程是动脉硬化的危险因素,合并代谢综合征的患者动脉硬化的进展速度更快。
此外,炎症介质在动脉硬化发生及进展中的作用也是近年的研究热点,炎症介质与动脉硬化的发生发展相关,而适当的抗炎治疗会降低动脉的僵硬度[12]。Liu等[13]研究发现,白细胞总数升高会导致血管损伤,介导动脉硬化的发生及发展,Wang等[14]的研究也发现,对于2型糖尿病患者而言,NLR是动脉硬化的独立影响因素。本研究选取了血白细胞计数,Hs-CRP及NLR三个在体检人群中较易获得的炎症指标,在单因素线性回归分析中,以上三个指标在各年龄段研究人群中均与baPWV相关(P<0.05),纳入多因素线性回归模型后,Hs-CRP仍与baPWV相关(P<0.05)。
本研究进一步发现血清NSE浓度为baPWV的独立影响因素,与外周动脉硬化密切相关。NSE因其特异性存在于神经细胞及神经内分泌细胞中而得名。越来越多的研究[15]发现,在血小板、红细胞、前列腺、乳腺组织和子宫、精原细胞、肌上皮细胞,心脏和肾脏的致密细胞等非神经系统细胞中也有NSE的存在,因此在大量神经系统以外的疾病中仍可观察到NSE的升高[16-17]。本研究发现,各年龄段人群中,随着血清NSE浓度的增加,baPWV也随之增加,在中年及老年人群中,随着NSE浓度递增,其发生外周动脉的风险也逐步增加。其机制可能与NSE可降解ECM、促进炎症反应、导致基质微环境及血管稳态失衡相关。首先,NSE可促进细胞表面的纤维酶原活化,从而达到降解ECM的作用[18-19];其次NSE可以通过激活PI3K和MAPK通路促进炎性细胞因子和趋化因子如TNF-α、IL-1β、INF-γ、TGF-β和MCP-1的产生,从而促进炎症反应;最后NSE还可以改变氧化还原反应平衡,加重细胞变性及损伤[20]。目前已有相关研究[21-22]表明,利用ENOblock(烯醇化酶抑制剂)抑制NSE可降低血清中NSE水平,减少纤溶酶的活化,降低血清中的炎症细胞因子和趋化因子水平,从而达到减少ECM降解及抑制炎症反应的作用,但ENOblock是否可在血清NSE水平增高人群中延缓外周动脉硬化的发生发展还需要进一步研究。
综上,本研究证实,在各年龄组人群中,血清NSE浓度越高,baPWV数值越大,血清NSE水平是外周动脉硬化的独立危险因素,随着NSE浓度梯度递增,中年及老年人群发生外周动脉硬化的风险也逐步递增,降低血清NSE水平是否可延缓外周动脉硬化仍需要进一步研究。

