Beckmann重排反应的综合性实验设计与教学应用
周建钟,郭明,陶厚璜,郑泽涛
浙江农林大学化学与材料工程学院,杭州 311300
脂肪酮和芳香酮都可以与羟胺作用生成肟,肟在酸性催化剂如硫酸、五氯化磷或多聚磷酸作用下发生分子重排生成酰胺的反应称为Beckmann重排。反应通过缺电子的氮原子进行,反应过程如图1所示,首先酸活化酮肟中的羟基使其形成易离去基,接着,处于羟基反侧的烷基带着一对电子迁移到氮原子上,得到亚胺碳正离子(和氰基氮正离子为共振式),水进攻碳正离子再互变异构得到酰胺。在这个重排反应中,R的迁移与离去基团的脱离是协同进行的,重排结果是:羟基和它处于反位的基团对调位置(反式位移)[1,2]。Beckmann重排不仅可以用来测定酮的结构,而且在有机合成,上也有实用价值。例如,环己酮肟经Beckmann重排生成己内酰胺,己内酰胺开环聚合可得到聚己内酰胺树脂(尼龙6),是一种性能优良的高分子材料[1–4]。
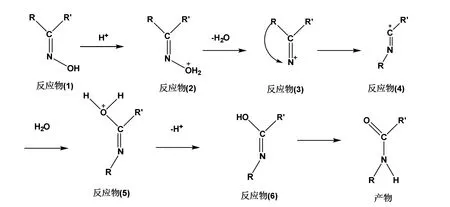
图1 Beckmann重排反应机理
Beckmann重排反应是有机化学的典型实验,查阅有关文献[4–7]以及国内外实验教程,其不足之处一是综合性不够;二是实验细节因条件不同而产生不同产物;三是实验过程中气味大。通过设计改进,减少合成反应中气味大的缺点的同时,综合应用了有机物表征分析手段,甄别产物结构与特性,达到Beckmann重排反应实验原理直观、机理佐证完善的结果。本综合实验设计与实施对学生理解Beckmann重排反应理论知识和提升创新思维能力具有重要促进作用,显著提高了实验教学效果。
1 方案设计与实验
1.1 主要试剂和仪器
采用二苯甲酮与盐酸羟胺反应生产二苯甲酮肟;二苯甲酮肟在多聚磷酸催化作用下发生分子重排,生成苯甲酰基苯胺[4]。所用化学试剂见表1。

表1 Beckmann重排反应化学试剂
为比对原料二苯甲酮、产品二苯甲酮肟与重排产物苯甲酰基苯胺结构区别,对原料与产品进行表征,使用仪器见表2。

表2 实验与表征仪器一览
1.2 二苯甲酮肟Beckmann重排,理化性能与结构表征
利用乙醇为溶媒,二苯甲酮与盐酸羟胺作用生成二苯甲酮肟;二苯甲酮肟在多聚磷酸(PPA)催化作用下发生分子重排,生成苯甲酰基苯胺[1–4],化学反应方程式如图2所示。
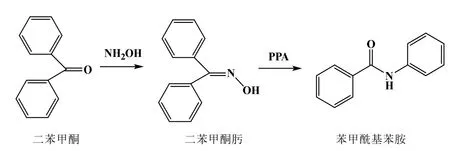
图2 二苯甲酮肟与苯甲酰基苯胺的重排反应方程式
在该重排反应中,二苯甲酮肟在多聚磷酸催化作用下苯基迁移到缺电子的氮原子上,形成缺电子的―N=C+―,与水缔合,失去氢质子,形成苯甲酰基苯胺。
1.3 原料与产品制备
二苯甲酮肟的制备[4]:在125 mL锥形瓶中,将2.5 g二苯甲酮及1.5 g羟胺盐酸盐溶解在5 mL乙醇和1 mL水中,剧烈振荡下加入2.0 g固体氢氧化钠,继续震荡5 min后,回流15 min,此时尚有少许氢氧化钠固体存在。稍冷后,转入一个事先装有8 mL浓盐酸和50 mL水的烧杯中,二苯甲酮肟即以白色粉状结晶析出。冷却后抽滤,用少量冷水(或冰水)洗涤,并用约20 mL乙醇重结晶。抽滤,并在滤纸上压干,测定熔点,其余产品供下一步重排反应用。
二苯甲酮肟的重排:在100 mL烧杯中放入25 mL PPA和余下的二苯甲酮肟(可用未经干燥的产品),装上回流装置,在油浴中加热,慢慢升温到100 °C,重排按预期发生(小心加热)。回流20 min后,充分搅拌下升温至125–130 °C,保持温度继续回流10 min后,将黏稠液小心倒入350 mL左右冰水中,不断搅拌,立即析出大量白色固体,抽滤,用少量冷水洗涤,并用约20 mL乙醇重结晶。所得苯甲酰基苯胺为白色针状结晶。
2 结果与讨论
采用熔点测定仪测定原料二苯甲酮、产品二苯甲酮肟、重排产物苯甲酰基苯胺的熔点,用Nicolet6700傅里叶红外分光光度计测红外光谱,Bruker 400M核磁共振波谱1H NMR测定核磁共振谱图,将红外光谱和核磁谱图数据导入Origin软件绘制谱图,并对光谱进行解析[1,5,6]。
2.1 二苯甲酮、二苯甲酮肟、苯甲酰基苯胺产品形状与熔点
二苯甲酮、二苯甲酮肟、苯甲酰基苯胺产品性状与熔点见表3。

表3 原料与产品物理性状一览
由表3可见,二苯甲酮、产品二苯甲酮肟、重排产物苯甲酰基苯胺熔点有明显差异。
2.2 二苯甲酮、二苯甲酮肟、苯甲酰基苯胺红外吸收光谱表征
二苯甲酮、二苯甲酮肟的红外光谱见图3、图4。观察到在3252.99、1749.32、1440.52 cm−1处归结为二苯甲酮芳香环内C―H、C=O、C=C伸缩振动峰,而1618.26 cm−1出现新的峰归结于二苯甲酮肟C=N伸缩振动峰,同时1749.32 cm−1的峰消失,综上所述,可以证明二苯甲酮肟复合成功。

图3 二苯甲酮的红外光谱图
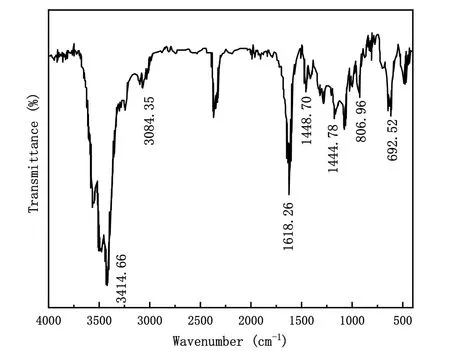
图4 二苯甲酮肟的红外光谱图
二苯甲酮肟Beckmann重排成苯甲酰基苯胺,红外光谱见图5。3410.43、1487.83、1453.91 cm−1分别是芳香环内C―H、C=C、C―N伸缩振动峰,在3189.57 cm−1处出现新的峰归因于―NH伸缩振动,同时1618.26 cm−1处的C=N―特征峰消失,3233.04 cm−1出现新的特征峰归结于二苯甲酮肟在多聚磷酸(PPA)催化作用下发生分子重排产生C=O伸缩振动。综上所述,可以证明苯甲基酰胺复合成功。此外,峰的吸收频率与基团振动形式见表4。
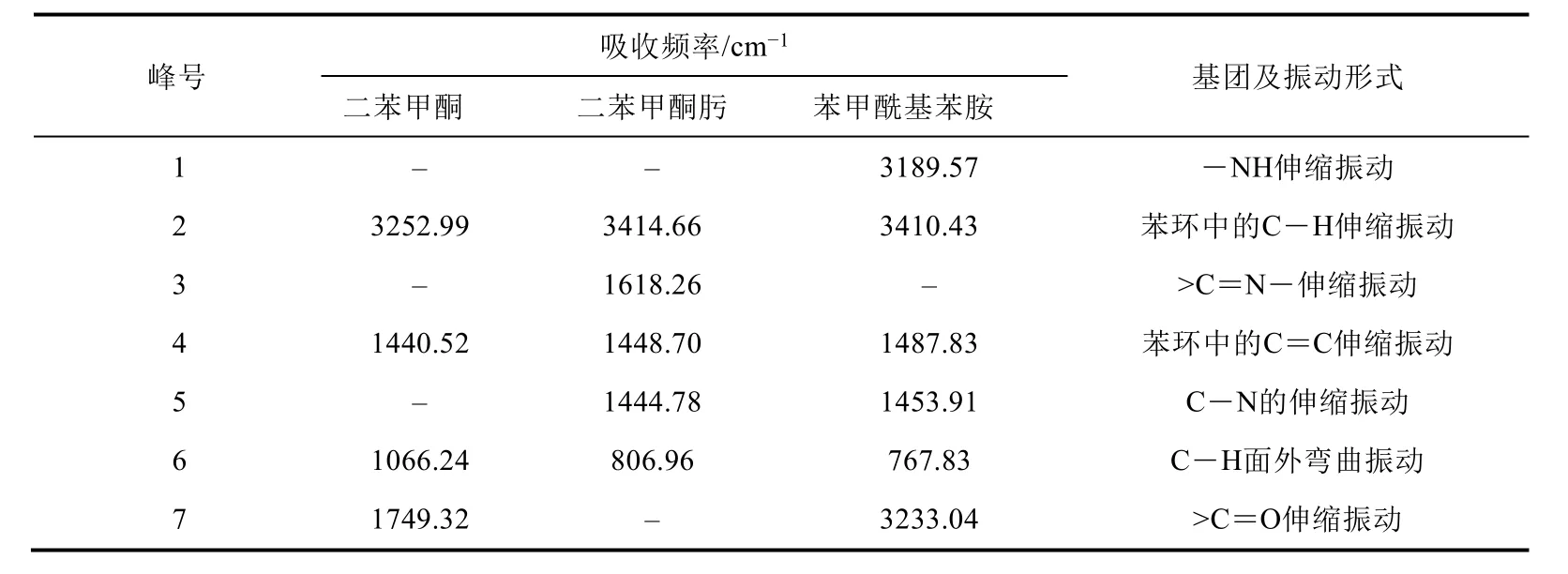
表4 产物结构不同红外峰值变化
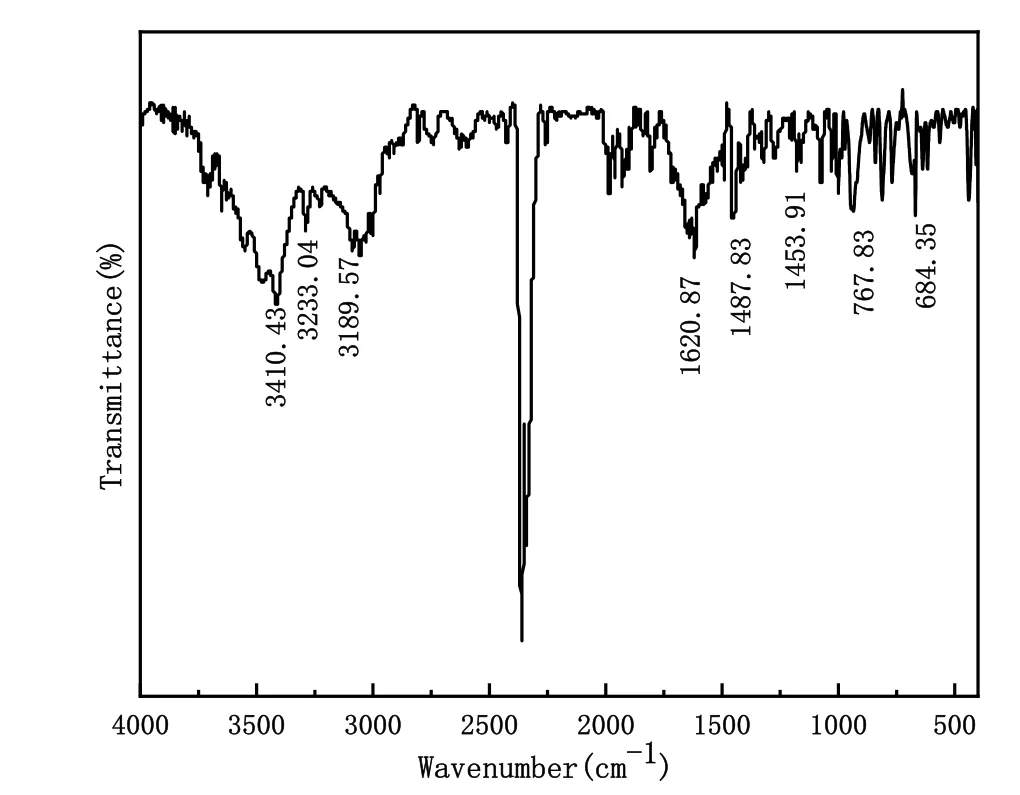
图5 苯甲酰基苯胺红外光谱
由表4可知,―NH、―C=N―、C=O等为特征基团,这些基团均与二苯甲酮肟和苯甲酰基苯胺的结构相对应。通过吸收频率与化合物基团振动的关系,对比文献推定结构,培养学生判断推理能力,以培养学生的科学实践能力。
2.3 二苯甲酮、二苯甲酮肟、苯甲酰基苯胺的核磁波谱表征
Bruker 400 M核磁共振波谱1H NMR测定二苯甲酮的核磁共振谱图,结果见图6。
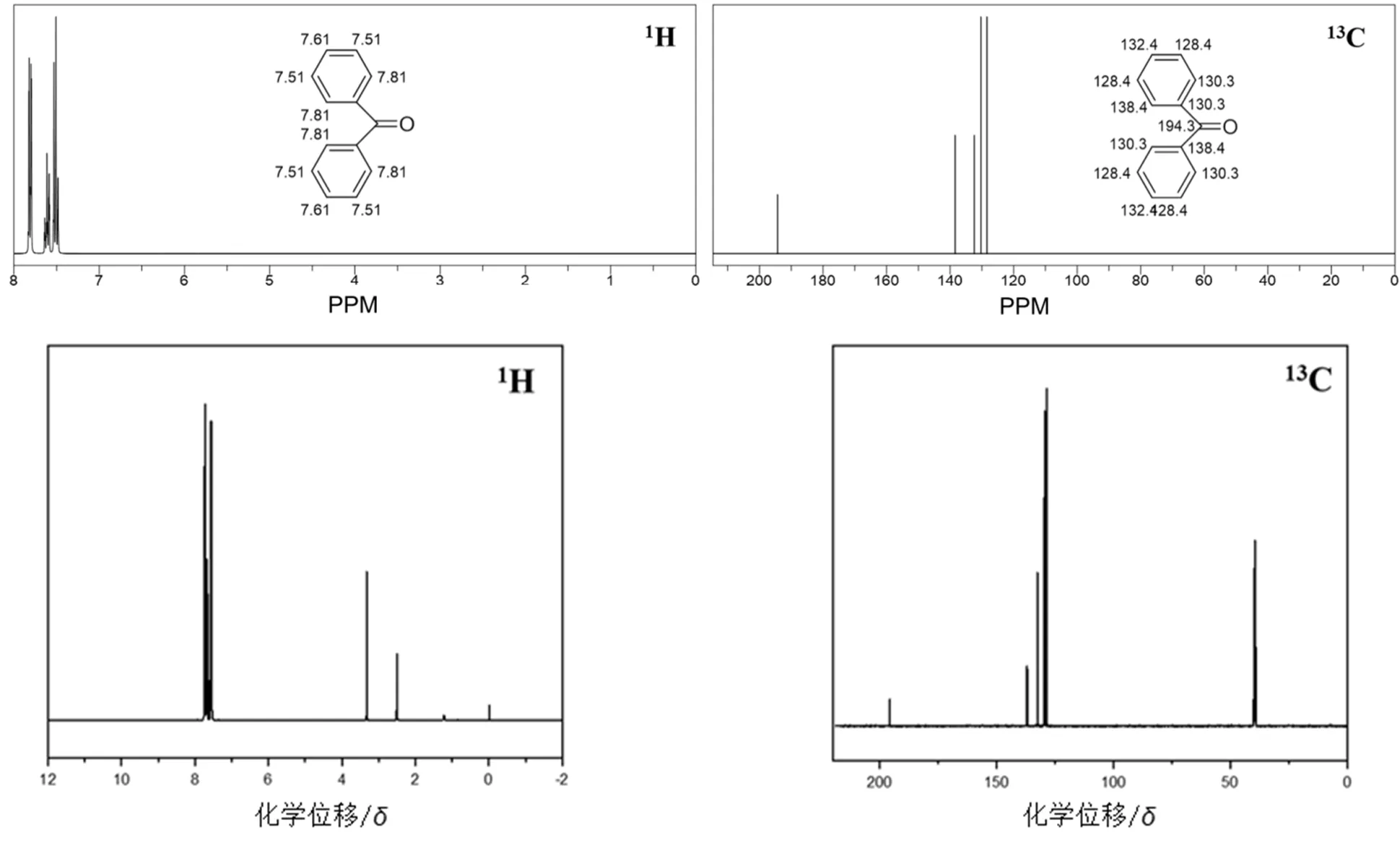
图6 二苯甲酮chemdraw模拟谱图与实验合成的氢谱和碳谱图
二苯甲酮肟的1H NMR和13C NMR见图7。1H NMR (400 MHz, DMSO-d6)δ7.78–7.71 (m, 2H),化学位移在7.78–7.71范围,可以推断为相邻的芳香环上的氢原子。而7.71–7.65 (m, 1H), 7.61–7.53 (m,2H);为芳香环上的氢原子;此外根据13C NMR (101 MHz,DMSO),δ:195.74 (s),表明δ195.74可能是酮基的碳原子。136.98 (s), 132.59 (s),129.59–129.41 (m), 128.55–128.44 (m)为芳香环上的碳原子,因此可以推断成功合成二苯甲酮肟。

图7 二苯甲酮肟chemdraw模拟谱图与实验合成的氢谱和碳谱图
苯甲酰基苯胺的1H NMR和13C NMR见图8。1H NMR (400 MHz, DMSO-d6)δ7.76–7.71 (m, 2H),表明在化学位移7.76出现新的峰,可以归为苯甲酰基苯胺上的单氢原子。苯甲酰基苯胺碳谱13C NMR(101 MHz,DMSO),δ:195.73 (s),136.98 (s), 132.58 (s), 129.50 (s), 128.48 (d,J= 12.8 Hz)表明碳谱中酮基的碳原子的化学位移为195.73,与二苯甲酮肟δ195.74十分相近,表明苯甲酰基苯胺和二苯甲酮肟在结构上存在差异,因此证实成功合成苯甲酰基苯胺。
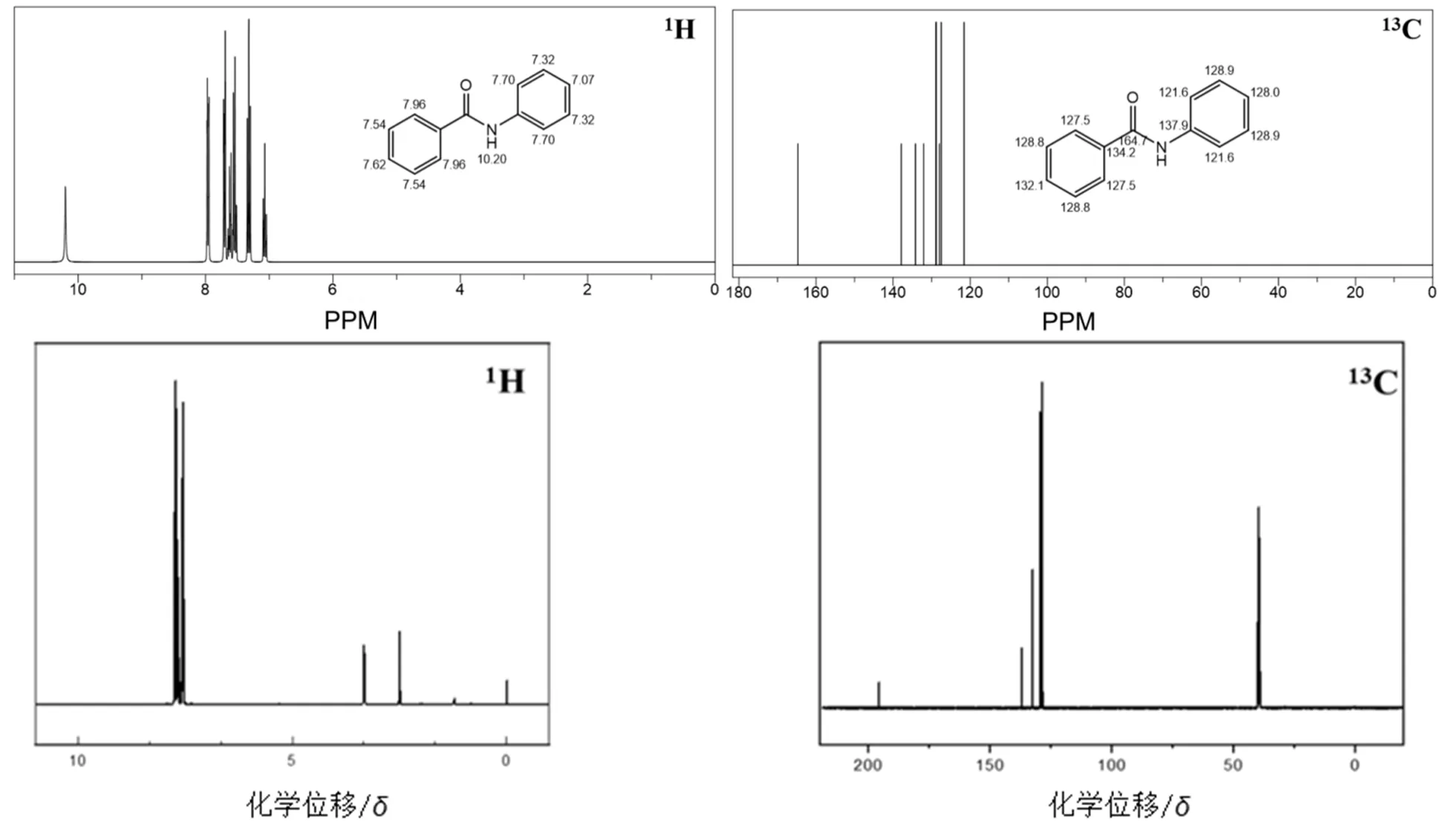
图8 苯甲酰苯胺chemdraw模拟谱图与实验合成的氢谱和碳谱图
3 教学探讨与实践
3.1 Beckmann重排的课堂教学设计
在教学中,实验室提供十余种催化剂,供学生在实验设计中选择,学生设计的方案通过PPT演示,在教师主导下班级同学相互进行评审、修改,然后实施实验方案,我们在教学中收集实验数据,汇总于表5。

表5 二苯甲酮肟Beckmann重排催化剂选择与反应条件
采用乙腈做溶剂的方案,反应完成后,用乙酸乙酯萃取3次,合并有机层,加入饱和氯化钠溶液洗涤,分液后,有机层用无水硫酸钠干燥,过滤,将滤液放入旋转蒸发仪蒸馏回收溶剂,产品晾干称重,计算得率。
3.2 实验指导中的几个关键因素
采用不同催化剂,会使用不同溶剂,产物分离、结晶手段不同。用水或乙醇做溶剂,采用结晶的方法析出,如果溶液没有达到过饱和状态,产率会下降很多,或者得不到结晶,可采用浓缩后结晶或加入氯化钠盐析结晶的方式。无机催化剂采用乙腈做溶剂,反应完成后通过乙酸乙酯萃取,用无水硫酸钠干燥,通过减压蒸馏装置或旋转蒸发仪蒸馏溶剂[2,5],得到产物,这时要重点关注压力与蒸馏温度。
3.3 鼓励前沿路线设计合成
除了二苯甲酮肟与苯甲酰苯胺间的重排,也可以根据重排反应的机理,布置学生在查阅文献的基础上设计其它的Beckmann重排反应,为不同年级段本科生、研究生提出合适的教学课题。
案例1:环己酮肟与己内酰胺的重排,重排反应方程式见图9,通过不同的Beckmann重排反应[3,7],以达到熟练掌握Beckmann重排反应机理,提高产品设计能力。
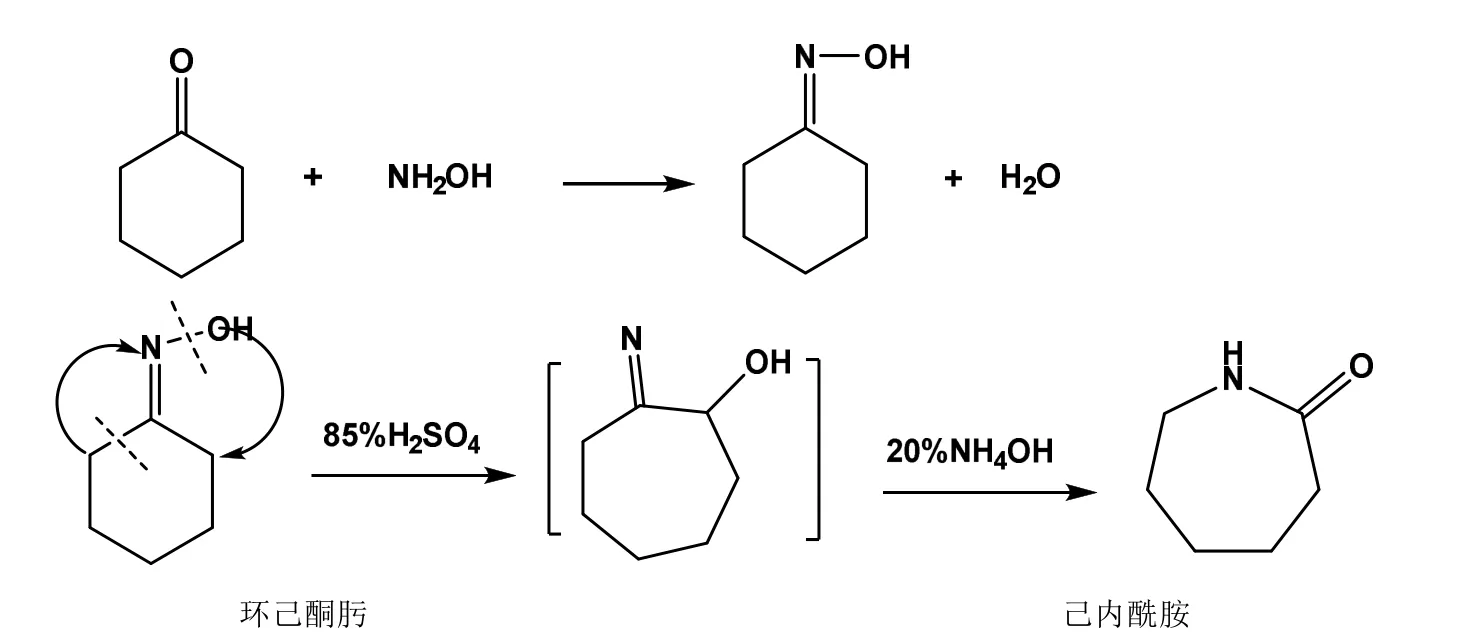
图9 环己酮肟与己内酰胺的Beckmann重排
案例2:阿奇霉素是由红霉素肟经贝克曼重排反应、还原反应和甲基化反应得到。红霉素肟的贝克曼重排反应是阿奇霉素合成的标志性反应,通过此反应,将红霉素的十四元环扩大为十五元环。红霉素肟有E、Z两种构型,它们之间可以相互转化而达到平衡,E肟和Z肟Beckmann重排反应方程式见图10,所用的肟都是E肟与Z肟的混合物。由于在贝克曼重排过程中,构型不会发生变化,因此,反应后E肟重排产物和Z肟重排产物的质量分数应当分别与原料中E肟和Z肟的质量分数保持一致[7–9]。

图10 E肟和Z肟Beckmann重排
案例3:通过文献查阅,指导本科毕业生、鼓励研究生设计新型的Beckmann重排反应新路线[7,8],前沿Beckmann重排路线见表6。

表6 Beckmann重排反应前沿路线
案例1中己内酰胺是尼龙66的主要成分,作为本科综合设计性实验,为适应社会现实需要而提出;案例2阿奇霉素医学上用于敏感细菌所引起的感染,通过红霉素肟的分子重排反应取得药物分子;案例3包含多种杂环分子重排,本科毕业生或研究生选择其中某一热点问题进行研究,通过选题,设计路线,开展实验研究,找出创新性点和应用价值,撰写毕业论文或创新性论文。
不同专业不同层次的学生,在查阅文献基础上,设计合成路线,形成实验方案, 在教师的审核后开展综合性创新性实验,视学生合成与表征的情况,指导学生写成论文报告,其中优质的论文指导发表。

