非甾体抗炎药修饰查尔酮衍生物的制备和表征
*李永莲 马晓敏 杨杰 庄翔智 蔡楚冰 游宗霖 刘文锋*
(1.广东轻工职业技术学院生态环境技术学院 广东 510300 2.五邑大学生物科技与大健康学院 广东 529020)
炎症是由各种来自外部的损伤因子给机体带来有害刺激所致的以防御性反应为主的病理过程。一般来说,微生物感染和组织受损等不利于机体内环境保持稳定的因素均可引发炎症。最常见的损伤因子是细菌、病毒等微生物及其排出的内毒素和对机体有害的生物因子,是导致炎症产生的关键因素。国内外很多报道显示,通过化学合成的方法对非甾体抗炎药进行结构修饰,有望提高其本身的生物活性,减少毒副作用的发生[1]。另外,文献[2]报道查尔酮类化合物具有安全低毒且具有众多生物活性的优点。
因此,本文受查尔酮生物活性多样性的启发,以2-羟基查尔酮为基本骨架,利用非甾体抗炎药以分子拼接的方式对该基本骨架进行结构修饰,以期找到一个或数个抗炎活性较好的新型化合物,为研发新型抗炎药物提供理论支持。
1.试验部分
(1)试验试剂
2-羟基查尔酮、阿司匹林、布洛芬、萘普生、甲灭酸、氟灭酸、依托度酸、吲哚美辛、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDCI)和二甲氨基吡啶(DMAP)纯度均为97%,阿拉丁公司;二氯甲烷、碳酸氢钠和无水硫酸钠,分析纯,大茂化学试剂厂。
(2)试验仪器
圆底烧瓶(100mL),集热式磁力恒温搅拌器(DF-101S),江苏省金坛市正基仪器有限公司;循环水式多用真空泵(SHB-Ⅲ),郑州长城科工贸有限公司;旋转蒸发仪(R-1001N),郑州长城科工贸有限公司;三用紫外灯箱(WFH-203B),上海精科有限公司;电子天平(AL204),梅特勒-托利多(中国)公司;核磁共振分析仪(AVANCE NEO 500),德国Bruker公司。
(3)查尔酮衍生物的合成
将1.0mmol非甾体抗炎药(NSAIDs)、1.0mmol 2-羟基查尔酮、1.2mmol EDCI和0.1mmol二甲氨基吡啶(DMAP)置于圆底烧瓶中,加入20mL干燥的CH2Cl2,待完全溶解后室温搅拌反应1h,静置点板(TLC)跟踪反应。待反应完成后,用饱和NaHCO3洗涤3次,无水Na2SO4干燥过滤,减压蒸馏除去溶剂,柱层析(乙酸乙酯:石油醚=1:6)分离提纯得到目标化合物1~7。
(4)查尔酮衍生物的表征
目标化合物首先经氘代氯仿溶解后,装入核磁管中备用。然后,使用AVANCE NEO 500核磁共振分析仪进行测试。原始数据经MestReNova软件解析后并导出相应的1H-NMR谱图和13C-NMR谱图。

图1 化合物1~7的合成路线图
2.结果与讨论
(1)查尔酮衍生物的结构鉴定
本文合成的查尔酮衍生物2的1H-NMR谱图和13C-NMR谱图如图2所示,图2是化合物2的1H-NMR谱图,其中化学位移(δ)为7.06~7.63的氢归属于苯环上的氢,理论产物的苯环上氢的个数为13个,图2显示苯环上氢的总数为13个;δ为7.05的氢有两个,这两个氢归属于查尔酮上双键上的氢,与理论个数相符;δ为3.86~3.90的氢则属于布洛芬结构上与羧基相连的次甲基上的氢;δ为2.44的氢归属于亚甲基上的氢原子,氢的实际个数有两个,与理论个数相符;δ为1.85的氢则是另外一个次甲基上的氢原子化学位移;δ为1.52和0.91的氢归属于甲基上的氢原子,氢的个数为9个,与理论个数一致。因此,根据化合物2的1H-NMR谱图可知,化合物2中氢原子的总数为28个,与目标化合物2的理论氢原子个数相符。
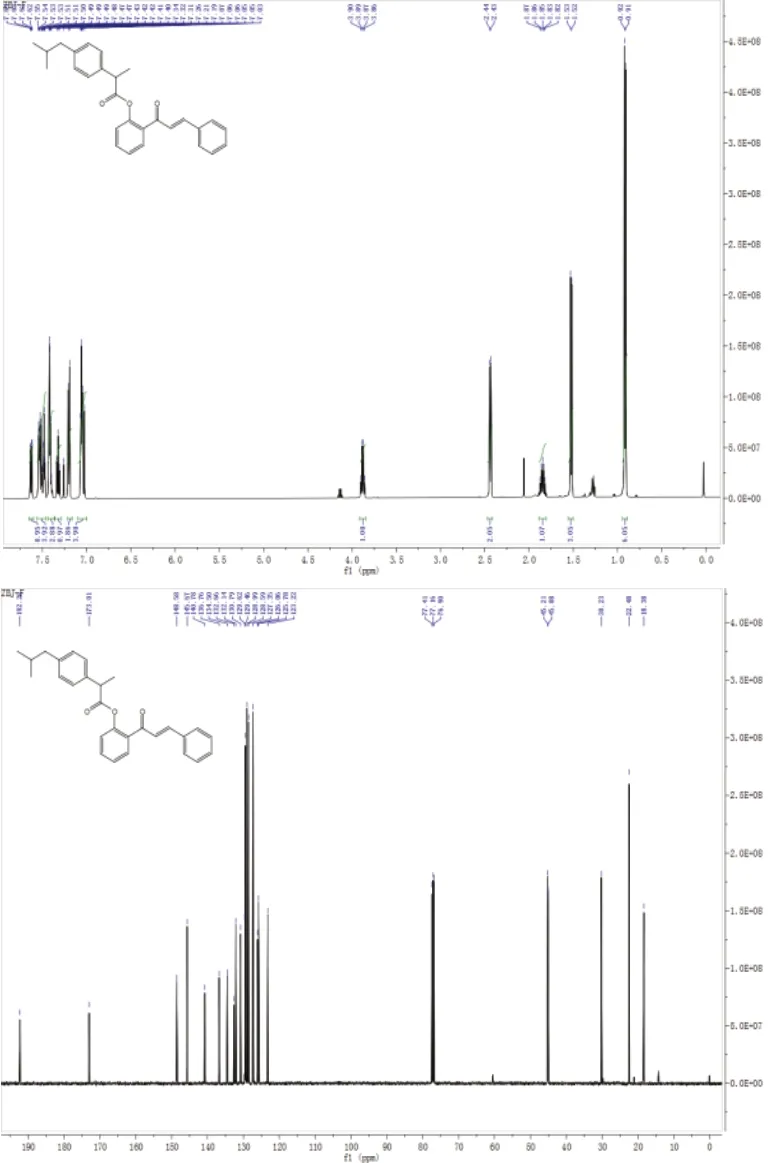
图2 化合物2的1H-NMR谱图和13C-NMR谱图
根据化合物2的13C-NMR谱图可知,δ为192.28归属于2-羟基查尔酮上的羰基碳原子,δ为173.01则是酯键上羰基官能团上的碳的化学位移,由此可知以布洛芬和2-羟基查尔酮为原料,在DMAP的催化作用下,二者能够在EDCI缩合剂的作用下,快速脱去一分子水,形成酯键,生成查尔酮衍生物2。δ为148.58、145.67、140.78、136.76、134.50、132.66、132.14、130.79、129.62、129.46、128.99、128.59、127.35、126.06、125.78和123.22归属于苯环和双键上碳原子的化学位移;δ为45.15属于布洛芬结构上与羧基相连的次甲基上氢原子的化学位移;δ为30.23则归属于另外一个次甲基上的碳原子化学位移,δ为22.48和18.38则是甲基上的碳原子的化学位移。经分析得出以下结论:化合物2中碳原子的总数为28个,与目标化合物2的理论碳原子个数相符。因此,本文以目标化合物1~7已经成功合成,并已确证其结构。
化合物1~7的物理性质、产率和核磁数据如下:
2-肉桂酰基苯基-2-乙酰氧基苯甲酸酯(1),浅绿色固体,产率为70%。1H NMR(500MHz,CDCl3)δ8.14(dd,J=7.9,1.6Hz,1H),7.76(dd,J=7.7,1.6Hz,1H),7.61-7.53(m,3H),7.47-7.44(m,2H),7.39(td,J=7.6,0.9Hz,1H),7.33(dd,J=5.0,3.6Hz,1H),7.30(dd,J=14.1,7.7Hz,3H),7.22(td,J=7.8,1.0Hz,1H),7.16(d,J=16.0Hz,1H),7.10(dd,J=8.1,0.8Hz,1H),2.27(s,3H)。13C NMR(126MHz,CDCl3)δ191.38,169.68,162.68,151.26,148.55,145.61,134.70,134.43,132.65,132.52,132.23,130.63,130.06,128.86,128.48,126.38,126.17,125.41,123.97,123.59,122.05,21.03。
2-肉桂酰基苯基-2-(4-异丁基苯基)异丙酸酯(2),浅绿色固体,产率为75%。1H NMR(500MHz,CDCl3)δ7.63(dd,J=7.6,1.5Hz,1H),7.56-7.46(m,4H),7.44-7.37(m,3H),7.32(t,J=7.5Hz,1H),7.20(d,J=8.0Hz,2H),7.05(dt,J=16.1,6.8Hz,4H),3.88(q,J=7.1Hz,1H),2.44(d,J=7.2Hz,2H),1.85(dt,J=13.5,6.7Hz,1H),1.52(d,J=7.2Hz,3H),0.91(d,J=6.6Hz,6H).13C NMR(126MHz,CDCl3)δ192.28,173.01,148.58,145.67,140.78,136.76,134.50,132.66,132.14,130.79,129.62,129.46,128.99,128.59,127.35,126.06,125.78,123.22,45.15,30.23,22.48,18.38。
2-肉桂酰基苯基-2-(6-甲氧基萘-2-基)丙酸酯(3),浅绿色油状物,产率为68%。1H NMR(500MHz,CDCl3)δ7.63(d,J=7.6Hz,3H),7.61-7.57(m,1H),7.4 7(t d,J=8.1,1.6 H z,1 H),7.4 1(d d,J=6.3,2.0Hz,1H),7.38(t,J=3.4Hz,1H),7.37-7.33(m,2H),7.33-7.29(m,1H),7.12(dd,J=8.9,2.5Hz,1H),7.08-7.03(m,2H),6.92(d,J=16.1Hz,1H),4.03(q,J=7.1Hz,1H),3.92(s,3H),1.60(d,J=7.2Hz,3H)。13C NMR(126MHz,CDCl3)δ192.41,172.94,157.66,148.43,145.75,134.61,134.33,133.78,132.73,132.08,130.72,129.56,129.37,128.91,128.50,127.33,126.28,126.23,126.12,125.68,123.19,119.05,105.56,55.35,45.52,18.38。
2-肉桂酰基苯基-2-((2,3-二甲基苯基)氨基)苯甲酸酯(4),浅绿色油状物,产率为77%。1H NMR(500MHz,CDCl3)δ9.06(s,1H),8.16(dd,J=8.1,1.5Hz,1H),7.81(dd,J=7.7,1.6Hz,1H),7.63(ddd,J=10.5,3.9,2.1Hz,2H),7.47-7.40(m,3H),7.37-7.33(m,2H),7.30(dd,J=11.4,4.5Hz,2H),7.26-7.21(m,2H),7.08(d,J=7.5Hz,1H),7.05-7.00(m,2H),6.71(d,J=8.3Hz,1H),6.66-6.61(m,1H),2.30(s,3H),2.07(s,3H)。13C NMR(126MHz,CDCl3)δ191.70,167.07,150.36,148.85,145.57,138.24,135.18,134.52,132.91,132.61,132.00,130.58,130.14,128.86,128.46,127.10,126.23,125.96,125.60,123.81,123.36,116.31,113.77,109.11,20.67,13.99。
2-肉桂酰基苯基-2-((3-(三氟甲基)苯基)氨基)苯甲酸酯(5),浅绿色油状物,产率为82%。1H NMR(500MHz,CDCl3)δ9.36(s,1H),8.18(d,J=8.1Hz,1H),7.80(d,J=7.7Hz,1H),7.66-7.58(m,2H),7.57(s,1H),7.43(t,J=8.3Hz,4H),7.38(t,J=7.8Hz,3H),7.35-7.28(m,6H),7.25-7.20(m,2H),7.18(s,1H),6.79(t,J=7.6Hz,1H).13C NMR(126MHz,CDCl3)δ191.63,166.97,148.66,147.51,145.80(s),141.10,135.24,134.36,132.65,132.36,131.90,131.65,130.69,130.14,129.95,128.88,128.42,126.41,125.39,124.89,123.72,119.92,118.56,114.14,111.37。
2-肉桂酰基苯基-2-(1,8-二乙基-1,3,4,9-四氢吡喃-[3,4-b]吲哚-1-基)-乙酸酯(6),浅绿色油状物,产率为67%。1H NMR(500MHz,CDCl3)δ9.05(s,1H),7.76(dd,J=7.7,1.6Hz,1H),7.57(ddd,J=9.1,7.8,1.6Hz,1H),7.45-7.38(m,4H),7.34(dt,J=8.1,2.5Hz,3H),7.14-7.05(m,3H),7.00(d,J=7.1Hz,1H),4.13(q,J=7.1Hz,1H),4.02(dt,J=9.0,4.7Hz,1H),3.85-3.77(m,1H),3.26(d,J=16.5Hz,1H),3.11(d,J=16.5Hz,1H),2.86-2.74(m,3H),2.60(dt,J=15.2,3.9Hz,1H),2.17(dq,J=14.7,7.3Hz,1H),2.01(dt,J=14.5,7.3Hz,1H),1.25(dt,J=15.2,7.4Hz,5H),0.83(t,J=7.3Hz,3H)。13C NMR(126MHz,CDCl3)δ191.47,171.15,148.25,145.87,135.10,134.52,134.18,132.81,132.40,130.89,129.97,128.96,128.51,126.85,126.47,126.09,124.67,123.21,120.38,119.54,115.96,108.69,74.72,60.69,60.48,43.24,30.95,24.07,22.37,14.25,13.75,7.61。
2-肉桂酰基苯基-2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1H-吲哚-3-基)-乙酸酯(7),浅绿色固体,产率为86%。1H NMR(500MHz,CDCl3)δ7.68-7.61(m,3H),7.53(td,J=8.0,1.6Hz,1H),7.45(ddd,J=10.8,7.5,2.8Hz,5H),7.39-7.32(m,4H),7.16(dd,J=8.1,0.7Hz,1H),7.05-7.00(m,1H),6.98(s,1H),6.88(d,J=9.0Hz,1H),6.65(dd,J=9.0,2.5Hz,1H),3.88(s,2H),3.79(s,3H),2.32(s,3H)。13C NMR(126MHz,CDCl3)δ192.01,169.32,168.29,156.07,148.52,146.12,139.21,136.26,134.25,133.89,132.31,132.21,131.22,130.85,130.75,130.59,129.60,129.12,129.00,128.49,126.18,125.26,123.48,115.01,111.91,111.69,101.11,55.67,30.24,13.46。
3.结论
本文以2-羟基查尔酮为基本骨架,利用非甾体抗炎药对其进行结构修饰,合成了7个新型的查尔酮类化合物,并对此类化合物的化学结构进行确证体。研究结果表明在DMAP的催化作用下,非甾体抗炎药和2-羟基查尔酮能够在EDCI缩合剂的作用下,快速脱去一分子水,形成酯键,生成目标产物。以天然活性成分为基本骨架,并对其进行化学修饰的合成策略为后续的药物研发奠定了理论基础。

