洪湖周边养殖池塘微塑料污染特征研究
陈玉玲 熊 雄 周炳升 吴辰熙
(1. 中国科学院水生生物研究所淡水生态和生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
微塑料通常是指粒径小于5 mm的塑料颗粒,由于它们的负面影响和广泛分布, 微塑料污染已经成为一种全球性的环境污染问题[1]。相比于自然环境, 水产养殖环境由于与人类活动关系密切, 养殖水体和水产品可能面临更高的微塑料暴露风险。当前集约化养殖的趋势也将导致水产养殖环境中污染物的增加。水产养殖区附近的塑料垃圾经过长期的自然风化和机械破碎逐渐形成微塑料颗粒,这些微塑料通过大气沉积、雨水冲刷和地表径流等方式迁移到养殖环境[2,3]。养殖活动中使用的塑料产品也会不可避免地将微塑料引入养殖环境。渔网、绳索、浮球和衣服等在长期浸泡、侵蚀、磨损、碰撞和紫外线照射的作用下会产生微塑料[4]。水生动物的活动也可能导致水产养殖环境中微塑料的增加[5,6]。此外, 天然饵料和饲料的投喂也是养殖水体微塑料的重要来源。例如, 鱼粉和虾粉是水产养殖中的高蛋白饲料原料, 这些原料主要由野生捕捞的鱼和虾制成, 野生鱼虾体内的微塑料可能会通过饲料投喂被带入养殖环境[7—9]。
一旦进入水产养殖环境, 微塑料可能会长期存在并影响水的透明度。一些含氯的微塑料如聚氯乙烯(Polyvinyl chloride, PVC)在光催化分解过程中可能释放盐酸, 导致水环境的酸化[10]。由于微塑料有较大的比表面积和较强的疏水性, 微塑料往往会吸附环境中的有机污染物, 如多环芳烃、有机氯农药和多氯联苯等[11]。微塑料添加剂和吸附污染物的再释放可能会增加水产品摄入毒素的风险, 同时也对人类健康构成威胁[12]。微塑料不仅会影响到水生动物的生长和健康[13,14], 还可通过动物-人类食物链传递给人类。食用水产品是人类接触微塑料的一个关键途径。研究报道, 通过食用贻贝人均可摄入7.4和5.0个微塑料[15,16], 每食用300 g鱼可摄入169—555个微塑料[17]。
调查研究表明, 海湾、人工鱼礁、沿海地区、河流、湖泊、池塘、养鱼场和稻鱼共养系统等水产养殖环境的水产品体内普遍含有微塑料颗粒[18]。例如, 中国沿海17个水产养殖基地的牡蛎中的微塑料丰度平均为2.93 items/ind.[19]。上海稻田养鱼生态系统中的鳗、小龙虾和泥鳅的微塑料丰度平均为(1.7±0.5) items/ind.[20]。珠江河口海水养殖区的石斑鱼体内微塑料平均丰度为35.36 items/ind.[21]。相比于野生的河豚, 养殖河豚会通过摄食暴露更多的微塑料[22]。此外, 不同的养殖模式下同种水产品可能具有不同程度的微塑料暴露风险[23]。随着人类对水产品需求的日益增加, 了解水产养殖活动的微塑料污染状况对于实施环境微塑料污染管控和评估人类接触微塑料风险至关重要。
淡水水产养殖贡献了全球77%的水产品, 在水产养殖业中占有重要地位[24]。作为世界上水产养殖第一大国, 我国在2021年的淡水养殖产量为3183.27万吨, 占水产养殖总产量的59.01%[25]。洪湖是我国第七大淡水湖泊, 为当地的水产养殖、生物多样性保护和生态旅游提供了重要的水资源和生物栖息地。洪湖周边围绕着多种类型的水产养殖池溏。通过调查洪湖周边养殖塘的养殖水体和水产品微塑料污染现状, 可以为了解我国淡水养殖环境中的微塑料污染状况提供有力参考。
1 材料与方法
1.1 样品采集
本研究于2020年10月份对洪湖周边水产养殖池塘进行采样, 我们随机调查了其中的5个龙虾塘(克氏原螯虾Procambarus clarkia, 俗称淡水小龙虾)、5个河蟹塘(中华绒螯蟹Eriocheir sinensis)和5个鲫塘(鲫Carassius auratus)(图1)。使用对角线混合法采集水样, 即在养殖塘对角线的两端和中心位置各收集20 L表层水, 每个池塘共取60 L表层水。在采样现场将水样通过20 μm的不锈钢筛进行过滤, 筛网上的残留物用超纯水冲洗到玻璃瓶中,残留物冷藏保存并及时转移到实验室中待测分析。养殖塘生物样与水样在同一时间进行采集。使用地笼诱捕的方式采集龙虾和河蟹。鲫使用捕网进行采集。每个采样点随机捕获大小一致的水产品各6只。将采集到的生物放入液氮罐中速冻死亡, 之后用锡纸包裹全身并装袋, 及时送到实验室中冷冻保存。
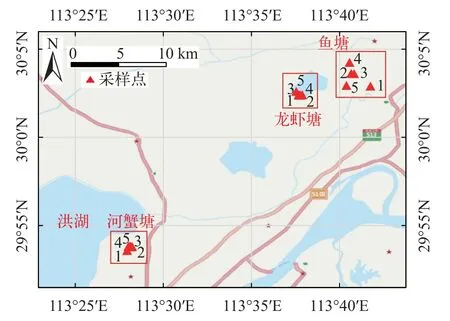
图1 洪湖养殖塘微塑料污染调查采样位点图Fig. 1 Sampling site of microplastics survey in aquaculture ponds around Honghu Lake
1.2 样品前处理与鉴定
将玻璃瓶中的水样放置于烘箱中65℃烘干。烘干后加入20 mL 30%的过氧化氢(分析纯), 于60℃下消解72h以去除有机物质。使用密度分离方法提取消解液中的微塑料颗粒, 即在消解完成后将消解液倒入分液漏斗中并加入饱和氯化钠溶液(ρ=1.2 g/cm3), 静置过夜。之后将上清液过滤到1.2 μm的白色网格滤膜上。然后将滤膜放置在50 mm×50 mm的玻璃片上, 放入带盖培养皿中保存。生物样品采集回来后用解剖工具分别取出龙虾的肠道和鳃部、鲫的肠道和鳃部、河蟹的消化系统和鳃部, 将各部分样品分别单独放入100 mL蓝盖瓶中,并加入3倍样品体积30%的H2O2溶液, 于烘箱中65℃消解3d。在消解完成后, 将消解液趁热抽滤至1.2 μm的白色网格滤膜上。消解瓶内壁用超纯水冲洗3次同时抽滤至滤膜上, 以避免微塑料残留。
使用体式显微镜统计滤膜上疑似微塑料颗粒的数量和形态特征, 统计的微塑料粒径在20—5000 μm。使用显微红外光谱仪(Micro-IR, Nicolet iN10, Thermo Scientific, America)对疑似微塑料的多聚物组分进行鉴定, 记录400—4000波段的红外光谱, 并将样品的红外光谱与聚合物光谱库进行比较, 以验证样品的聚合物类型。
为了避免整个实验过程中的污染, 所有用于采样和实验室分析的设备都要用超纯水预冲洗, 并在使用前后用铝箔覆盖。在取样和分析时穿棉质实验室外套和清洁手套。桌子和手的表面用黏性滚轮滚动, 以去除上面的颗粒。实验过程中所有溶液和水均通过孔径为1.2 μm的GF/C滤膜过滤后使用。解剖工具在使用前和取完单只生物样品后均用超纯水清洗3遍, 以防止交叉污染。空白对照样品采用与现场采样相同的方法进行采集, 即在现场用去离子水冲洗预洗过的不锈钢筛子, 然后将筛网上的残留物用水冲洗至玻璃瓶中。空白样品按照环境样品的前处理方法进行处理。在解剖生物样品和抽滤消解液的过程中, 设置程序空白。测定样品的微塑料丰度用空白样本中具有与之形态相似的微塑料平均丰度进行校正。
1.3 数据分析
采 用ArcGIS (10.6版)绘 制 采 样 点 图, 使 用Excel软件对数据进行统计分析和作图。首先对数据进行正态性和方差齐性检验, 使用单因素方差分析比较不同水体之间微塑料丰度的差异显著性, 显著性水平为0.05。使用独立样本t检验比较同一生物不同器官之间微塑料丰度的差异显著性。利用斯皮尔曼相关性分析比较生物微塑料丰度和水体微塑料丰度之间的相关性。基于微塑料的形态特征(粒径和形状占比), 使用相似性分析(ANOSIM)比较水体和生物之间, 以及不同生物之间的微塑料群落差异。
2 结果
2.1 水体和水产品微塑料丰度
在3种养殖塘水体中均有检出微塑料颗粒, 其中河蟹塘水体微塑料平均丰度为(992±558) items/m3,显著高于龙虾塘水体微塑料平均丰度(296±140) items/m3(P<0.05)。鱼塘水体微塑料平均丰度为(520±233)items/m3, 居于这两者之间(图2A)。3种生物体内微塑料检出率具体为龙虾96.67% (肠道80%, 鳃部70%)、鲫96.67% (肠道97%, 鳃部63%)和河蟹63.33% (肠道27%, 鳃部53%)。生物微塑料丰度为0—16 items/ind., 其中龙虾体内的平均丰度为(4.30±3.83) items/ind., 河蟹体内的平均丰度为(1.20±1.49) items/ind.,鲫体内的平均丰度为(5.17±3.34) items/ind.。从微塑料的生物分布来看, 龙虾和河蟹的肠道和鳃部微塑料丰度相当(P>0.05), 鲫肠道内微塑料显著高于鲫鳃部(P<0.05; 图2B)。通过对同一养殖塘水体和生物之间的微塑料丰度进行斯皮尔曼相关性分析,可以发现各养殖塘中水体和生物之间的微塑料丰度并不存在显著相关性(P>0.05; 图2C)。

图2 养殖塘水体和水产品微塑料丰度图Fig. 2 Microplastic abundance of aquacultural ponds
2.2 水体和水产品微塑料形态特征
养殖塘水体中的微塑料从形状上来看主要分为纤维、碎片和碎块三种类型, 其中纤维状微塑料最多, 占比56.70%—82.68%, 其次为碎片状微塑料,占比13.92%—37.85%, 微塑料碎块仅有少量存在,占比1.82%—5.45% (图3A)。水产品体内超过80%为纤维状微塑料, 剩余为少量微塑料碎片(图3B)。我们将微塑料粒径划分为小粒径(< 500 μm)和大粒径(>500 μm)两个等级, 统计结果表明养殖塘水体中大粒径微塑料占比在51.59%—58.53%, 略高于小粒径微塑料(占比41.47%—48.41%; 图3C), 而生物体内超过70%的微塑料为大粒径微塑料(图3D)。经显微红外鉴定, 水体微塑料的聚合物类型主要有7种: 聚丙烯(Polypropylene, PP)、聚对苯二甲酸乙二醇酯(Polyethylene terephthalate, PET)、聚乙烯(Polyethylene, PE)、聚苯乙烯(Polystyrene, PS)、PVC、聚酰胺(Polyamide, PA)和聚甲基丙烯酸甲酯(Polymethyl methacrylate, PMMA; 图3E)。水产品体内检出的微塑料多聚物类型主要有纤维素(Cellulose),聚四氟乙烯(Polytetrafluoroethylene, PTFE)、PET、PP和PE等5种(图2—3F)。3种水产品体内的微塑料均以纤维素、PTFE和PET纤维为主, 其次为少量PP和PE碎片。
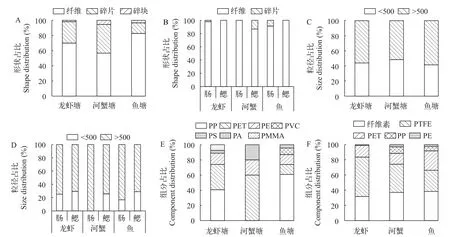
图3 微塑料形状、粒径和组分在水体和生物体的占比Fig. 3 Shape, size and component distribution of microplastics in water and organism
考虑到微塑料在大小上对水产品的适口性, 我们基于微塑料的粒径和形状占比, 比较了水体和生物之间以及不同生物之间的微塑料群落差异。结果表明, 水体微塑料和水产品之间的微塑料形态差异程度较小, 其中水体微塑料的形态包含绝大多数水产品微塑料形态(图4A)。3种水产品微塑料群落差异不显著, 具有较高的相似度, 但组内差异稍大于组间差异(图4B)。
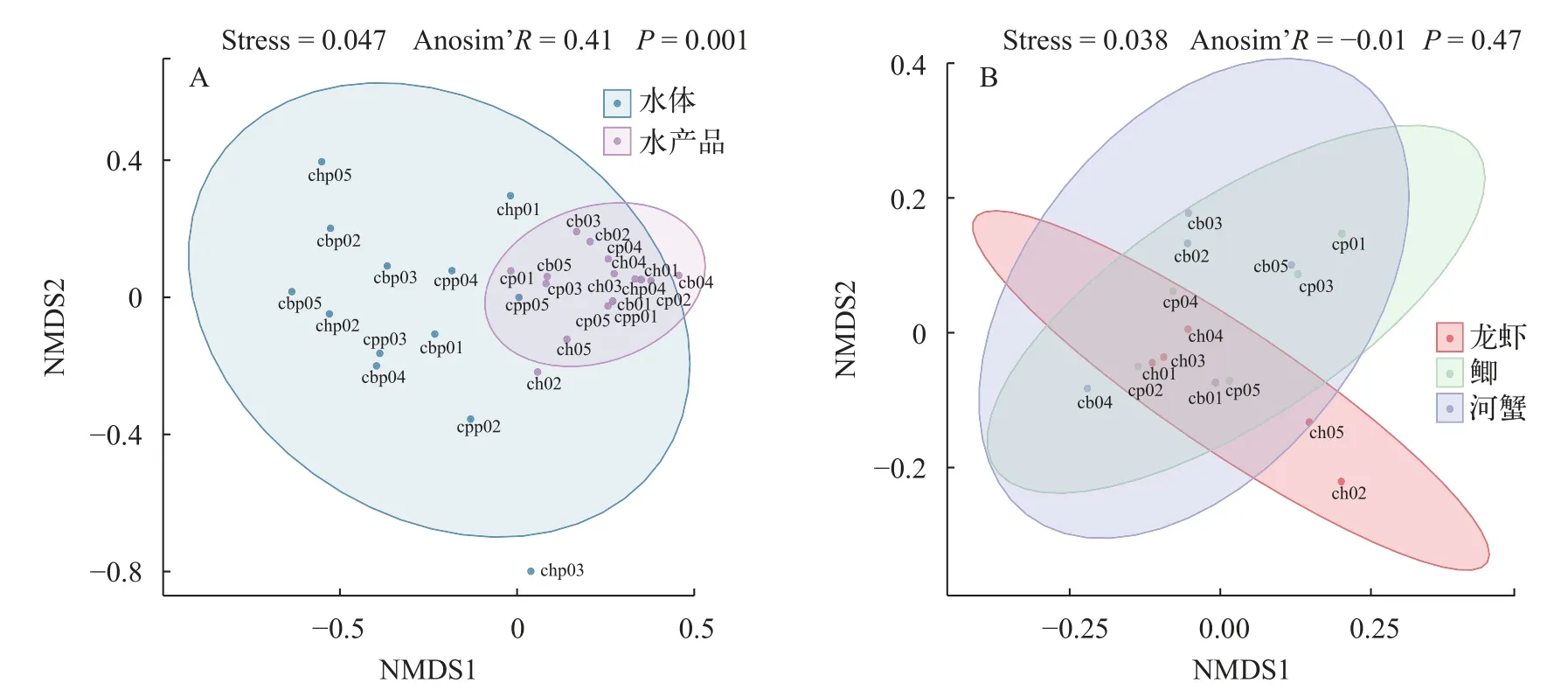
图4 微塑料群落相似度分析Fig. 4 Similarity analysis of microplastics community
3 讨论
3.1 微塑料污染水平
从调查结果来看, 洪湖养殖塘水体普遍受到微塑料污染。相比于国内外其他淡水养殖水体, 该地区水体微塑料丰度处于中等水平(表1)。研究表明,上海地区的水稻-鱼养殖塘和鳗鱼养殖站水体微塑料丰度较低[20,26], 除此之外, 国内的其他地区包括常州和广州的鱼塘、珠江河口的鱼、虾养殖区, 以及湖北监利地区的龙虾养殖站和水稻-龙虾养殖系统的水体微塑料丰度均高于洪湖养殖塘水体微塑料丰度1—3个数量级[27—29]。目前国外主要关注于海水或半咸水的养殖水体微塑料污染现状, 针对淡水养殖水体的微塑料污染状况还了解甚少。例如,欧洲喀尔巴阡盆地的鱼塘水体微塑料污染水平要远远低于洪湖养殖塘水体微塑料污染水平[28]。然而需要注意的是, 由于目前还没有统一的标准方法,不同研究所使用的微塑料采样方法差异较大, 这也是导致不同研究结果之间存在较大差异的原因。
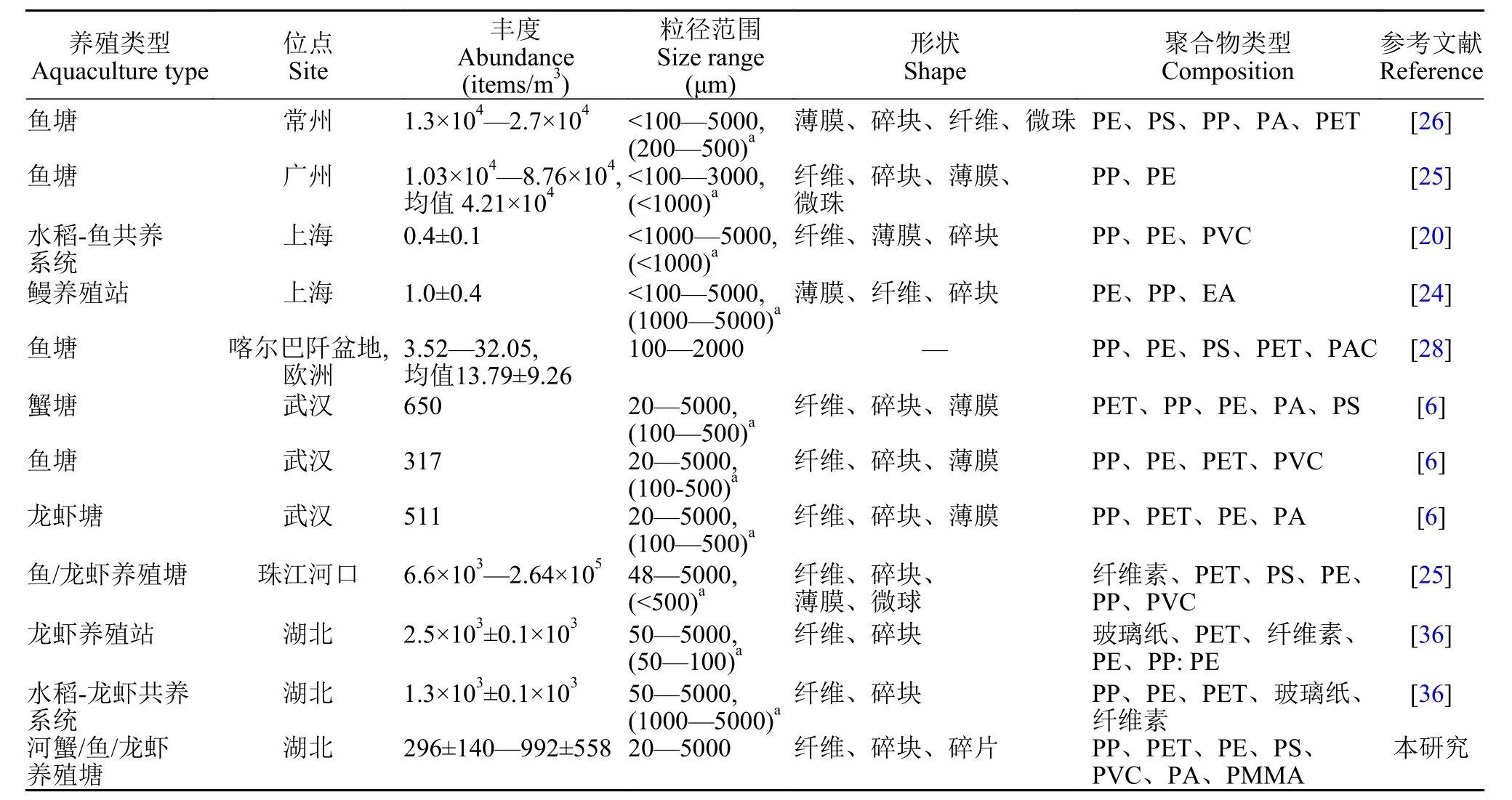
表1 淡水养殖水体微塑料污染特征Tab. 1 Characteristics of microplastics pollution in water column of freshwater aquaculture system
养殖活动可能是使养殖水体遭受微塑料污染的主要原因。养殖过程中的捕捞和投喂等行为可能会直接或间接地导致渔具和饲料等产品中的微塑料颗粒被释放到水环境当中。结合前人的研究结果, 纤维状微塑料是水体中出现最多的微塑料形态(表1)。水体中大量纤维的存在可能跟捕网等渔具的使用有关。养殖塘水体的输入与排出过程也是影响水体微塑料丰度的重要原因。洪湖水体通过养殖塘附近的沟渠引入到养殖塘, 在养殖季节结束后又重新排放回沟渠中, 因此洪湖水体也是养殖塘微塑料的重要来源。本研究中3种养殖塘水体中大粒径微塑料和小粒径微塑料含量基本一致。这与国内外其他养殖系统和自然水体中发现小型尺寸微塑料占比较多的现象形成了鲜明对比(表1)[31—33]。我们分析可能是由于养殖塘的排水过程导致微塑料在水体的停留时间缩短, 减弱了微塑料在水体中的破碎化过程, 因此水体主要以大粒径微塑料颗粒为主。此外, 排水过程还可能导致大粒径塑料被滞留在池塘中, 进而增加了大粒径微塑料颗粒的占比[6]。同时, 养殖塘水体高丰度的营养物质会促进微塑料表面形成微生物膜, 小型微塑料颗粒由于比表面积相对较大更易形成较多的微生物膜, 进而导致微塑料密度增大而沉降[34,35]。PET、PP和PE类微塑料在水体中占比较多。PET是纤维状微塑料的主要聚合物类型, PP和PE主要为碎片和碎块状微塑料,这可能主要来自于渔业活动过程中使用的包装材料和器皿等塑料用品。
3.2 水产品微塑料含量
通过对3种养殖塘中的水产品进行微塑料污染水平分析, 可以看出超过一半的生物体内含有微塑料颗粒。前人研究也表明, 商业水产品体内普遍受到微塑料污染[29,37,38]。在这3种生物当中, 96%以上的龙虾和鲫体内都暴露到微塑料颗粒, 肠道中微塑料的检出率稍高于鳃部。河蟹体内微塑料检出率最低, 与前两种生物相反的是, 河蟹鳃部的微塑料检出率比肠道中微塑料检出率高。3种生物微塑料丰度和微塑料检出率具有一致性, 龙虾和鲫体内微塑料总丰度略高于河蟹, 但整体来看, 3种生物体内微塑料丰度均处于较低水平。目前关于淡水类水产品微塑料污染现状的报道还相当有限, 我国在这方面的关注相对较多。从前人的研究结果来看, 鳝鱼、泥鳅、鱼类和龙虾等水产品的微塑料丰度也都在一个数量级以内, 与本研究调查结果较为一致(表2)[20,26,36,39]。
研究发现, 生物主要通过摄食和呼吸过程接触水体中的微塑料颗粒, 在摄食过程中也会通过食物间接摄入微塑料颗粒。3种生物体内均以细长的纤维状微塑料为主, 我们分析可能主要有2种原因: 一是水体中含有较多的纤维状微塑料, 导致生物暴露纤维的概率更大; 二是由于纤维的易滞留性, 导致纤维状微塑料更难被排泄或清除而滞留在生物体内[38]。以往的研究也表明纤维状微塑料是生物体内占比最多的微塑料形态[41,42]。生物体内微塑料以大于500 μm的大粒径微塑料为主, 这可能是由于较多的纤维状微塑料增加了大粒径微塑料的占比。
3.3 微塑料生物暴露因素分析
斯皮尔曼相关性结果表明, 同一养殖塘水体微塑料丰度与生物微塑料丰度之间无显著相关性, 这说明生活环境微塑料丰度并不是影响生物暴露微塑料水平的直接原因。在以往的研究中我们也得到相似结果[43]。由于龙虾和河蟹为典型的底栖类杂食性动物, 他们喜欢潜伏在水草或底泥中, 摄食底栖动物, 植物碎屑和动物尸体等, 因此可能会从底泥中摄入微塑料颗粒。沉积物作为水体环境微塑料的主要汇之一, 沉积物微塑料丰度可能会影响生物对微塑料的摄入程度。以往的研究发现水生动物微塑料丰度与养殖区土壤微塑料丰度呈正相关性, 而与水体微塑料丰度并没有相关性[20]。由于本研究没有调查沉积物微塑料污染现状, 暂时无法判断沉积物微塑料丰度与生物微塑料丰度之间的关系。
从生物不同器官的微塑料检出率来看, 龙虾和鲫鱼主要通过摄食暴露微塑料, 而河蟹主要通过鳃呼吸暴露微塑料。生物的生活方式和不同器官对微塑料的清除排泄能力可能会影响微塑料的暴露途径[44,45]。从微塑料丰度来看, 龙虾和河蟹的肠道和鳃部微塑料丰度相当, 而鲫肠道中的微塑料丰度显著高于鳃部(P<0.05), 这可能跟生物的肠容量有关, 相比于龙虾和河蟹, 鲫由于体型更大而具有更高的肠容量, 导致较多的微塑料颗粒随摄入的食物累积在肠道中。通过比较水体和生物体微塑料群落相似性及3种生物微塑料群落之间的相似性可以发现, 和水体微塑料群落相比, 3种生物的微塑料群落较为单一且具有较高的一致性, 这可能因为3种生物体内的微塑料群落均是以细长的纤维状微塑料为主。由此可以看出生物微塑料污染特征与生物种类无关, 而微塑料不同的形态特征所带来的滞留性差异可能是影响生物暴露微塑料的内在原因。同时由于3种水产品微塑料群落的组内差异稍大于组间差异, 也间接说明了生物摄食微塑料的随机性和空间异质性。
毒理试验表明大量的微塑料存在会影响生物的生长与健康[13,46,47]。虽然当前水环境微塑料污染水平以及生物体内微塑料暴露剂量远远低于微塑料的生物有效应浓度, 由于微塑料(及塑料产品)在人类生活和各种环境当中无处不在, 微塑料的潜在影响还是需要人们的密切关注。同时, 部分类型水产品如龙虾和蟹, 在食用前并对肠道和鳃部等部分未进行充分的处理, 由此可能导致人类在进食这些食物时误食微塑料颗粒。水产品的微塑料污染水平密切关系到人类的健康风险, 因此, 建议严格防控养殖水体微塑料的输入, 包括限制养殖活动中塑料产品的使用, 同时建议在进行水产品食物加工前, 处理掉水产品的外壳、肠道和鳃部等容易暴露微塑料的部位。
4 结论
本研究表明, 洪湖周边养殖塘的水体和水产品普遍受到微塑料污染。水产品的鳃部和肠道均是遭受微塑料污染的暴露部位。纤维状微塑料是养殖塘水体和水产品中主要的微塑料类型。与国内外其他淡水养殖水体相比, 该地养殖塘水体微塑料丰度处于中等水平。3种养殖塘的水产品微塑料丰度处于同一水平。统计分析表明, 水产品生活的水体微塑料丰度与水产品暴露的微塑料丰度无关。然而, 考虑到生物摄食的多样性, 未来应当关注养殖塘环境中能够为水产品提供食物来源的其他介质如底泥、饲料、植物碎屑、腐殖质等有机物质中的微塑料污染状况。同时还应当探究不同形态特征的微塑料在生物体内的清除排泄过程, 以及微塑料对水产养殖生态系统的影响。

