动脉瘤性蛛网膜下腔出血后脑血管痉挛的影响因素研究
刘菁芸 江小琳 程琼 汪银洲 李永坤
动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage ASAH)是自发性出血性脑卒中的一种, 它是由大约80%的蛛网膜下腔出血(SAH)患者的脑动脉瘤破裂引起的[1]。近1/3 的动脉瘤性蛛网膜下腔出血幸存者发生迟发性脑缺血, 这是由于脑血管狭窄和脑血流减少所致[2]。颅内动脉管腔的节段性或弥漫性狭窄也称为脑血管痉挛(cerebral vasospasm CVS)[3]。CVS 是SAH 最严重的并发症, 是一种自我延迟和限制的情况,其严重程度与蛛网膜下腔血液的体积、密度、扩展存在和部位有关[4]。受SAH 影响的CVS 与很多因素相关, 包括低血容量、受损的自我调节功能以及血管炎等[5]。预防CVS 最重要的是维持正常的血容量以及使用尼莫地平等药物进行治疗[6]。目前, 已知多种因素与SAH 后CVS 风险增加有关。触珠蛋白表型是这些因素之一, 因为分子对血红蛋白的亲和力取决于它在蛛网膜下腔与游离血红蛋白结合的程度, 从而阻止一系列最终导致CVS 形成的反应发生[7]。在动脉瘤性蛛网膜下腔出血内的脑室出血也与较高的CVS 发生率以及长期使用烟草有关。此外, 在心电图上检测到的左心室肥厚被描述为CVS 发展的危险因素(OR=3.48)[8]。采用容量分析和SAH/脑脊液(CSF)比值(OR=1.03)观察CSF 与CVS 的相关性, 然而, 迄今为止在这一领域公布的数据数量相对有限[9]。大多数研究只在出现神经症状的患者中探索CVS。本研究的目的是研究影响CVS 发病的危险因素。现报告如下。
1 资料与方法
1.1 一般资料 选取2017 年1 月~2021 年3 月在本院住院治疗的66 例动脉瘤性蛛网膜下腔出血患者, 根据是否发生CVS 分为CVS 组与无CVS 组, 每组33 例。纳入标准:①≥18 岁, 症状出现后24 h 内入院自发性SAH。②符合《欧洲卒中组织2013 年颅内动脉瘤和蛛网膜下腔出血治疗指南》[10]诊断标准, 首次因颅内动脉瘤破裂而患SAH, 入院时CT 扫描证实SAH。③数字减影血管造影(DSA)证实动脉瘤破裂。④血管内弹簧圈栓塞术治疗动脉瘤后至少2 次对照CT 扫描(血管内手术后1 d 进行第1 次CT 扫描, 出院时最后一次CT扫描, 应神经科医生要求进行额外CT 扫描), 栓塞后第5~10 天进行头颈部CT 血管成像(CTA)检查。⑤签署知情同意书, 能够配合检查并完成随访者。
排除标准:①不能完全定期随访者;②近2 周服用抗凝药物;③近3 周头颅外伤史;④有血液病史、恶性肿瘤病史、自身免疫性疾病病史、严重的脑血管病或脑外伤病史、严重肝肾功能损害病史;⑤非动脉瘤性SAH。
剔除标准:①病程中需要外科手术干预;②入院后血管造影检查未能发现SAH 相关动脉瘤;③不能完成定期随访者;④入院后血管造影检查未能发现SAH相关动脉瘤;⑤经颅多普勒(TCD)探测发现前后循环均出现血流速度增快, 无法排除由于全脑充血导致的血管痉挛;⑥住院期间出现严重并发症如脓毒症、肝肾功能障碍等患者;⑦孕妇;⑧患者档案不完整。每次介入放射学检查由2 名经验丰富的放射科或神经介入医生组成, 所有CT 扫描均由本院的3 位放射科医生进行评估。
1.2 方法 从患者档案中收集以下信息:①社会人口学数据:年龄、性别、居住地、吸烟史和咖啡因使用史;②入院前的症状和身体状况:视乳头水肿视力减退;③量表:出院时改良的Rankin 量表(modified rankin scale, mRS)、Hunt-Hess 分级量表(HHS)、Fischer 分级量表(FS), 入院时格拉斯哥昏迷评分量表(glasgow coma scale, GCS);④CT 表现:脑积水、脑水肿、脑室出血和脑出血;⑤临床处理情况:腰椎穿刺和(或)脑室腹腔分流术, 血管内手术后的机械通气;⑥动脉瘤特征:第二次未破裂动脉瘤的位置[颈内动脉(ICA)、大脑中动脉(MCA)、大脑前动脉(ACA)、大脑后动脉(PCA)、基底动脉(BA)]、大小(宽度、高度、直径)、存在情况;⑦实验室检查:CRP 最大记录、WBC 最大记录、PLT最低值、INR 最大记录、白蛋白最低值、尿素最大记录。
①mRS 评分可对患者预后情况进行判断, mRS 评分0~2 分为预后良好, 3~6 分为预后不良。②HHS 分级是判断蛛网膜下腔出血患者病情轻重的重要工具,评判标准:动脉瘤未破裂为0 级;无症状, 或轻度头痛,轻度颈项强直为1 级;无急性脑膜/脑反应, 但有固定的神经功能缺失为1a 级;中等至重度头痛, 颈项强直,或颅神经瘫痪(如Ⅲ、Ⅳ)为2 级;嗜睡或混乱, 轻度定向障碍为3级;昏迷, 中等至重度偏瘫为4级;深昏迷,去脑强直, 垂死表现为5 级。③FS 分级根据蛛网膜下腔出血情况进行分级:0 级为无SAH 或脑室内出血;1 级为少量或薄层SAH, 不伴双侧脑室出血;2 级为少量或薄层SAH, 伴双侧脑室出血;3 级为蛛网膜下腔出血量大, 不伴双侧脑室出血;4 级为蛛网膜下腔出血量大, 伴双侧脑室出血。④GCS 评分可在床边评估意识水平障碍, 根据运动、语言、睁眼3 个部分进行评分相加所得。
1.3 统计学方法 采用SPSS23.0 统计学软件对研究数据进行统计分析。计量资料采用Kolmogorov-Smirnov 检验数据分布的正态性, 符合正态分布的计量资料以均数±标准差( x-±s)表示, 采用t 检验;计数资料以率(%)表示, 采用χ2检验;影响因素采用多因素Logistic 回归分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 CVS 的单因素分析 共有66 例患者符合入组标准, 并且均完成了这项研究, 大多数患者年龄分布在40~60 岁之间, 两组患者中均为女性患者较多。两组患者在年龄、性别、吸烟史、咖啡因使用史、动脉瘤情况(大小、定位、高度、直径)、GCS 评分、HHS 分级、FS分级、白蛋白最低值、CRP 最大记录、是否腰椎穿刺和(或)脑室腹腔分流术、是否血管内手术后机械通气方面比较差异无统计学意义(P>0.05);两组患者在视乳头水肿视力减退、脑室内出血、脑积水、动脉瘤宽度、mRS 评分、尿素最大记录、WBC 最大记录、INR最大记录、PLT 最低值方面比较差异具有统计学意义(P<0.05)。见表1。
表1 CVS 的单因素分析[ ±s, n, n(%)]
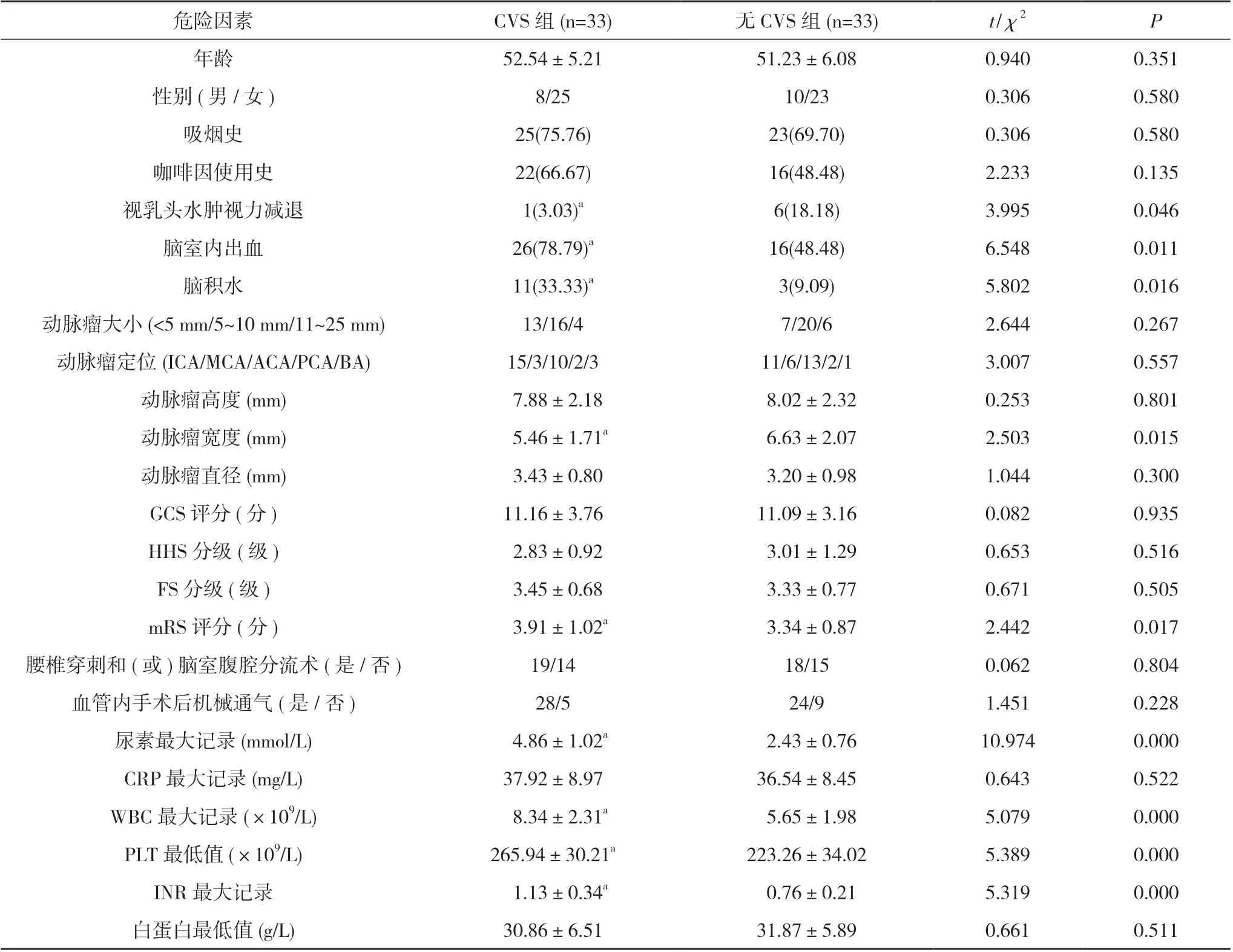
表1 CVS 的单因素分析[ ±s, n, n(%)]
注:与无CVS 组比较, aP<0.05
危险因素CVS 组(n=33)无CVS 组(n=33)t/χ2P年龄52.54±5.2151.23±6.080.9400.351性别(男/女)8/2510/230.3060.580吸烟史25(75.76)23(69.70)0.3060.580咖啡因使用史22(66.67)16(48.48)2.2330.135视乳头水肿视力减退1(3.03)a6(18.18)3.9950.046脑室内出血26(78.79)a16(48.48)6.5480.011脑积水11(33.33)a3(9.09)5.8020.016动脉瘤大小(<5 mm/5~10 mm/11~25 mm)13/16/47/20/62.6440.267动脉瘤定位(ICA/MCA/ACA/PCA/BA)15/3/10/2/311/6/13/2/13.0070.557动脉瘤高度(mm) 7.88±2.18 8.02±2.320.2530.801动脉瘤宽度(mm) 5.46±1.71a 6.63±2.072.5030.015动脉瘤直径(mm) 3.43±0.80 3.20±0.981.0440.300 GCS 评分(分)11.16±3.7611.09±3.160.0820.935 HHS 分级(级) 2.83±0.92 3.01±1.290.6530.516 FS 分级(级) 3.45±0.68 3.33±0.770.6710.505 mRS 评分(分) 3.91±1.02a 3.34±0.872.4420.017腰椎穿刺和(或)脑室腹腔分流术(是/否)19/1418/150.0620.804血管内手术后机械通气(是/否)28/524/91.4510.228尿素最大记录(mmol/L) 4.86±1.02a 2.43±0.7610.9740.000 CRP 最大记录(mg/L)37.92±8.9736.54±8.450.6430.522 WBC 最大记录(×109/L) 8.34±2.31a 5.65±1.985.0790.000 PLT 最低值(×109/L)265.94±30.21a223.26±34.025.3890.000 INR 最大记录 1.13±0.34a 0.76±0.215.3190.000白蛋白最低值(g/L)30.86±6.5131.87±5.890.6610.511
2.2 CVS 的多因素Logistic 回归分析 将单因素分析有意义的指标进行多因素Logistic 回归分析, 结果显示:尿素最大记录、WBC 最大记录和INR 最大记录升高是动脉瘤性蛛网膜下腔出血后CVS 发生的危险因素(OR=1.235、1.219、1.373, P<0.05)。视乳头水肿视力减退、脑室内出血、脑积水、动脉瘤宽度、mRS 评分、PLT最低值不是动脉瘤性蛛网膜下腔出血后CVS 发生的影响因素(P>0.05)。见表2。
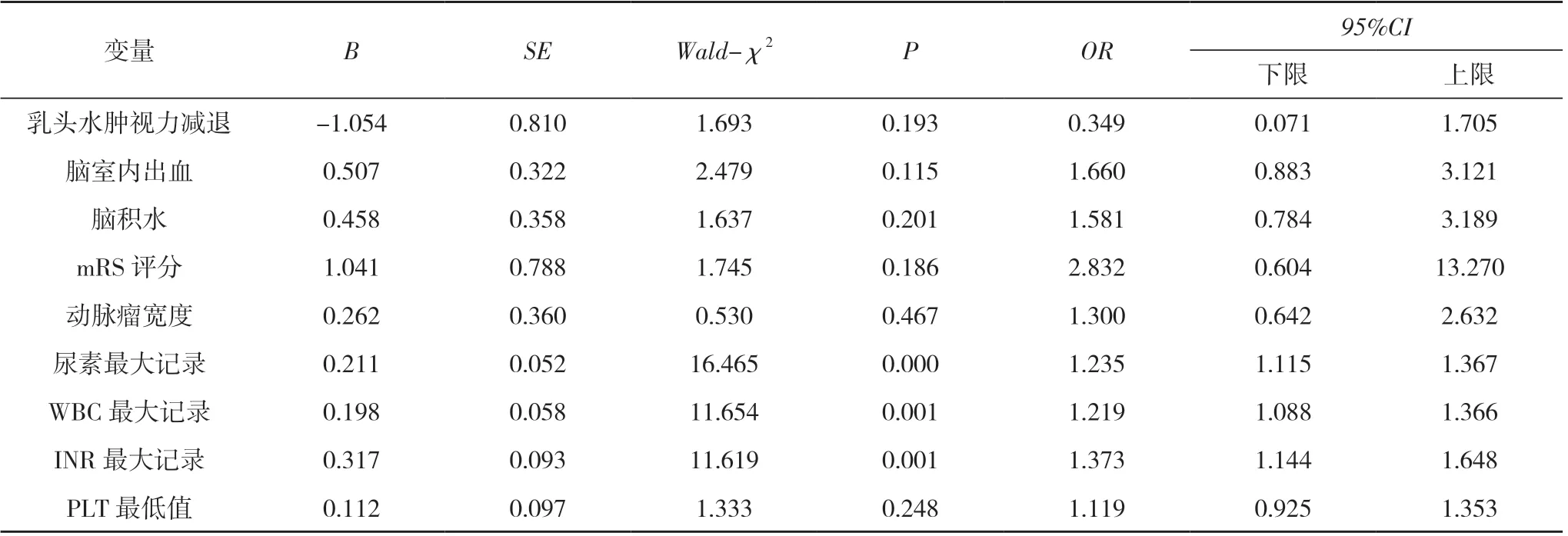
表2 CVS 的多因素Logistic 回归分析
3 讨论
CVS 是动脉瘤性蛛网膜下腔出血患者中比较常见的一种并发症, 严重影响动脉瘤性蛛网膜下腔出血患者的预后, 甚至对其生命安全造成严重的不良后果。CVS 发生的具体机制未明, 但现有研究认为神经炎症与动脉瘤破裂后诸如血管痉挛等继发结果关系密切。本研究通过单因素及多因素Logistic 回归分析发现,INR 最大记录、WBC 最大记录和尿素最大记录与CVS的发生相关, 能显著增加出血后临床过程中出现CVS的机会。
研究中观察到INR 升高可能反映了全身炎症(近72%的患者CRP 升高)对凝血级联的类似影响。全身炎症可通过激活凝血、降低血液中内源性抗凝物和抑制纤溶等造成高凝状态, INR 通常是由于消耗了与凝血级联有关的某些蛋白质而升高的。因此, 升高的INR 值可能与动脉瘤破裂后脑组织的强烈炎症有关。动脉瘤破裂后会释放大量炎性因子, 比如半胱氨酸白三烯, 此类化合物可能激活平滑肌细胞上的受体, 产生强烈的血管痉挛[11]。总之, 对于动脉瘤破裂后上调的神经炎性途径的研究已经引发越来越多研究者的关注和重视。
WBC 的升高也反映了脑组织的炎症过程, 其可能也与SAH 后CVS 的发生具有一定的相关性[12]。据了解, SAH 后大量的血管和神经改变是由炎症引起的,伴随着脑实质和血液中免疫细胞的激活[13], 有可能出现引起血管痉挛的物质, 如一些激素和神经递质等。其中一些是由血小板释放的, 如血清素;而另一些则可能来源于SAH 后被破坏的其他血细胞。血管活性儿茶酚胺、内皮素或其他物质的浓度增加, 都可能导致强烈的血管收缩[14]。
虽然脑积水和脑室内出血在发生CVS 的患者中更为常见, 但对痉挛的影响无统计学意义[15]。在一些动物实验中, 脑室内出血与脑组织炎症有关, 引起促炎细胞因子的增加, 吸引白细胞, 激活小胶质细胞。另一方面, 脑积水可能是脑室内出血并伴有炎症和水肿的结果。然而, 脑室内出血可能不是导致神经炎症和释放产生血管收缩的介质的唯一原因, 这与研究中相对较少的患者一起, 可以解释为什么在调整和多因素分析后, 它并不是重要的危险因素之一[16]。在本研究中咖啡因的使用与CVS 没有显著的关联, 但一些作者确实发现了两者之间的联系。咖啡因引起的CVS 一个可能的解释是血栓前状态, 血管扩张能力下降, 因为来自富含咖啡因的饮料或咖啡的咖啡因会增加血小板聚集,并改变内皮功能, 降低内皮介导血管舒张的能力[17,18]。然而, 还需要进一步的研究来证实。脑动脉瘤大小与蛛网膜下腔出血后CVS 的发生有关, 但这是一种间接效应, 因为当蛛网膜下腔出血程度很大时, CVS 更常见[19]。然而, 目前还没有研究发现动脉瘤的大小与血管内栓塞后CVS 的发生有关[20]。
本研究的局限性在于样本量相对较小, 脑动脉瘤破裂后的SAH 造成颅内炎症状态, 其强度可能与CVS的发生及其不良后果直接相关。对神经炎症干预的药物能否成为预防CVS 的有效手段仍需以后足够大样本量的研究。

