凝脂莲香精成分分析及最优提取方式研究
陶厚璜,周泓彬,郭明
( 浙江农林大学 化学与材料工程学院,浙江 杭州 311300)
景天科Crassulaceae 多肉植物可以散发出香味[1],比如凝脂莲Sedumclavatum,原产于墨西哥,生长于岩壁或安山岩上,现已在世界多地广泛种植[2]。在经过人类百年的培育后,基因稳定[3],生产链完善。在国内属于多肉植物中的入门级品种,价格低,产量又高[4],因其经过日晒后香味更加浓郁,成为多肉香精提取的主要对象[5]。多肉香精的提取不仅可以直接解决部分多肉植物现阶段价格低迷、供大于求的问题,还可以解决农民囤积的问题,为农户们带来新的创收,同时可为我国多肉产业链调整提供参考[6]。
对相关精油的提取,现国内主要采用的是微波辅助水蒸气法(Microwave Assisted Hydro-distillation,MAHD)[7],相较于传统的水蒸气蒸馏法(Steam distillation,HD)存在提取过程长,提取原料需要加热,不适用于化学性质不稳定组分提取的问题[8],MAHD 既有水蒸气蒸馏法设备简单、易操作和易分离纯化的优点[9],又结合了微波辅助技术对某些组分的高效选择性和省时、产物提取率高的特点,两者结合可以大大加快香精提取的速度以及提高产物的提取率[10]。MAHD 已经在天然产物的提取中有过较多报道,是一种可靠的方法,而关于其在景天科多肉植物香精提取研究则较为少见[11]。
本文通过MAHD 法提取凝脂莲香精,采用气相色谱-质谱联用(GC-MS)分析仪[12]分析和鉴定原植株香精与叶片、茎秆香精化学成分的差异,对比三者成分,探求三者的关系;同时,利用单因素试验法[13],探讨固液比、浸泡时间、微波功率、提取时间四个因素对香精提取率的影响,总结凝脂莲香精的最佳提取条件,得出最高提取率。目前,已发现景天科多肉植物相对于其他多肉植物的香精挥发性物具有抑菌[14]、抗氧化、消炎、抑制细胞毒性[15]等作用。本文也希望提取出的香精在帮助种植户们解决囤积问题,增加收入的同时,能为植物种植领域[16]做出独特的贡献,成为一项有意义的研究。
1 材料与方法
1.1 材料准备与实验仪器
试验所用凝脂莲购于山东欣美多肉植物种植基地。取新鲜凝脂莲的地上部分,将叶片和杆茎分别切出小口,避免在干燥过程中爆裂[17],再放入干燥箱中,初始温度定为40 ~ 50 ℃,时间为2 h,中期控制温度在55 ℃左右,放置10 h,后期升温至60 ℃,等待5 h,最后取出并趁热使用粉碎机分别粉碎,得到的产物使用目筛筛至10 目,随后及时使用密封袋装取备用。
试验所用试剂无水硫酸钠、异丙醇(分析纯,质量分数为98%)均购于上海阿拉丁试剂有限公司。
真空干燥箱(北京益康科学仪器有限公司);XH-300A 微波-超声波合成萃取仪(北京祥鹄科技发展有限公司);气相色谱-质谱联用分析仪(Agilent,美国)。
1.2 微波辅助水蒸气法提取凝脂莲精油
分别准备25 g 的凝脂莲叶片及杆茎干样和200 g 蒸馏水即固液之比为1∶8,将干样浸泡到蒸馏水中,等待2 h,结束后加入至微波-超声波合成萃取仪中,上端连接冷凝管和挥发油测定器进行微波辅助-水蒸气蒸馏。微波提取功率为400 W,无馏分蒸出后关闭微波提取装置,收集冷却至室温后的精油,3 500 r·min-1离心10 min,取上清液经无水硫酸钠脱水后得到凝脂莲叶片及杆茎香精[18],精确称量其质量并记录,密封后保存于4 ℃冰箱。计算凝脂莲精油提取率:
式(1)中,mg是脱水后香精的质量,mo是凝脂莲使用的质量。
1.3 香精成分分析测定条件
1.3.1 植株香精成分测定-顶空固相微萃取[19]
(1)将一年生的新鲜凝脂莲植株清洗干净晾干,把植株均匀剪成小粒,称取1.0 g 放入顶空瓶,加入9 mL蒸馏水,插入萃取头于45 ℃下萃取,时间30 min,在气相色谱仪进样口250 ℃下热解析6 min,启动气质仪采集,进行GC-MS 分析。
(2)气相色谱条件[18]:RTX-5MS 型弹性石英毛细管色谱柱,载气为高纯度氦气(99.999%),柱内载气流量1.30 mL·min-1;进样口温度230 ℃。升温程序:从60 ℃开始保持2 min;以4 ℃·min-1升温至80 ℃,保持1 min;再以10 ℃·min-1升温至120 ℃,保持1 min;以5 ℃·min-1升温至180 ℃,保持1 min;最后以20 ℃·min-1升温至220 ℃;不分流进样。
(3)质谱条件:电子轰击离子源为EI 源;离子源温度230 ℃;接口温度280 ℃;电子能量70 eV;倍增器电压0.9 kV;溶剂延时5 min;扫描范围35 ~ 600 m·z-1。
1.3.2 叶片和茎秆香精成分测定
(1)在1 mL 异丙醇中溶解100 μL 叶片或茎秆的香精,充分震荡摇匀作为待测液,进行GC-MS 分析。
(2)气相色谱条件:同1.3.1(2)中的条件。
(3)质谱条件:同1.3.1(3)中的条件。
1.4 单因素实验
通过1.2 节的实验发现茎秆香精提取率远高于叶片,所以单因素实验只考虑茎秆香精的提取率。按照1.2节方法,每次改变1 个因素条件,研究固液比即不同量凝脂莲茎秆干料与水的比例(1∶4、1∶6、1∶8、1∶10、1∶12 W/W)、提取时间(1.5、2.0、2.5、3.0、3.5 h)、浸泡时间(30、60、90、120、150 min)、和微波提取功率(100、200、400、600、800 W)对凝脂莲茎秆香精提取率的影响。
1.5 正交试验设计
通过单因素实验考察,固液比发生变化会影响微波功率下微波集中吸收量,改变香精的提取率,两者互相影响,不可同时改变,故以固液比为1∶8,凝脂莲茎秆香精得率为考察指标,选择浸泡时间、微波功率和提取时间3 个因素进行正交试验,因素水平设计见表1,结果见表4、表5。

表1 微波辅助水蒸气法提取凝脂莲茎秆香精的水平因素Tab.1 Level factors of extracting essential oil from stem of S. clavatum by microwave-assisted hydro-distillation (MAHD)
2 结果与分析
2.1 叶片与茎秆香精提取率
由表2 可知,凝脂莲叶片与茎秆的香精提取率相对比,茎秆的香精提取率要远高于叶片,但是茎秆的香精提取时间大约为叶片香精提取时间的两倍,耗时差异较大可能是因为茎秆处细胞间隙较大,组织细胞充分膨胀裂开时间较久。

表2 微波辅助水蒸气法对凝脂莲叶片与茎秆香精的提取率Tab. 2 Yield of essential oil from leaves and stems of S. clavatum by MAHD
2.2 植株、叶片、茎秆香精成分分析
在上述色谱与质谱条件下,得到凝脂莲植株、茎秆、叶片香精气相色谱-质谱总离子流量图,如图1。共检测出39 种主要化学成分,凝脂莲香精组分分析鉴定结果见表3。由图1、表3 可得,从凝脂莲植株香精挥发物中共鉴定出17 种主要化学物质,其中烯烃类7 种,占总挥发物质种数的39.58%;酸类3 种,占总挥发物质种数的11.18%,脂类2 种,占总挥发物质种数的6.63%。主要挥发物成分及占总挥发物质种数比例是1R-α-蒎烯(15.50%)、(+)-α-长叶蒎烯(10.82%)、柠檬烯(8.95%)、软脂酸(6.27%)、9,12-十八碳二烯酸丁酯(3.92%)、3,5-二叔丁基-4-羟基苯基丙酸(3.76%)。从凝脂莲茎秆所提取的香精挥发物中鉴定出14 种化学物质,其中烯烃类3 种,占总挥发物质种数的5.45%;醇类3 种,占总挥发物质种数的36.94%,无醛类。主要挥发物成分及占总挥发物质比例是桉叶油醇(31.40%)、2,4-二叔丁基苯酚(12.04%)、皮蝇磷(7.88%)、异辛烷(6.04%)。从凝脂莲叶片所提取的香精挥发物中鉴定出8 种化学物质,其中酮类2 种,占总挥发物质种数的3.95%;醇类1 种,占总挥发物质种数的10.15%,无烯烃类。主要挥发物成分及占总挥发物质种数比例是2,4-二叔丁基苯酚(28.38%)、4-萜烯醇(10.15%)、2,6-二羟基苯乙酮,双(三甲基甲硅烷基)醚(8.95%)、油酸腈(6.18%)。

图1 凝脂莲香精气相色谱-质谱总离子流量图Fig. 1 GC-MS total ion current of volatile aromatic compounds from S. clavatum essential oil
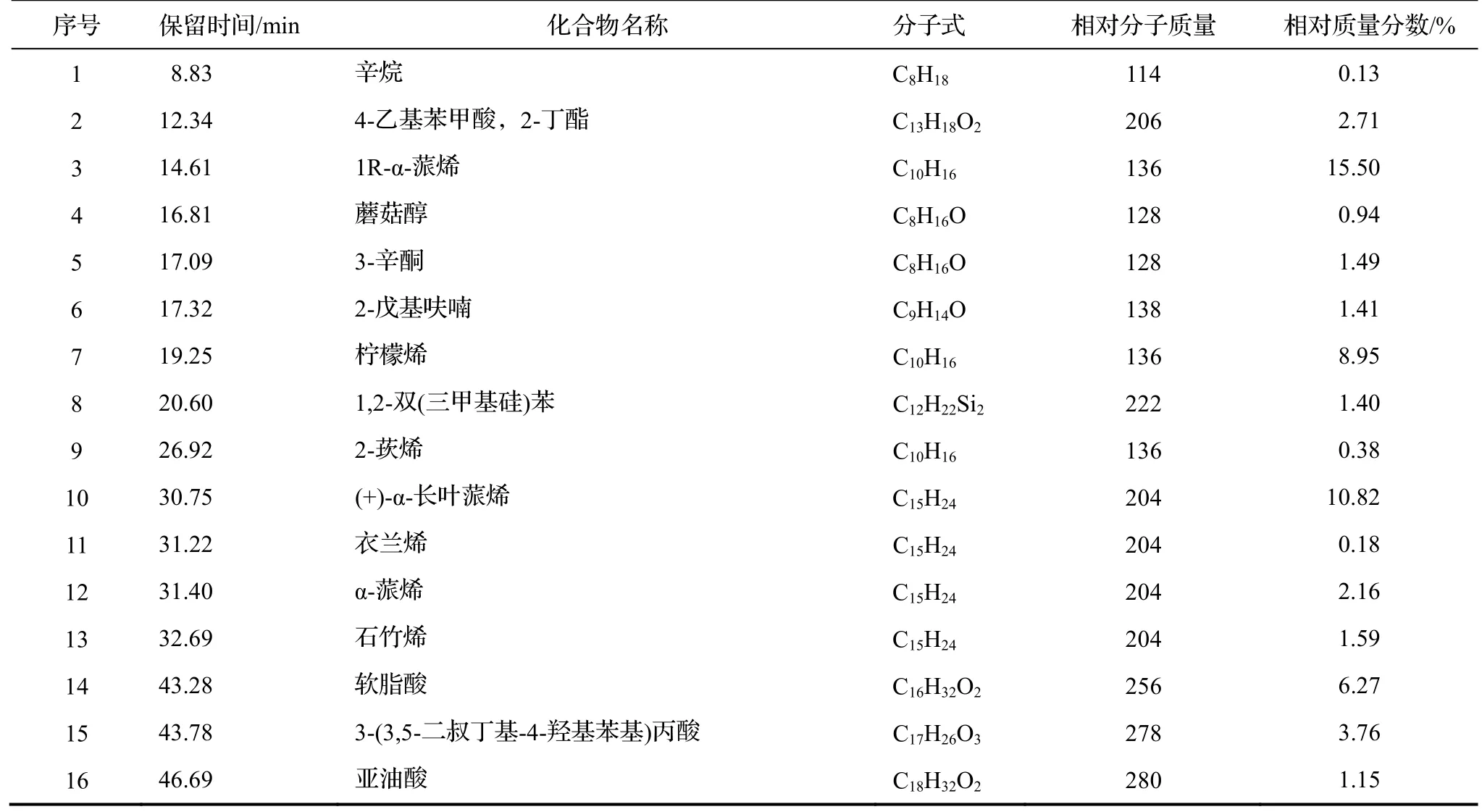
表3 凝脂莲香精组分分析(主要成分)Tab. 3 Components of essential oil of S, clavatum
2.3 单因素对凝脂莲茎秆香精提取率的影响
2.3.1 固液比对凝脂莲香精提取率的影响 研究凝脂莲茎秆干样与水的各种比例对凝脂莲香精提取率的影响,结果如图2。由图2 可知,不同固液比对凝脂莲香精提取率的影响比较明显,随着水量的增加,提取率增加,这是因为更多的极性水渗入植物器官与腺体,当传输系统中存在极性分子相互作用时,导致局部过热,更多的极性水会使植物体内的压力梯度增加,细胞壁破裂,导致香精成分更容易被释放到溶液中去。当固液比在1∶8 时,茎秆的香精提取率最高,随着水的比例持续增加,香精在水中的溶解度增大导致水介质中香精含量损失[20],香精提取率降低。
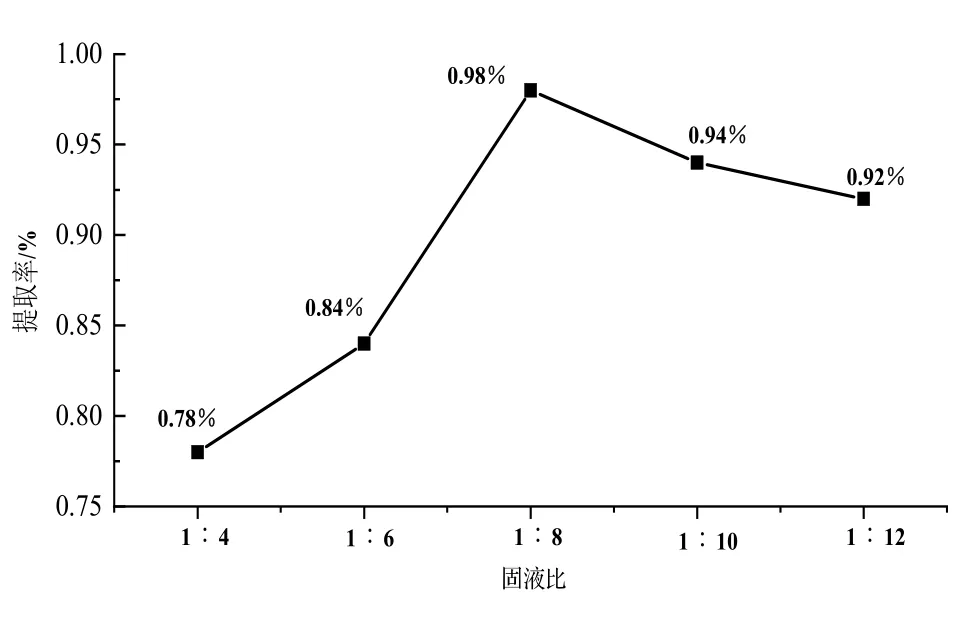
图2 不同固液比对香精提取率的影响Fig. 2 Effect of different solid-liquid ratio on the extraction rate of essential oil
2.3.2 浸泡时间对凝脂莲香精提取率的影响 浸泡时间对凝脂莲香精提取率的影响,结果如图3 所示。由图3 可知,浸泡时间从60 min 到150 min 之间,香精提取率相对稳定,其中,浸泡时间为60 min 时,香精提取率相对较高,浸泡60 min 后,香精提取率下降,在120 min 到150 min 之间时,香精提取率又上升,但未超越浸泡60 min 时的香精提取率,因此,确定最佳浸泡时间为60 min。
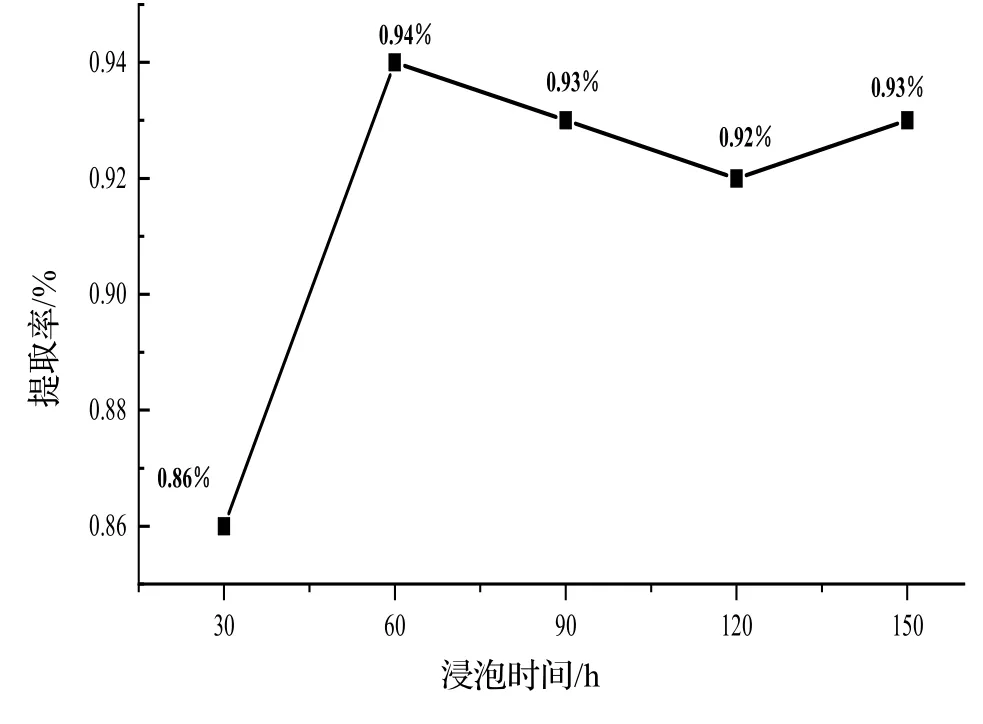
图3 不同浸泡时间对香精提取率的影响Fig. 3 Effect of different soaking time on the extraction rate of essential oil
2.3.3 微波功率对凝脂莲香精提取率的影响 微波功率对凝脂莲香精提取率的影响,结果如图4 所示。由图4 可知,挥发性香精的提取率会随着微波功率的增加而增加,这是由于在较高的微波功率下,微波能集中被水吸收,从而提高了凝脂莲挥发性香精的释放率,当微波功率超过400 W 时,更高的功率会使整个传输系统在短时间内发生相互碰撞,减少了香精的组分,因此微波最佳功率为400 W。
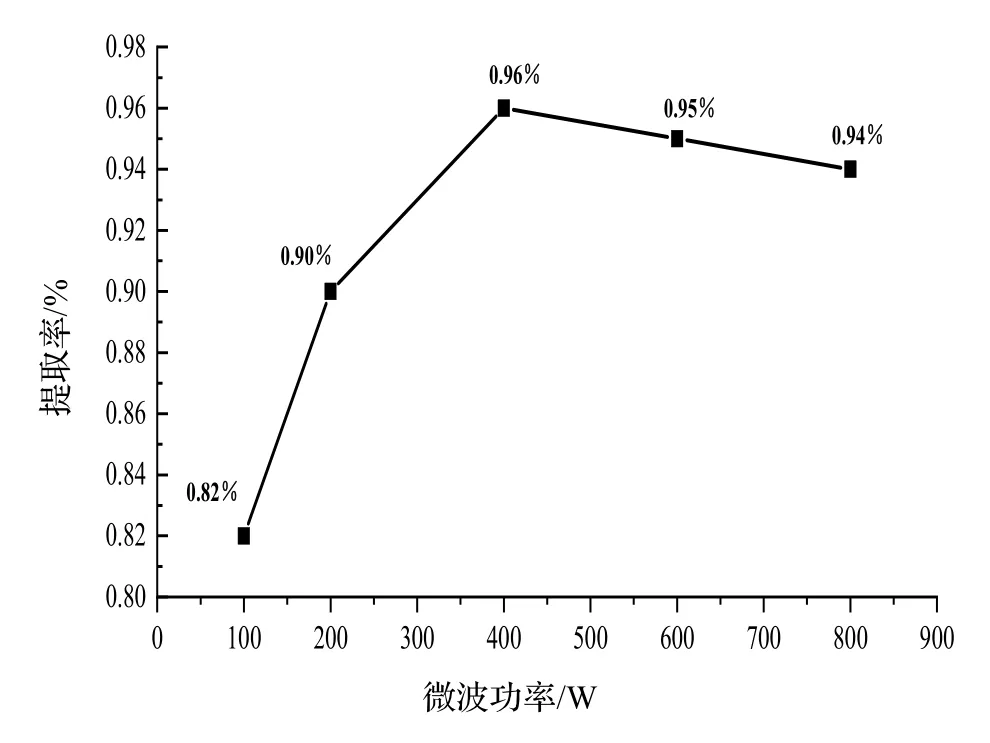
图4 不同微波功率对香精提取率的影响Fig. 4 Effect of different microwave powers on extraction rate of essential oil
2.3.4 提取时间对凝脂莲香精提取率的影响 提取时间对凝脂莲香精提取率的影响,结果如图5 所示。由图5 可以看出,随着时间的增加,凝脂莲挥发性香精的提取率不断增加。因为提取时间增加植物细胞间隙增大,组织细胞充分膨胀,使细胞内、外液交换速度更快,有利于香精提取率的提高。在提取时间为3 h 时香精提取率达到顶峰,但提取3 h 之后,随着香精在水中的溶解,精油提取率降低。综合考虑,最佳提取时间为3 h。
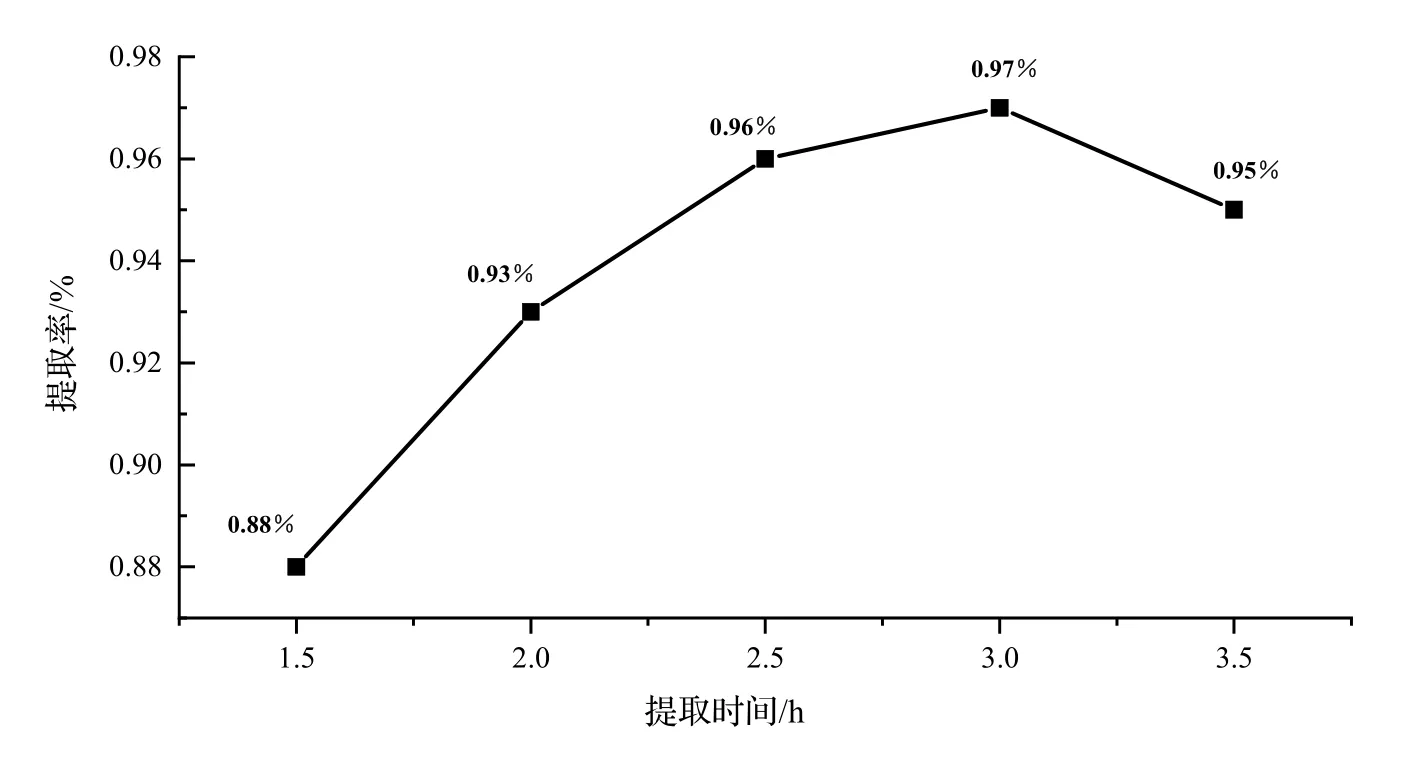
图5 不同提取时间对香精提取率的影响Fig. 5 Effect of different extraction time on the extraction rate of essential oil
2.4 正交试验结果
由表4、表5 可知,微波辅助水蒸气法提取凝脂莲茎秆香精的各因素中,微波功率影响最大,其次是提取时间,浸泡时间影响最小,但三者影响均无显著性。最佳提取工艺是A1B2C3,即浸泡时间60 min、微波功率400 W、提取时间3 h,固液比1∶8。

表4 微波辅助水蒸气法提取茎秆香精正交试验的结果Tab. 4 Result of orthogonal experiment on extraction of essential oil from stem by MAHD
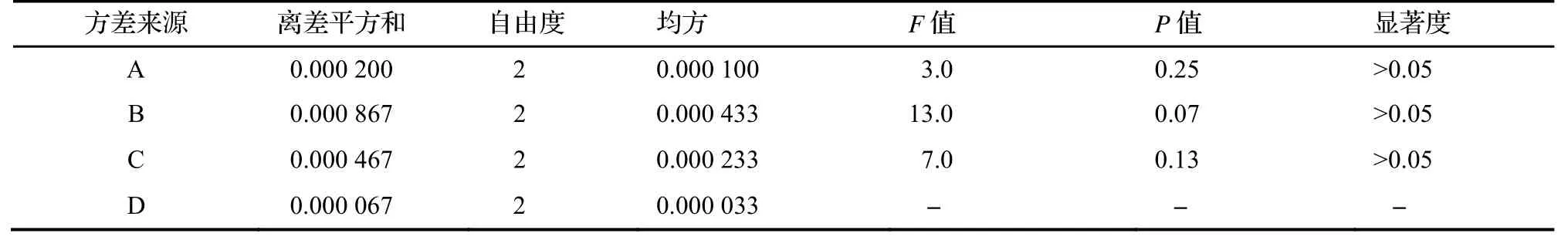
表5 方差分析结果Tab. 5 ANOVA result
3 讨论与结论
本研究采用GC-MS 测定发现凝脂莲茎秆香精与植株香精重复成分为2 种,分别是1R-α-蒎烯、石竹烯,在原植株挥发物总种数中占比分别为15.60%、1.31%。而叶片所提取的香精与植株香精无重复成分。将两者对比,茎秆香精在重复成分以及香精的含量上都要高于叶片香精。凝脂莲茎秆香精成分中含有大量的醇类及烯烃类化合物,相对于王利国等[21]采用GC-MS 检测栀子Gardeniajasminoides花香精化学成分主要有酯类、萜烯类、烃类化合物;刘更涛[22]采用GC-MS 检测牡丹Paeoniasuffruticosa香精化学成分主要有醛类及醇类化合物。上述报道中有关凝脂莲香精成分与其他植物香精成分差异较大,推测主要原因可能与植物本身特性以及各自的提取方法有关,有待于进一步深入研究阐明。
本研究中使用凝脂莲茎秆来提取香精效果要远高于叶片提取香精效果。原因有以下几个方面:第一,叶片香精提取率远低于茎秆香精提取率,大约只有茎秆香精提取率的1/4;第二,由于其叶片为肉质结构,在干燥烘干过程中一旦没有事先切出小口容易发生爆裂,而茎秆干燥烘干则无爆裂危险。遂在单因素实验和正交试验中只考虑对茎秆香精的提取率影响。由单因素实验和正交试验可知,在实验室环境下,在固液比1∶8、浸泡时间60 min、微波功率400 W、提取时间3 h 的条件下,凝脂莲香精提取率最高,平均提取率达到了0.96%,在现实产业化过程中,此数据可供参考。通过实验研究我们可以得到,无论是在提取率还是在香精成分研究上都是使用茎秆来提取为优。再加上实际中,凝脂莲由于其叶片厚实,茎秆香精含量高[23],大多使用叶片“叶插”繁殖,且春秋为凝脂莲的生长季,所以在实际产业化时,可以采用“春秋叶片扦插,冬夏茎秆提取”的轮作型产业方式。对凝脂莲的香精成分分析旨在通过对其挥发物成分进行定性和定量分析[24],同时为今后对凝脂莲的其他科学研究提供参考价值。

