晚期非小细胞肺癌患者骨转移灶与内脏病灶的全身药物治疗反应差异分析
丁朝伟 梁海杰 尉然 于沂阳 郭卫
肺癌是我国乃至全球男性和女性癌症发病率及相关病死率均较高的恶性肿瘤,近年来其发病率和病死率呈明显上升趋势[1-2]。80% 的肺癌患者其病理亚型为非小细胞肺癌 ( non-small-cell lung cancer,NSCLC ),其中腺癌又是最常见的亚型。随着基于靶向药物的个性化药物的出现与发展[3],以及免疫检查点抑制剂免疫疗法的常规使用[4],包括手术治疗、放疗及全身药物治疗的综合治疗方案正应用于所有NSCLC 患者,化疗、免疫治疗以及新型靶向药物的联合应用可显著改善晚期肺癌患者的预后,总生存期( overall survival,OS ) 甚至可远长于 5年[5]。然而,在大多数 NSCLC 患者中,远处转移 ( distant metastasis,DM ) 的存在仍然是高病死率的原因之一[6],并且在药物治疗过程中获得耐药性的出现更让晚期 NSCLC 患者的治疗效果不尽如意[7]。
临床观察表明,通过远处转移部位可以在一定程度上预测其预后情况。晚期 NSCLC 患者的转移发展优先转移到骨骼、大脑、肝脏、对侧肺和肾上腺[8-9],其中约 20%~30% 的 NSCLC 患者在诊断时就伴有骨转移,约 30%~40% 的晚期患者会发生骨转移[10],骨转移灶的出现会导致疼痛、骨骼相关事件 ( skeletal related events,SRE ) 发生及行动能力和生活质量下降,会对患者及社会造成很大的心理和经济负担。既往研究表明伴有骨转移的晚期 NSCLC患者预后不如伴有脑转移及其它内脏转移者,其总生存率显著下降,术后 1年的 OS 从 71.6% 降至46.8%[11]。
可见,用于晚期 NSCLC 患者的全身药物治疗方案,对于已发生骨转移灶者或内脏转移灶者的疗效反应存在差异。然而,既往对 NSCLC 骨转移研究重点是在早期阶段识别“高风险”患者[12],而关于NSCLC 骨转移治疗的报道很少,这与骨转移的高发生率是不一致的。
本研究旨在探究晚期 NSCLC 患者的骨转移灶与内脏转移灶对全身药物治疗的反应差异,从临床特征及基因表达层面,寻找其相关因素,进而为NSCLC 骨转移患者的综合治疗方案提供理论基础。
资料与方法
一、纳入标准与排除标准
1. 纳入标准:( 1 ) 2010年 1月至 2020年 12月,在我院骨肿瘤科就诊的晚期 NSCLC 骨转移患者;( 2 ) 通过穿刺活检或术后病理以及影像学检查确诊为晚期 NSCLC 者;( 3 ) 临床资料完整者;( 4 )骨转移灶术前长期接受全身药物治疗 ( 包括术前长期化疗、免疫治疗或靶向治疗 ) 者;( 5 )年龄 >18 岁者。
2. 排除标准:( 1 ) 骨转移灶术前未进行全身药物治疗者;( 2 ) 无法评估骨转移或内脏转移灶的药物反应者;( 3 ) 携带非 EGFR 突变类型患者。
二、研究对象
基因表达数据来自 GEO ( gene expression omnibus )数据库中 GSE76194 数据集,挑选其中 4 对中国来源的肺癌原发灶和相应的骨转移灶样本数据,探针基于 GPL570 ( Affymetrix Human Genome U133 Plus 2.0 Array ) 平台转换成基因表达矩阵。
三、临床资料收集
本研究共纳入 74 例。收集患者的一般资料 [年龄、性别、体质量指数 ( body mass index,BMI )、吸烟史、肺癌确诊时间、初诊分期、病理分型及基因突变情况、初诊是否有转移及转移部位、发生内脏转移时间及骨转移时间 ]、全身药物治疗资料 ( 全身药物治疗开始时间及具体方案、是否使用双磷酸盐或地诺单抗等骨保护药物及开始时间 ) 及全身药物治疗后资料 ( 原发灶及转移灶是否进展、是否出现新发转移灶、是否行局部放疗、是否进行骨转移灶手术、骨转移灶手术前的生化指标 )。数据来自医院病历记录或直接从患者或患者家属处获得。
四、分组及评价标准
根据全身药物治疗后首次进展时间将患者分为内脏病灶优先进展组与骨转移灶优先进展组,下文中简称为内脏病灶组与骨病灶组。全身药物治疗方案根据确诊时患者分期制定,主要观测指标为疾病进展时间 ( time to progression,TTP ),即从开始全身药物治疗到骨转移灶或内脏病灶发生进展的时间,根据实体瘤疗效评价标准 ( response evaluation criteria in solid tumors,RESIST ) 1.1 版制定疗效评价标准,利用电子计算机断层扫描 ( computed tomography,CT )测量靶病灶最长径变化以监测治疗反应,骨转移灶进展定义为接受全身药物治疗后出现新发骨转移或可测量骨转移靶病灶最长径之和增加 20%;内脏病灶进展定义为接受全身药物治疗后内脏病灶出现新发转移或内脏转移靶病灶最长径之和增加 20%。
五、临床数据分析
定量数据用±s( 范围 ) 表示,定性数据用计数 ( 百分比 ) 表示。采用单因素及多因素 Logistic 回归分析,比较影响病灶进展先后的临床因素。使用单变量 Cox 回归模型对骨转移优先进展预后因素进行分析,进展情况采用 Kaplan-Meier 方法估计,并使用对数秩检验进行比较,采用 Cox 比例风险模型进行多因素分析进一步探索骨转移灶优先进展的独立预后因素。检验水准 α 值取双侧 0.05。所有分析均使用 R 4.1.3 软件完成。
六、基因表达数据分析
首先在 R 4.1.3 软件上,使用 GEOquery 软件包下载基因表达矩阵文件和注释文件。使用 Idmap1 软件包进行注释获得基因表达谱,并通过 Limma 软件包[13]筛选在亲本细胞原发灶与骨转移灶的差异表达基因,差异表达基因筛选标准为P< 0.05 以及对两组基因表达量比值 ( fold change,FC ) 取 2 为底的对数的绝对值 ( | Log2 ( FC ) | > 2。使用 Pheatmap 包对上调和下调基因进行聚类分析。通过 GSEA ( gene set enrichment analysis ) ( Version 3.0 ) 进行骨转移组和原发灶组差异表达的基因耐药相关生物学途径富集。耐药相关 Geneset 通过以“Drug Resistance”和“Lung Cancer”为关键词检索分子特征数据库( molecular signatures database,MsigDB ) 获得。P<0.05 以及标准化富集得分 ( normalized enrichment score,NES ) 的绝对值 > 1 的富集结果被认为是显著的,并由错误发现率 ( false discovery rate,FDR ) <0.25 进行校正。
结 果
一、骨转移灶及内脏病灶全身药物治疗反应性差异
本组 74 例 中 15 例晚期肺癌患者接受全身药物治疗后发现内脏病灶优先进展 ( 内脏病灶组 ),59 例出现骨转移灶优先进展 ( 骨病灶组 ),骨转移灶优先进展率及内脏病灶优先进展率分别为 79.7% 以及20.3%。Wilcoxon 符号秩检验显示,骨转移和内脏转移的优先转移率差异有统计学意义 (P< 0.05 ),最终 26 例发现内脏病灶进展,74 例均发现骨转移灶进展。内脏转移灶与骨转移灶中位进展时间分别为18.0 ( 14.8~21.2 ) 个月与 15.0 ( 11.2~18.8 ) 个月。两组在性别、年龄、BMI、吸烟史、转移部位、原发病理类型、实验室检验结果等基线特征上差异无统计学意义 ( 表 1 )。
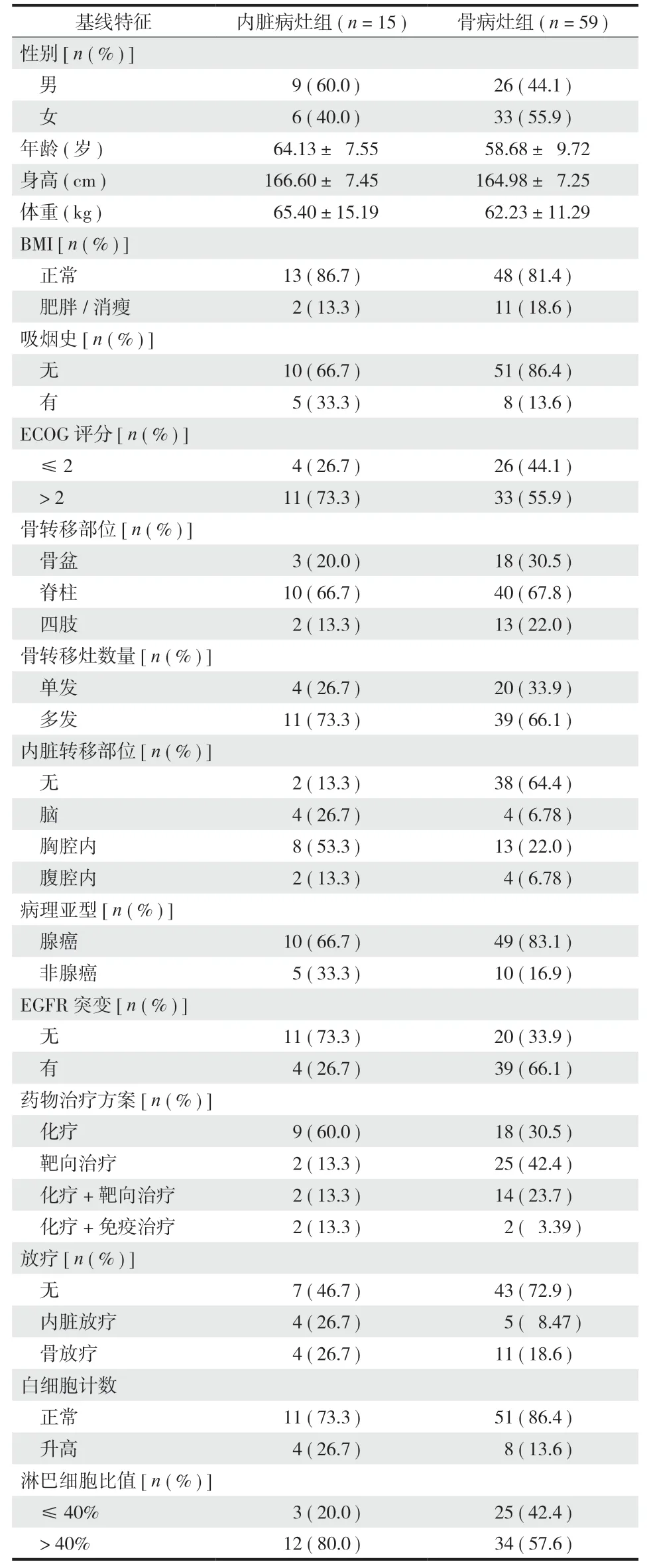
表1 两组患者的变量描述性统计 ( n = 74 )Tab.1 Descriptive statistics of variables with no missing data collected and used for research ( n = 74 )
二、全身药物治疗反应性差异相关因素
内脏病灶组作为对照组,骨病灶组作为病例组进行 Logistic 回归分析。结果提示存在 EGFR 突变、药物治疗前伴有内脏转移以及药物治疗前内脏转移部位是骨转移灶优先进展的相关因素。将单因素分析结果中P< 0.05 的因素纳入,行多因素 Logistic 回归分析,结果显示 EGFR 突变状态以及药物治疗前内脏转移部位是独立相关因素 ( 表 2 )。

表2 骨病灶组与内脏病灶组单因素及多因素 Logistic 回归分析结果Tab.2 Results of univariate and multivariate Logistic regression analysis in bone lesion group and visceral lesion group
三、晚期 NSCLC 患者骨转移优先进展预后因素
本组 59 例出现骨转移灶优先进展。单因素分析结果提示药物治疗前有骨转移灶、仅使用靶向药物以及内脏病灶接受放疗是影响骨转移灶优先进展的预后因素 ( 表 3 )。将单因素分析结果中P< 0.1 的因素进一步纳入多因素 Cox 回归分析,结果显示有吸烟史、仅使用靶向药物、内脏病灶接受放疗以及药物治疗前伴腹腔内转移可能是影响骨转移灶优先进展的独立危险因素,使用 Kaplan-Meier 方法构建进展曲线 ( 图 1~4 )。
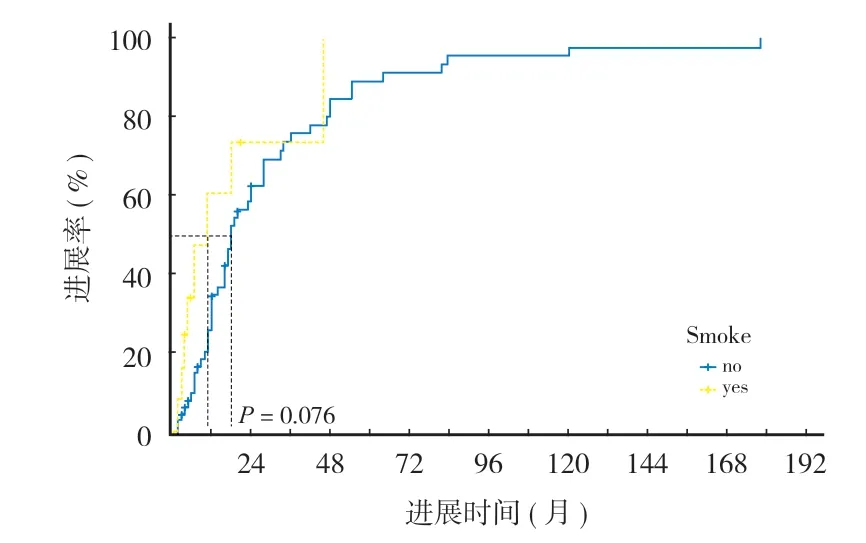
图1 吸烟史分组骨转移灶优先进展率的 Kaplan-Meier 图Fig.1 Kaplan-Meier plot of the priority progression rate of bone metastases in groups with smoking history
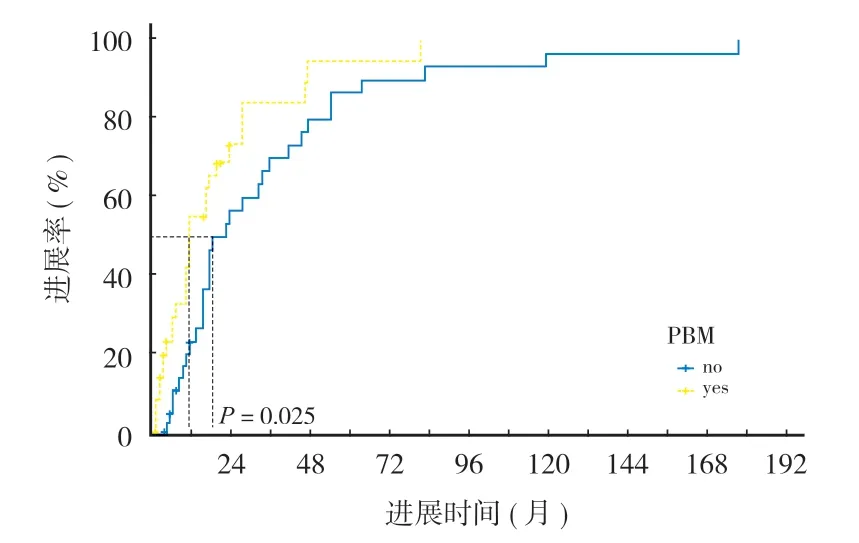
图2 全身药物治疗前骨转移分组骨转移灶优先进展率的Kaplan-Meier 图Fig.2 Kaplan-Meier plot of the priority progression rate of bone metastases in groups with primary bone metastases

图3 全身药物治疗方案分组骨转移灶优先进展率的Kaplan-Meier 图,C 代表单一化疗,T 代表单靶向,C + T 代表化疗联合靶向治疗,C + I 代表化疗联合免疫治疗Fig.3 Kaplan-Meier plot of the priority progression rate of bone metastases in groups with drugs. C: Single chemotherapy; T: Single target; C + T: Chemotherapy combined with targeted therapy; C + I:Chemotherapy combined with immunotherapy
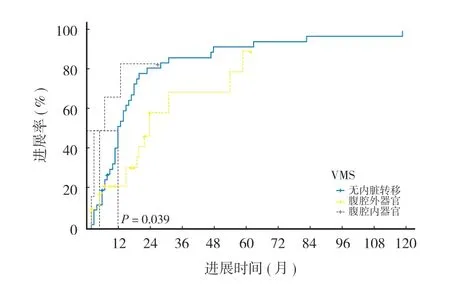
图4 内脏转移部位分组骨转移灶优先进展率的 Kaplan-Meier 图Fig.4 Kaplan-Meier plot of the priority progression rate of bone metastases in groups with visceral metastasis sites
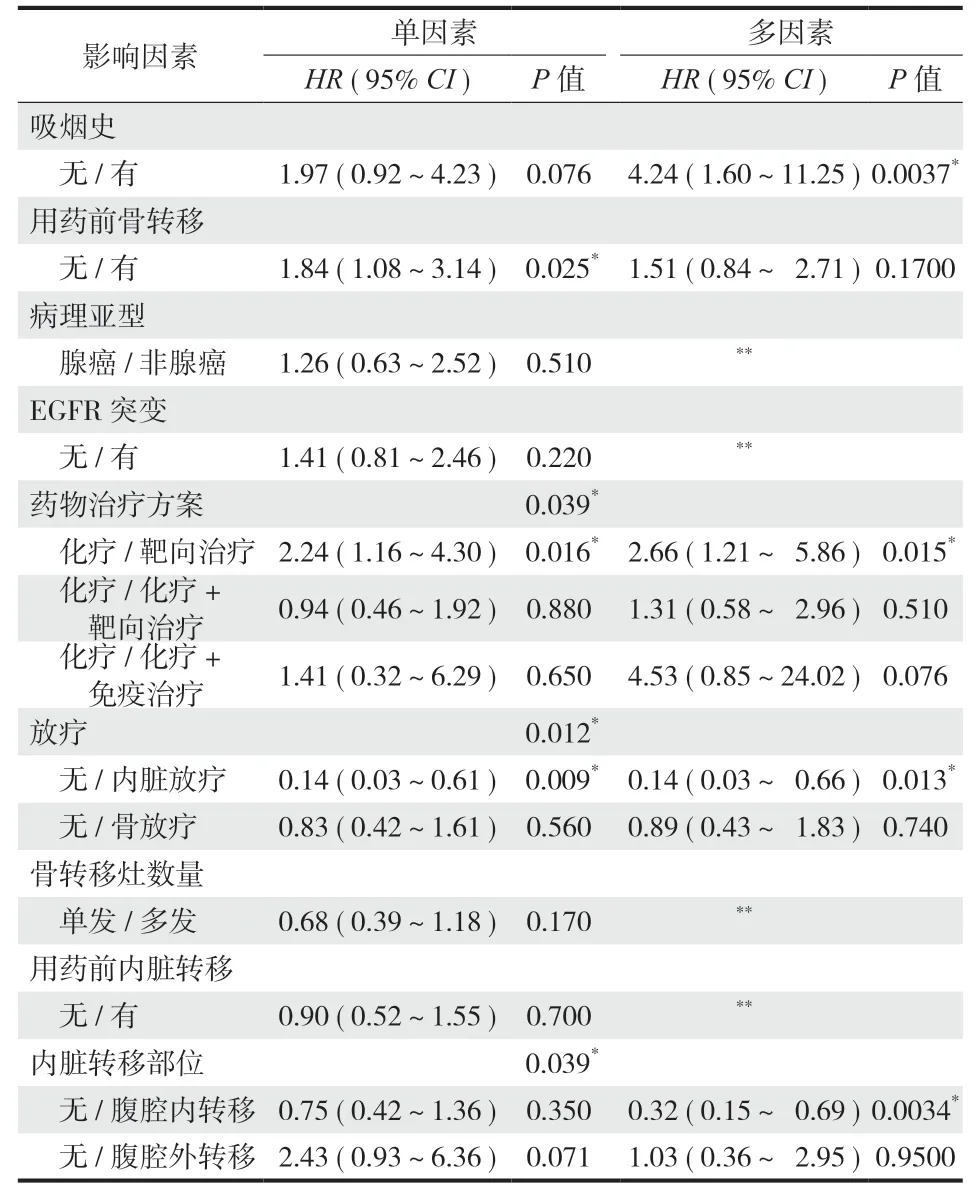
表3 晚期 NSCLC 患者骨转移灶进展 Cox 比例风险模型分析结果Tab.3 Results of Cox proportional risk model analysis of bone metastasis progression in advanced non-small cell lung cancer patients
四、骨转移灶与原发灶差异表达基因 ( DEGs )筛选
本研究首先从 GEO 数据集 ( GSE76194 ) 中获得了 4 对晚期肺癌骨转移灶与原发灶的基因表达谱。基于 R 统计软件中 Limma 包的差异基因分析,获得了样本的基因表达矩阵,共鉴定出 20 188 个基因。使用P< 0.05 和 | Log2 ( FC ) > 2 的标准进行筛选,本研究发现 938 个显著差异表达的基因,其中376 个基因上调,562 个基因下调。差异表达 mRNA谱结果的表达水平以热图和火山图的形式表达( 图 5 )。
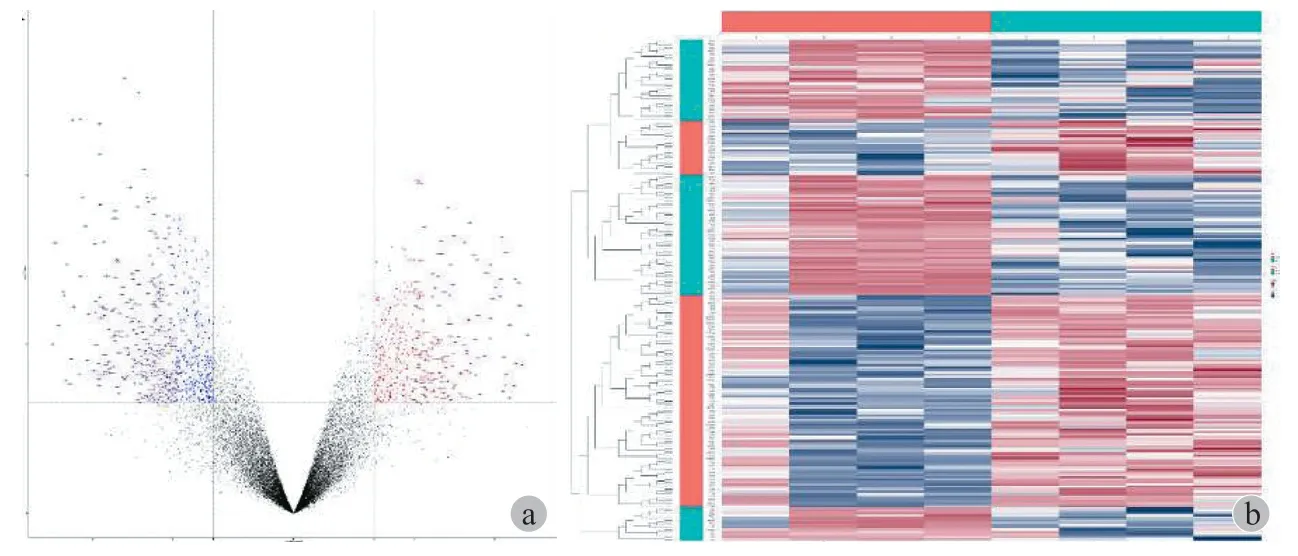
图5 骨转移灶及原发灶差异基因筛选 a:差异基因火山图,位于坐标图区域内的红色和蓝色点表示差异表达基因,而灰色点表示未差异表达的基因,横轴表示 Log2 ( fold change ),纵轴表示-Log ( P value ),筛选标准为 | Log2( FC ) | > 2 以及 P < 0.05。蓝色,下调基因;红色,上调基因;DEG,差异表达基因。b:差异基因热图,显示低 ( 蓝色 ) 到高 ( 红色 ) 基因表达水平在 NSCLC 骨转移灶中具有不同的分布。通过基因进行聚类,每列顶部的条形图显示以下内容:蓝绿色代表原发灶,橘红色代表骨转移灶Fig.5 Volcano plot ( a ) and heat map ( b )visualizing the screening of DEGs of GSE76194. For volcano plot ( a ), the horizontal axis represented Log2 ( fold change ), and the vertical axis showed the reliability of -Log ( P value ). The red and blue points falling within the region of interest in the plot represented the differentially expressed genes, while the grey dots represented genes that are not differentially expressed, defined by | Log2 ( FC ) | > 2 and P < 0.05. Blue, down expression; Red, up expression; DEG, differentially expressed gene. Heat map ( b ) illustrating lower ( blue ) to higher ( red ) gene expression levels with distinct profiles across NSCLC bone metastasis. Rows were clustered by genes. Bars at the top of each column indicated the following:Turquoise = parental; Flame = bone metastasis
五、骨转移灶与原发灶耐药性差异验证
本研究采用 GESA 方法对 GSE76194 中获得的基因表达矩阵进行富集分析,共得到 1 个显著富集的上调表达通路以及 3 个显著富集的下调表达通路 ( 图 6a、b )。结果显示,骨转移灶中吉非替尼( Gefitinib ) 耐药相关通路上调,达沙替尼 ( Dasatinib )药物敏感性相关通路下调。
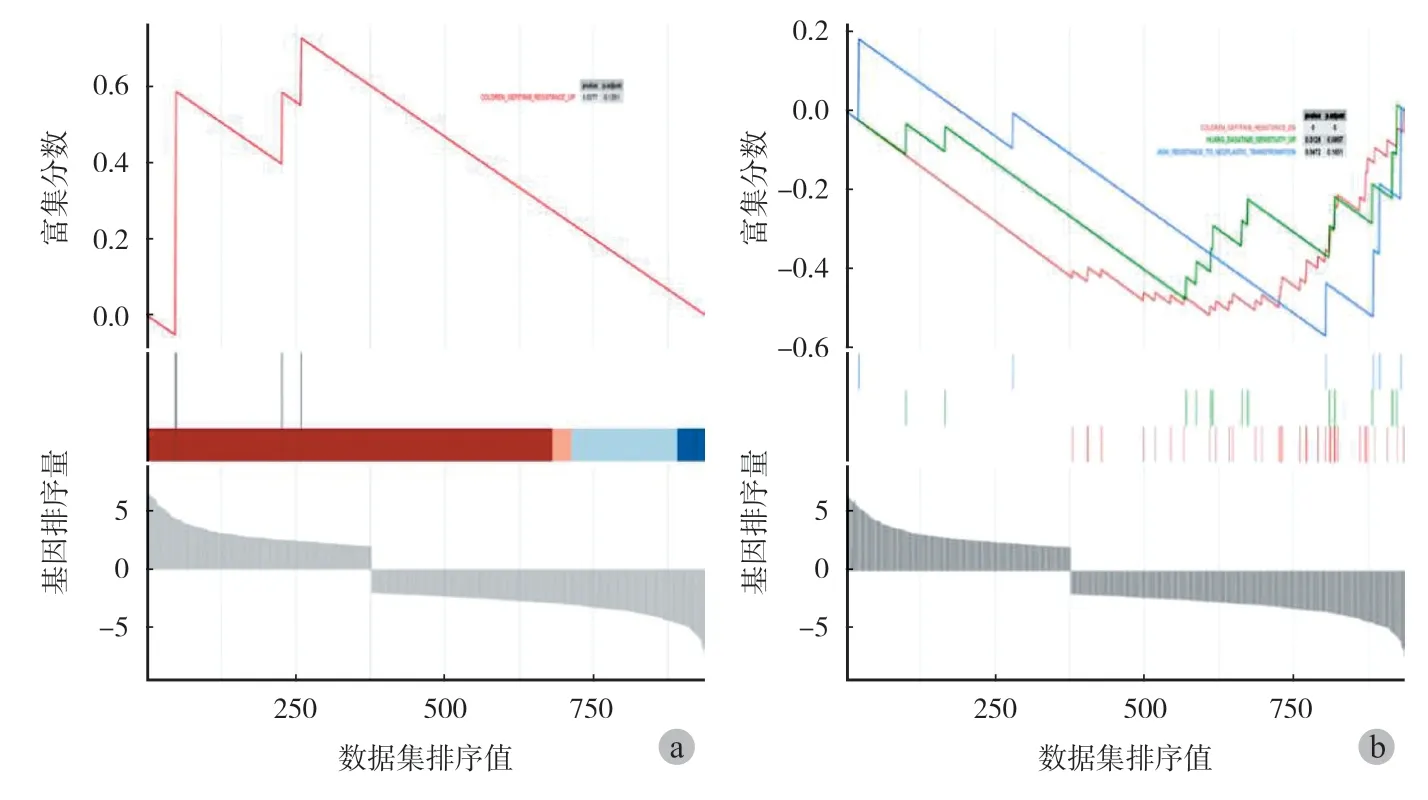
图6 骨转移灶与原发灶差异表达基因 GSEA 分析 a:GSEA 显著富集的耐药相关上调表达通路;b:GSEA 显著富集的耐药相关下调表达通路,筛选标准为 P < 0.05 且 FDR < 0.25,以及 | NES | > 1Fig.6 GSEA analysis of differentially expressed genes between bone metastases and primary site a: GSEA significantly enriched drug-resistance-related up-regulated expression pathways;b: GSEA significantly enriched drugresistance-related down-regulated expression pathway. The criteria: P <0.05, FDR < 0.25 and | NES | > 1
讨 论
一、NSCLC 骨转移灶与内脏病灶反应性差异
本研究中晚期 NSCLC 患者骨转移灶与内脏病灶全身药物治疗后,骨转移灶优先进展率明显高于内脏病灶,分别为 79.7% 以及 20.3% (P< 0.05 )。提示接受全身药物治疗时骨转移灶对全身药物的反应性相较于内脏病灶可能更差,骨转移灶进展过程中发生骨骼相关事件的可能性也会更大[14]。既往 Schmid等[15]的研究也证实了骨转移灶进展率较高的结果,但由于纳入病例数较少,故未与内脏病灶做有效的统计学检验。而在 Yoneda 等[16]的研究中则指出,晚期 NSCLC 患者在使用免疫检查点抑制剂治疗时,骨转移灶的存在是 PFS 和 OS 较差的独立危险因素,提示骨转移灶对全身药物治疗反应性相对较差。骨转移患者中 SRE 的发生率较高,发生 SRE 的患者需接受放疗、手术治疗在内的局部治疗,且一旦发生会严重影响患者的生活质量和生存率,可能导致伴有骨转移的晚期 NSCLC 患者预后更差。
二、全身药物治疗反应性差异相关因素
伴有 EGFR 突变的晚期肺癌患者骨转移灶全身药物治疗反应性更差。本研究的单因素及多因素 Logistic回归分析结果显示,EGFR 突变与全身药物治疗反应性差异高度相关 (P= 0.009 ),OR为 6.76,95% 置信区间为 1.60~28.60。这与既往研究是相符的,Chen等[17]对伴有 EGFR 突变的晚期 NSCLC 患者的单中心回顾分析研究结果显示,骨转移组患者接受 EGFRTKI 治疗的 PFS 和 OS 更短,骨转移为靶向治疗预后差的独立危险,并且单用 EGFR-TKI 治疗骨转移灶的进展时间较靶向治疗联合化疗的短[18]。因此,对于晚期 NSCLC 患者应积极进行基因检测,尤其是对于全身药物治疗后骨转移灶进展的患者,得知患者常见驱动基因的突变状态可以预测患者预后并指导综合治疗方案的制订。
晚期 NSCLC 患者腹腔器官转移灶相对于骨转移灶对全身药物治疗反应性更差。本研究 Logistic 回归结果提示,全身药物治疗前有腹腔器官转移时骨转移灶优先转移风险更低 (P= 0.001 ),OR为 0.078,95% 置信区间为 0.017~0.35。既往有研究提示肝转移是靶向治疗预后差独立危险因素[19-20],提示腹腔器官转移灶,尤其是肝转移灶相较于骨转移灶对全身药物治疗的反应性可能更差。当患者出现上述部位转移后须密切监测病灶变化,及时调整药物治疗方案,甚至可采用联合用药的方式控制病灶进展。至于单因素 Logistic 回归中P< 0.05 但未纳入回归方程的因素,包括放疗及药物治疗前是否有内脏转移,这些也可能是影响全身药物治疗反应性差异的相关因素,在之后的研究中应着重关注这些因素与病灶进展的关系。
三、骨转移灶优先进展的影响因素
有吸烟史的晚期 NSCLC 患者更可能发生骨转移灶进展。众所周知,吸烟是罹患肺癌的高危因素,也与 NSCLC 患者不良预后相关。本研究结果显示吸烟可能降低骨转移灶对全身药物治疗的反应性,HR( 95%CI) 是 4.4 ( 1.67~11.59 ),以致患者骨转移灶进展的风险更大[21]。因此,须密切关注有吸烟史的NSCLC 患者,及时进行骨骼相关的影像学检查,及时更换用药方案或采用联合用药。
除吸烟史外,仅靶向药物治疗的晚期 NSCLC 患者可能发生骨转移灶。本研究结果表明仅靶向治疗是单纯化疗后骨转移灶进展风险的 2.94 倍,95% 置信区间为 1.37~6.29,如表 3 所示。有研究证实发生骨转移,提示靶向治疗晚期 NSCLC 患者预后较差[17],也有研究显示对于晚期 NSCLC 患者联合治疗比单一治疗反应性更好[22]。这提示目前应用于临床的靶向药物可能对肺癌骨转移灶的治疗疗效较差,应积极寻找新的治疗靶点,甚至采用联合治疗方式,降低骨转移灶的进展率,从而延长晚期肺癌患者的总生存时间。
四、骨转移灶耐药性
为进一步验证骨转移灶与内脏病灶,对全身药物治疗反应性的差异,并寻找 NSCLC 骨转移新的治疗靶点。本研究进行了差异表达基因的筛选,结果显示骨转移灶中有与全身药物治疗耐药相关的表达通路上调。这从另一方面证明骨转移灶与内脏病灶对药物的反应存在差异。
EGFR 是公认的 NSCLC 的原癌驱动基因,在首次发现其致癌突变后,EGFR 酪氨酸激酶抑制剂( tyrosine kinase inhibitors,TKI ) 成为了 EGFR 突变阳性晚期患者的一线疗法[23]。既往的研究显示 EGFR过表达能够促进肺癌细胞增殖、侵袭迁移[3],从而促使肺癌发生与转移,下调其表达可以明显抑制肿瘤细胞的增殖,起到抑癌的作用。本研究结果显示NSCLC 骨转移灶与原发灶相比 EGFR 表达下调,这与达沙替尼药物敏感性下降有关。骨转移灶有其独有的间质细胞及免疫微环境,肿瘤相关成纤维细胞可以分泌多种炎症因子及生长因子参与肿瘤细胞增殖、凋亡的调控中[24-25],这个过程可能形成旁调节通路,从而诱导骨转移灶肿瘤细胞耐药性的产生,导致其对全身药物治疗的反应更差。引起反应性的差异具体机制仍须进一步研究。
五、本研究的局限性
本研究存在的局限性:( 1 ) 样本量只有 74 例相对较小,可能会导致预测模型过拟合;( 2 ) 作为回顾性研究,纳入患者的临床特征、长期随访结果很难全面获得;( 3 ) 患者药物治疗方案具有异质性,样本采集时间 2010-2021年,患者接受的药物治疗方案可能受治疗时间影响;( 4 ) 本研究未能收集到纳入患者的基因表达数据,无法直接验证耐药后骨转移灶与原发灶基因表达的差异。
总之,晚期 NSCLC 患者骨转移灶与内脏病灶对全身药物治疗反应存在差异,骨转移灶存在耐药相关通路的表达上调,伴有 EGFR 突变的患者骨转移灶较腹腔外内脏病灶对全身药物治疗反应性更差,建议对全身药物治疗反应性差的 NSCLC 骨转移患者采取积极的局部治疗。

