电池级磷酸铁的合成工艺优化及其性能研究
刘 彩,程先明,冯文平,胡 赞,娄金东
(中蓝长化工程科技有限公司,湖南 长沙 410116)
1 前言
磷酸铁(FePO4)又称为正磷酸铁,在自然界中以蓝铁矿的形式存在,常带有两个结晶水,是一种白色、粉红色或淡黄色粉末[1]。磷酸铁有多种不同的晶体类型,主要包括无定型结构、单斜晶系、α-石英结构、正交晶系和磷酸铁锂脱锂后形成的正交晶系异磷铁锰矿等。α-石英结构属于稳定结构,其他几种结构属于亚稳定结构,都可以在高温下转换成α-石英结构[2-3]。
磷酸铁广泛应用于农业、钢铁、食品、催化剂、陶瓷玻璃等领域[4]。因其与磷酸铁锂相似的化学结构,FePO4又被作为前驱体参与锂电池正极材料磷酸铁锂的制备,相比于其他的锂电池正极材料,磷酸铁锂由于原料来源丰富、价格低廉、容量高、安全性好等优点,成为近年来的研究热点[5-7]。而前驱体磷酸铁的化学成分、结构、形貌、粒径、性能在很大程度上决定了磷酸铁锂正极材料的综合性能,因此高品质磷酸铁的制备工艺至关重要[8-9]。
文章以七水硫酸亚铁和磷酸一铵为原料,采用一步法制备磷酸铁,并对相关工艺参数进行优化,得到质量高、品质好、能满足工业标准的磷酸铁产品。
2 实验
2.1 实验原料
七水硫酸亚铁,质量百分含量85%左右;磷酸一铵(分析纯),质量百分含量99%;磷酸(分析纯),质量百分含量85%;过氧化氢(分析纯),质量百分含量30%;浓硫酸(工业级),溶液质量百分含量98%。
2.2 实验准备
铁盐溶液的配置。取七水硫酸亚铁加入75 ℃纯水,搅拌10 min 左右,原料全部溶完,此时温度下降至51.80 ℃,且烧杯底部有少量黑色砂石块。pH值为1.82,溶液呈暗绿色。将上述配制的溶液在55 ℃水浴锅加热,加25%氨水控制pH 值为3.50~4.00,加入絮凝剂聚丙烯酰胺、硅藻土后用漏斗过滤,滤渣干燥称重,滤液用砂芯漏斗过滤后测得溶液pH值为3.70,最后加入98%浓硫酸调节pH值。
磷酸一铵溶液的配置。取磷酸一铵(纯度为99%)在70 ℃纯水溶解,冷却至常温下定容至2 L 容量瓶中。
双氧水的配置。取30%双氧水加纯水稀释至3%,测得pH值为5.10。
2.3 实验方法
实验采用一步法制备磷酸铁。首先,根据磷酸一铵溶液和铁盐溶液实测的磷、铁含量,以铁盐溶液400 mL 为基准称取对应的FeSO4溶液,按磷酸一铵和铁盐溶液的磷铁比(1∶1)、磷酸和铁盐溶液的磷铁比(0.15∶1)称取相应质量磷盐溶液加入到铁盐溶液中。实验过程中采用98%浓硫酸控制体系pH值,调至溶液澄清后,再加入3%双氧水,使Fe2+完全氧化成Fe3+,然后在一定温度下反应陈化一定时间得到白色悬浊液,对悬浊液进行过滤、洗涤和干燥,得到白色的FeSO4·2H2O,最后500 ℃下煅烧4 h 得到FePO4产品。工艺流程图见图1。一步法制备磷酸铁的相关工艺的控制条件复杂,影响因素较多,因此实验对其主要工艺参数(反应温度、铁离子浓度、体系pH值、反应时间)进行了实验研究。
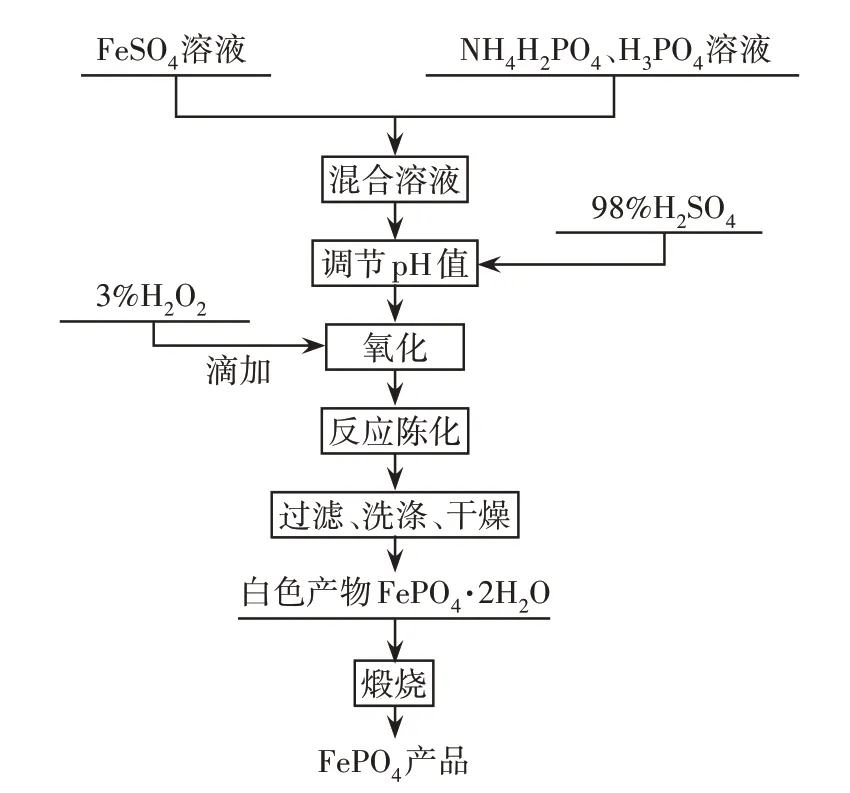
图1 一步法制备磷酸铁工艺流程图Fig.1 One-step process for the preparation of iron phosphate
2.4 分析方法
采用ICAP6300 对Fe、P、S、Si、Pb、Zn 等元素进行分析检测;采用捷克TESCANMIRALMS 型扫描电子显微镜和德国X射线衍射仪对产物的微观形貌和物相组成进行分析;采用LS13320 型激光粒度分析仪对不同实验条件下所得FePO4产品粉末的粒径分布进行测试;采用美国MicromeriticsASAP2460 型比表面积分析仪测定不同实验条件所得产品颗粒的比表面积。
3 结果与讨论
3.1 一步法制备磷酸铁条件优化
3.1.1 反应温度对制备磷酸铁的影响
一步法制备磷酸铁的过程中,改变反应温度为60、70、80、90 ℃,从而探索不同反应温度对制备磷酸铁产品的影响,结果见表1、表2。
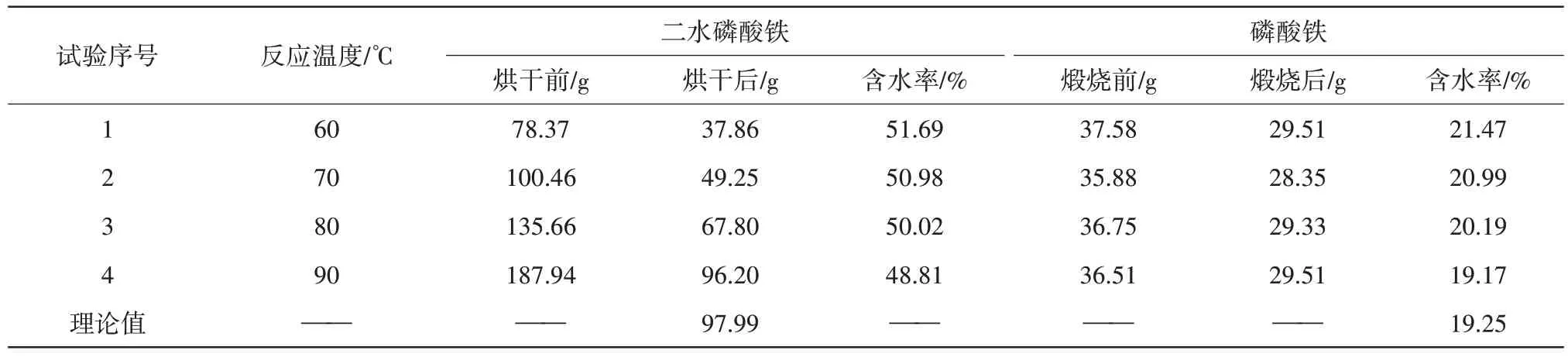
表1 不同反应温度下二水磷酸铁、磷酸铁产品脱水前后对比Tab.1 Comparison of iron phosphate dihydrate and iron phosphate products before and after dehydration under different reaction temperatures
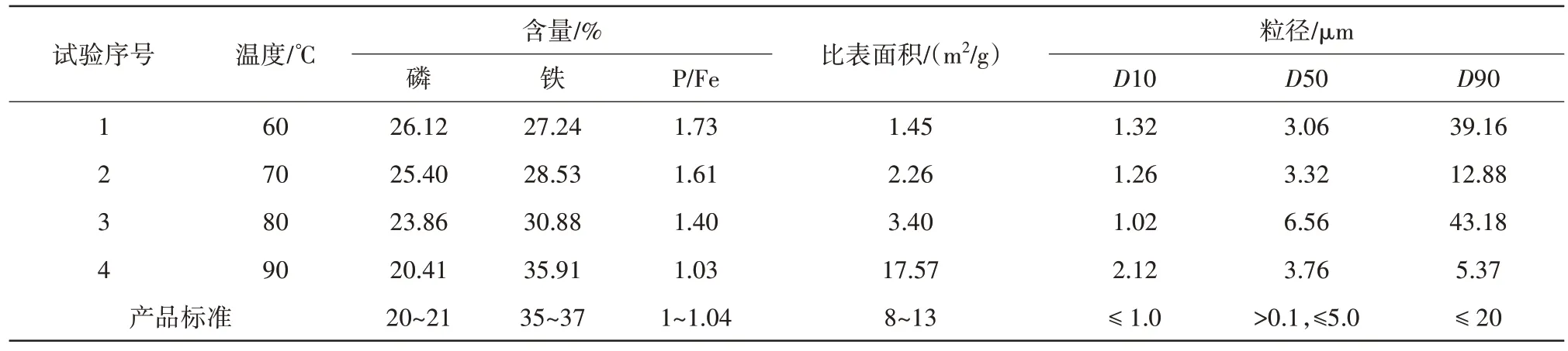
表2 反应温度对磷酸铁产品的影响Tab.2 Effect of reaction temperature on iron phosphate products
由表1 数据可知,随着反应温度由60 ℃升至90 ℃时,合成的二水磷酸铁质量也随之增加,80 ℃烘干后二水磷酸铁质量由37.86 g 增加至67.8 g,当反应温度低于90 ℃时,经烘干得到的二水磷酸铁质量都小于70 g,小于理论值(97.99 g),500 ℃下煅烧后的失水率均大于理论值19.25%,说明在上述温度的条件下反应并不充分,难以将反应物转化形成FePO4·2H2O,导致合成制得的二水磷酸铁质量较少。而当温度提升到90 ℃时,烘干得到的二水磷酸铁质量为96.20 g,接近理论值97.99 g,500 ℃下煅烧后得到的磷酸铁失水率为19.17%,接近理论值19.25%。实验表明,反应体系的温度升高会导致反应物分子更为活跃,这促进了Fe(OH)3向FePO4·2H2O的转化,从而制备出更多的二水磷酸铁产品。
由表2 数据可知,当体系反应温度由60 ℃升至90 ℃时,磷酸铁产品磷含量逐渐减少,由26.12%降低至20.41%;而铁含量相应增加,由27.24%增加至35.91%,表明反应温度明显影响了产品的元素组成。通过计算分析产品中磷与铁元素的占比可知,高的反应温度可以显著降低磷铁比,当温度低于90 ℃时,磷铁比均超出了产品磷铁比理论值范围,当温度为90 ℃时,磷铁比为1.03,在理论值范围内,这主要是由于随着温度的升高,磷离子溶解性增强,因而磷铁比下降。此外,通过对产品粒径及比表面积分析发现,随着反应温度升高,磷酸铁产品的中位粒径D50 呈现出逐渐增加趋势,这主要是因为高温提高了反应物料的反应速率,从而促进磷酸铁晶体的生长,增加了晶体的尺寸。除促进晶体生长外,温度还会扰动晶体成核,使得所产生的晶体尺寸趋于相近,因而产品的D90 粒径随温度升高呈现下降趋势,产品颗粒尺寸更加均一。通常而言,大粒径和高均匀性的颗粒比表面积较小,但制备的磷酸铁产品比表面积却随颗粒粒径的增加而变大。
图2 为产品SEM 形貌结果。从图中可以观察到,当反应温度为60 ℃时,磷酸铁样品较为致密,尽管表面粗糙,但孔隙率较低。随着反应温度提升,样品表面逐渐转变为大量约500 nm 直径的球形颗粒;当温度升至90 ℃时,球形颗粒分布更广且更加明显,颗粒间相互连接促使样品孔隙率提升,这也解释了磷酸铁产品比表面积随反应温度提升而增加的现象。

图2 不同反应温度制备磷酸铁的SEM图像Fig.2 SEM images of iron phosphate prepared at different reaction temperatures
综上所述,当反应温度控制在90 ℃时,制备的磷酸铁产品各项指标更加符合产品标准。
3.1.2 反应pH值对制备磷酸铁的影响
反应溶液的pH 值是合成磷酸铁的关键控制因素之一,其对溶液中元素含量以及最后的产率都有重要的影响。实验通过改变98%浓硫酸的加入量,控制pH 值为1.60、1.80、2.00、2.35,从而探索pH 值的不同对合成磷酸铁性能的影响,结果见表3、表4。
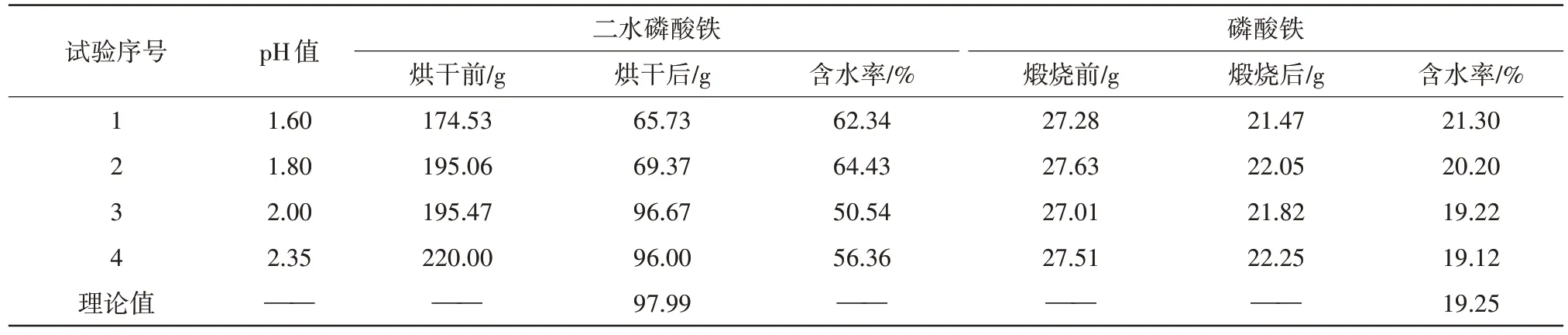
表3 不同pH值下二水磷酸铁、磷酸铁产品脱水前后对比Tab.3 Comparison of iron phosphate dihydrate and iron phosphate products before and after dehydration under different pH values
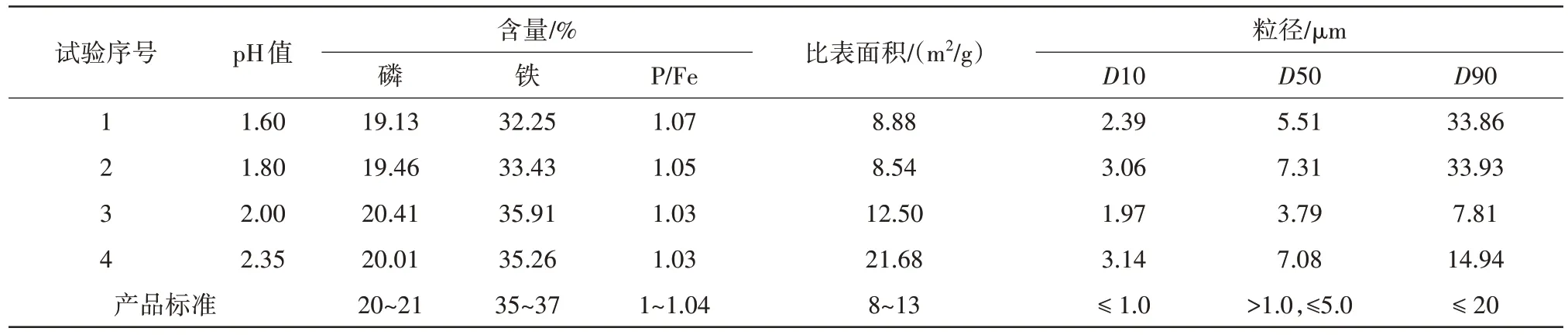
表4 pH值对磷酸铁产品的影响Tab.4 Effect of pH value on iron phosphate products
由表3数据可知,随着反应溶液pH 值由1.60提高到2.35,合成制得的二水磷酸铁质量也不断增加,当pH 值为1.60、1.80 时,80 ℃烘干后得到的二水磷酸铁质量分别为65.73、69.37 g,小于理论值97.99 g,500 ℃下煅烧得到的磷酸铁失水率均大于理论值19.25%;当pH 值为2.00 和2.35 时,80 ℃烘干后得到的二水磷酸铁质量分别为96.67、96.00 g,基本接近理论值97.99 g,500 ℃下煅烧得到的磷酸铁失水率均接近理论值19.25%。造成这一现象的原因可能是反应体系的pH 值低于2.00 时,二水磷酸铁溶解度较大,导致合成制得的二水磷酸铁质量较少,当反应体系的pH 值≥2.00 时,溶液中的二水磷酸铁能沉淀完全。
由表4 数据可知,当pH 值为1.60、1.80 时,磷酸铁产品中的磷含量分别为19.13%、19.46%,铁含量分别为32.25%、33.43%,均小于产品磷铁含量理论值范围;而磷铁比分别为1.07、1.05,均超出了产品磷铁比理论值范围。当pH 值为2.00、2.35 时,磷酸铁产品中的磷含量分别为20.41%、20.01%;铁含量分别为35.91%、35.26%;磷铁比都为1.03,均在产品标准范围内。但pH值为2.35时,磷酸铁产品的比表面积为21.68 m2/g,超出了产品比表面积标准的范围,且产品的平均粒径D50 为7.08 μm,大于产品D50粒径标准。而当pH 值为2.00时,磷酸铁产品的粒径大小、比表面积都符合磷酸铁产品标准。
由图3 SEM图像可看出,反应pH值条件影响了磷酸铁产品的微观形貌。pH 值为1.60 和1.80 时更偏向于球形形态,而pH 值为2.00 和2.35 时更偏向于松散的片状结构。

图3 不同pH值制备磷酸铁的SEM图像Fig.3 SEM images of iron phosphate prepared at different pH value
3.1.3 反应时间对制备磷酸铁的影响
实验在控制其他条件不变(反应pH 值为2.00,合成温度为90 ℃)情况下,通过改变体系的反应时间(分别为2、3、4、5.5、7 h),从而探索不同反应时间对合成磷酸铁性能的影响,实验结果见图4、图5、表5、表6。
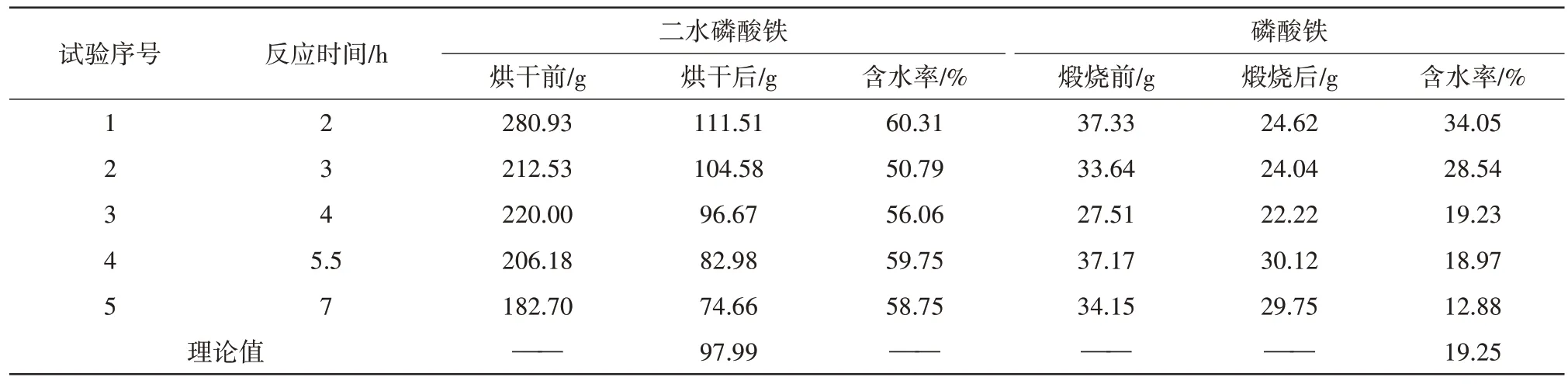
表5 不同反应时间下二水磷酸铁、磷酸铁产品脱水前后对比Tab.5 Comparison of iron phosphate dihydrate and iron phosphate products before and after dehydration under different reaction times
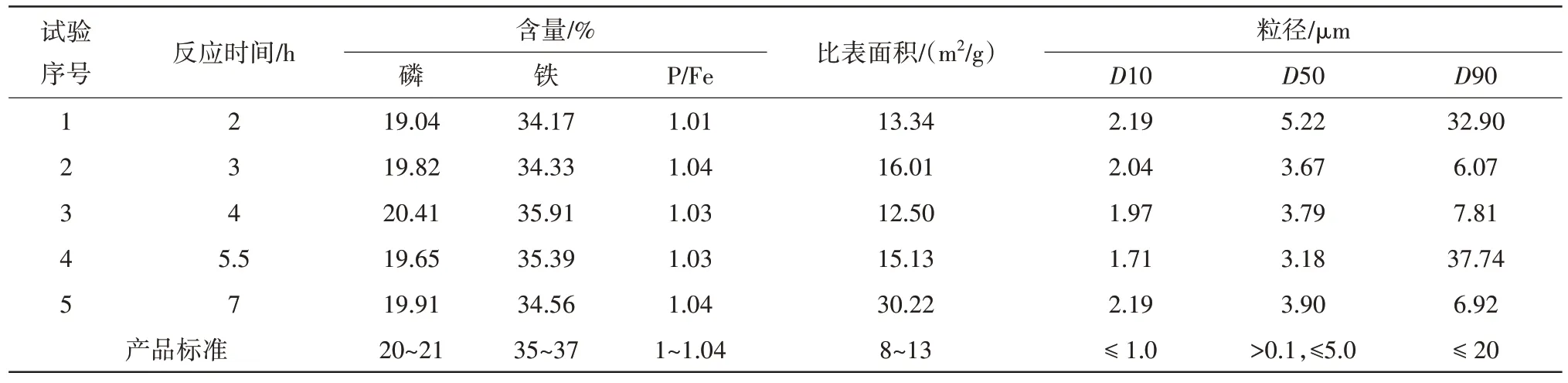
表6 反应时间对磷酸铁产品的影响Tab.6 Effect of reaction time on iron phosphate products

图4 不同反应时间溶液颜色的变化图Fig.4 The color change of the solution at different reaction times

图5 不同反应时间制备磷酸铁的SEM图像Fig.5 SEM images of iron phosphate prepared at different reaction times
由图4 可知,滴加双氧水后,体系呈淡黄色浊液。混合溶液反应2 h,三口烧瓶中呈淡黄色,反应出现淡黄白色沉淀;反应2.5 h后,转变为白色;反应达到4 h 后,混合溶液转变为粉白色,继续增加反应时间,混合溶液颜色保持不变。
由表5数据可知,随着反应时间增加,制得的二水磷酸铁质量呈现减少的趋势,当反应时间低于4 h时,80 ℃下烘干制得的二水磷酸铁质量分别为111.51、104.58 g,均大于理论值97.99 g,500 ℃煅烧后得到的磷酸铁失水率分别为34.05%、28.54%,均大于理论值19.25%;当反应时间为4 h时,80 ℃下烘干制得的二水磷酸铁质量为96.67 g,接近理论值97.99 g,500 ℃煅烧后得到的磷酸铁失水率为19.23%,接近理论值19.25%;当反应时间超过4 h后,80 ℃下烘干制得的二水磷酸铁质量分别为82.98、74.66 g,均小于理论值97.99 g,500 ℃煅烧后得到的磷酸铁失水率分别为18.97%、12.88%,均小于理论值19.25%。造成上述现象的原因可能是,反应初期生成的并非为二水磷酸铁,此时溶液中固体较多;反应在2.5 h时,体系中的固体开始转化为二水磷酸铁;反应4 h后转化完全,继续增加反应时间,溶液中的磷酸铁开始返溶,致使二水磷酸铁质量减少。
由表6 数据可知,当反应时间低于4 h 时,制得的磷酸铁产品中磷含量分别为19.04%、19.82%,铁含量分别为34.17%、34.33%,均小于产品磷铁含量的理论值;当反应时间为5.5 h 时,制得的磷酸铁产品的磷含量为19.65%,小于产品的理论值,铁含量为35.39%,磷铁比为1.03;当反应时间为7 h 时,磷酸铁产品中磷含量为19.91%,铁含量为34.56%,均小于产品的理论值,当反应时间为5.5、7 h时,制得的磷酸铁产品比表面积分别为15.13、30.22 m2/g,均超出了产品比表面积的标准范围,且反应时间为5.5 h时,磷酸铁产品的粒径D90为37.74 μm,远大于产品D90 粒径标准范围。当反应时间为4 h 时,制得的磷酸铁产品中磷含量为20.41%,铁含量为35.91%,磷 铁 比 为1.03,比 表 面 积 为12.50 m2/g,D50 为3.79 μm,D90 为7.81 μm,均符合产品标准,因此反应时间为4 h是最佳反应时间。
由图5可看出,反应时间对磷酸铁产品的微观形貌影响更加微观。反应时间为2 h 时,生成的磷酸铁产品为球形颗粒形态,进一步延长反应时间,球形颗粒便逐渐转变为片状团簇。在反应时间为3~4 h时,磷酸铁产品中可以观察到尺寸较大的片状结构,这可能是球形形貌向片状形貌转变的中间产物,而随着时间延长至5.5 h和7 h时,大尺寸片状结构难以观察。由此可知,随反应时间增加,磷酸铁形貌呈现球形向片状及小尺寸片状团簇转变的趋势。此外,片状团簇更加疏松,这一趋势与样品比表面积的测试结果相一致。
3.2 产品品质评测
通过上述实验研究,获得了以硫酸亚铁溶液和磷盐混合溶液制取磷酸铁的优化条件:温度90 ℃、pH 值2.00、反应时间为4 h。文章对在此条件下制备出的FePO4产品品质进行评测。图6 是实验在优化条件下制得的FePO4产品的XRD图谱。
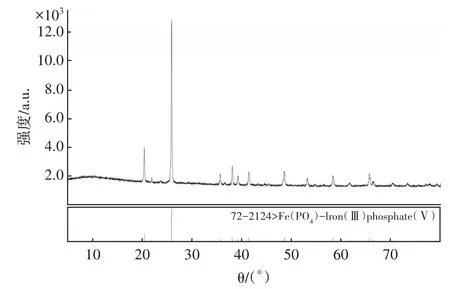
图6 制备的磷酸铁XRD图谱Fig.6 XRD pattern of prepared iron phosphate
由图6看出制备出的磷酸铁产品出现了明显的特征峰,且所有的特征峰位置和强度均与标准卡片的PDF#77-0094 相一致[10],表明所得的磷酸铁产品纯度较高,且无任何杂相。
4 结论
文章以七水硫酸亚铁和磷酸一铵为原料,探究优化了一步法制备磷酸铁工艺,通过条件实验,获得了以硫酸亚铁溶液和磷盐混合溶液合成的磷酸铁最优条件为:温度90 ℃、pH 值为2.00、反应时间为4 h。在最优条件下制备得到的磷酸铁磷含量为20.41%、铁含量35.91%、磷铁比1.03,比表面积12.50 m2/g、D50为3.79 μm、D90为7.81 μm,且产品纯度较高,无任何杂相,完全达到了电池级产品标准。

