前列腺癌组织中Wnt5a的表达与血管生成拟态的相关性
刘彼得,李循,王书恒,贾宏亮,张小安,李九智
0 引言
前列腺癌(prostate cancer, PCa)为男性泌尿生殖系统常见的恶性肿瘤,随着人口老龄化的加重,我国PCa发病率及死亡率呈上升态势[1]。血管生成拟态(vasculogenic mimicry, VM)是由肿瘤细胞围成的具有内皮性血管功能的管状结构,已在包括PCa在内的多种实体恶性肿瘤组织中被证实存在,并与肿瘤的恶性程度及不良预后相关[2]。VM的形成涉及肿瘤细胞可塑性及模拟内皮细胞的过程,这与肿瘤干细胞(cancer stem cells, CSCs)及上皮向间充质转化(epithelial-mesenchymal transition, EMT)密切相关[2-3]。Wnt5a是Wnt非经典信号通路配体,Wnt5a不仅参与调控CSCs特性和EMT进程,且有研究报道其能够促进卵巢癌、非小细胞肺癌及脉络膜黑色素瘤VM的形成,但Wnt5a对PCa的VM调控作用尚未被探究[4-7]。故本研究通过免疫组织化学法检测PCa组织中Wnt5a的表达及VM的形成情况,并收集PCa患者的临床病理资料,从人体组织水平初步探究Wnt5a与VM形成的相关性及临床意义。
1 资料与方法
1.1 资料
1.1.1 组织标本 收集新疆维吾尔自治区人民医院2019—2020年间行PCa根治术的患者组织标本50例,所有患者术前均未接受内分泌治疗、放疗、化疗及免疫治疗等,并以年龄及体重指数1:1匹配收集良性前列腺增生患者组织标本50例。标本经福尔马林固定、常规石蜡包埋,并经病理医师明确诊断。收集患者一般资料及临床病理资料。
1.1.2 主要试剂 Wnt5a抗体(1:200)和Vimentin抗体(1:500)购自英国Abcam公司,E-cadherin抗体(1:1 000)和CD133抗体(1:1 000)购自美国Proteintech公司,CD34抗体(1:200)、HRP-山羊抗兔二抗(1:5 000)和HRP-山羊抗小鼠二抗(1:5 000)购自北京中杉金桥生物技术公司。
1.2 方法
1.2.1 免疫组织化学染色 组织切片脱蜡、水化,采用高压修复法进行抗原修复,5%BSA封闭20 min后滴加一抗,室温孵育1 h后转入4℃恒温箱过夜,滴加二抗室温孵育1 h,DAB和苏木精显色后,梯度脱水封片,由两名医师在显微镜下共同评估蛋白表达情况。
1.2.2 CD34/PAS双染 按照上述步骤进行CD34染色后,0.5%PAS溶液37℃孵育10 min,苏木精对比染色后,梯度脱水封片。
1.2.3 免疫组织化学染色判读标准 每例标本取10个含有阳性细胞的高倍视野(×200)分别计数100个肿瘤细胞或增生腺体细胞,取其平均值计算阳性细胞百分率,0分:阳性细胞占0~5%;1分:阳性细胞占5%~25%;2分:阳性细胞占25%~50%;3分:阳性细胞>50%。染色强度:0分:无明显染色;1分:与基质相比有轻微染色;2分:易见的深黄色;3分:棕黄色。染色指数为阳性细胞百分率和染色强度之和,最终将染色结果分为两组:阴性和弱阳性为一组(0~2分),以低表达表示;中等阳性和强阳性为一组(3~6分),以高表达表示。
1.2.4 CD34/PAS双染判读标准 CD34染色位置为血管内皮细胞,定位在细胞膜,颜色呈棕黄色,PAS着色于基底膜,呈樱桃红色。内皮细胞性血管CD34和PAS均染色阳性;VM的CD34染色阴性,PAS染色阳性,且管道内可见红细胞。观察并计数整张切片上VM的数量,有则为阳性,无则为阴性。
1.3 统计学方法
用SPSS21.0软件进行统计学分析,采用χ2检验分析Wnt5a在两组间的表达差异,以及Wnt5a和VM的临床意义,Spearman相关性分析Wnt5a和VM的相关性及与CD133、Vimentin、E-cadherin表达的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 Wnt5a在PCa组织及良性前列腺增生组织中的表达情况
前列腺上皮细胞及间质细胞均表达Wnt5a,以上皮细胞表达为著。在PCa组织中Wnt5a的高表达率为72.0%,良性前列腺增生组织中高表达率为50.0%,两组比较差异有统计学意义(P=0.024),见图1、表1。

表1 Wnt5a蛋白在PCa组织及良性前列腺增生组织中的表达Table 1 Expression of Wnt5a protein in prostate cancer tissues and benign prostatic hyperplasia tissues
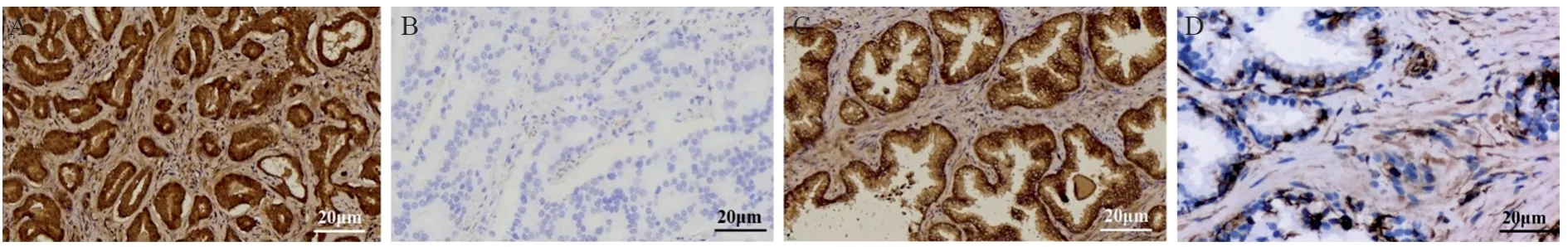
图1 Wnt5a在PCa组织及良性前列腺增生组织中的IHC染色结果 (×200)Figure 1 IHC staining results of Wnt5a in PCa and benign prostatic hyperplasia tissues (×200)
2.2 PCa组织中VM的形成情况及与Wnt5a表达的关系
CD34可将内皮细胞染色,PAS着色于血管样结构的基底膜,经CD34/PAS双染可见,在PCa组织中CD34染色阴性而PAS染色阳性的肿瘤细胞围成的管腔样结构为VM(图2A);而CD34和PAS均染色的管腔样结构为内皮细胞血管(图2B),前列腺癌组织中VM阳性率为38.0%(19/50)。前列腺癌组织中VM的形成与Wnt5a的表达具有正相关性(r=0.396,P=0.004),见表2。
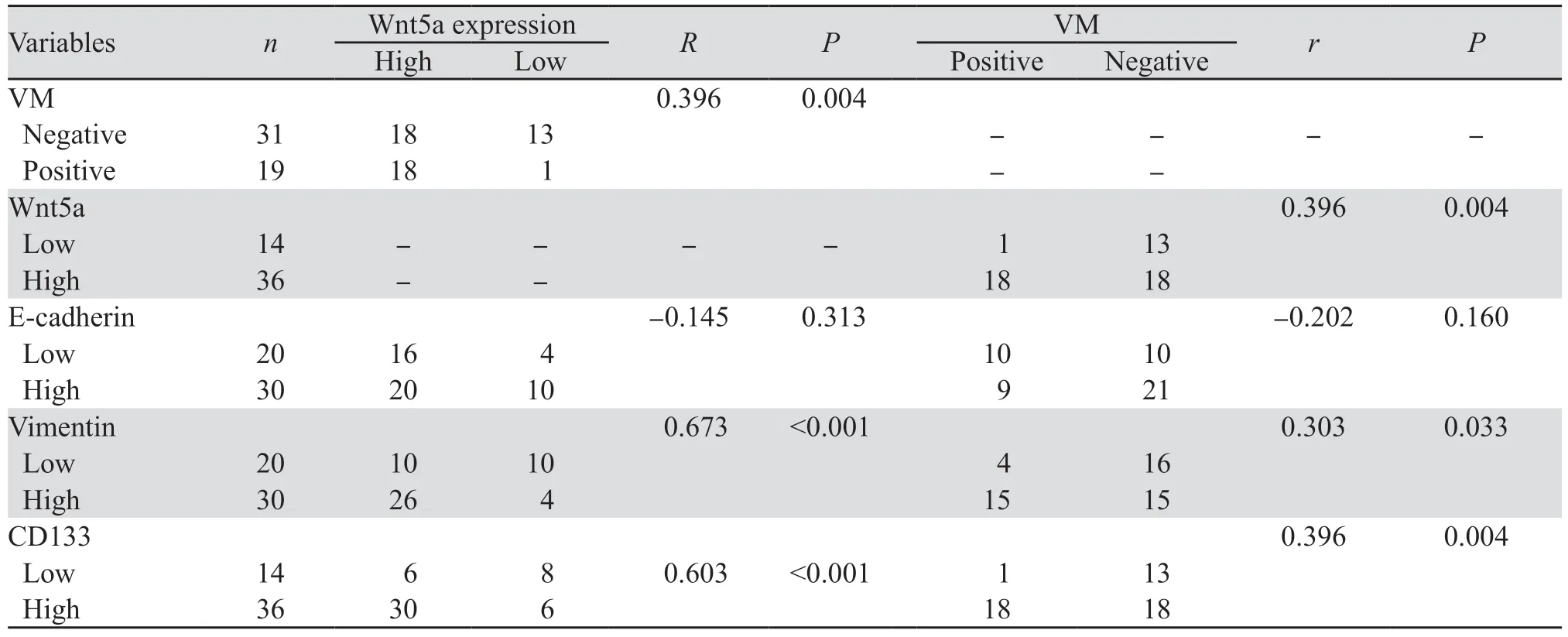
表2 PCa组织中Wnt5a、VM及CSCs/EMT标志蛋白表达的相关性Table 2 Correlation among Wnt5a expression, VM, and CSCs/EMT-related protein expression in prostate cancer tissues
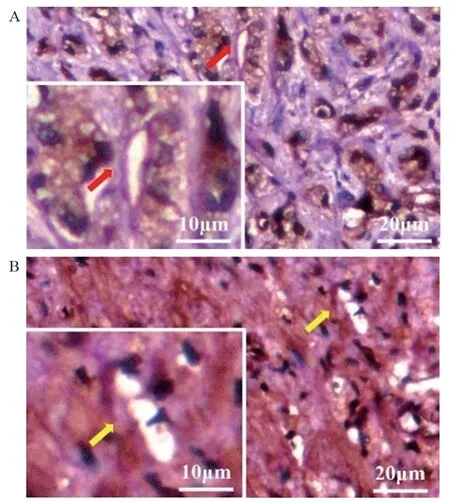
图2 VM在前列腺癌组织中的染色情况 (×200)Figure 2 Morphology of VM in prostate cancer tissues by CD34/PAS double staining (×200)
2.3 PCa组织中Wnt5a的表达及VM与CSCs/EMT标志蛋白表达的关系
E-cadherin为上皮特异性标志蛋白,Vimentin为间皮特异性标志蛋白,由图3及表2可见,PCa组织中Wnt5a的表达与Vimentin的表达呈显著正相关(r=0.673,P<0.001),而与E-cadherin的表达无显著相关性;且VM的存在同样与Vimentin的表达呈显著正相关(r=0.303,P=0.033),而与E-cadherin的表达无显著相关性。CD133为CSCs标志蛋白,其在前列腺癌组织中的表达与Wnt5a的表达(r=0.603,P<0.001)及VM(r=0.396,P=0.004)均呈显著正相关。
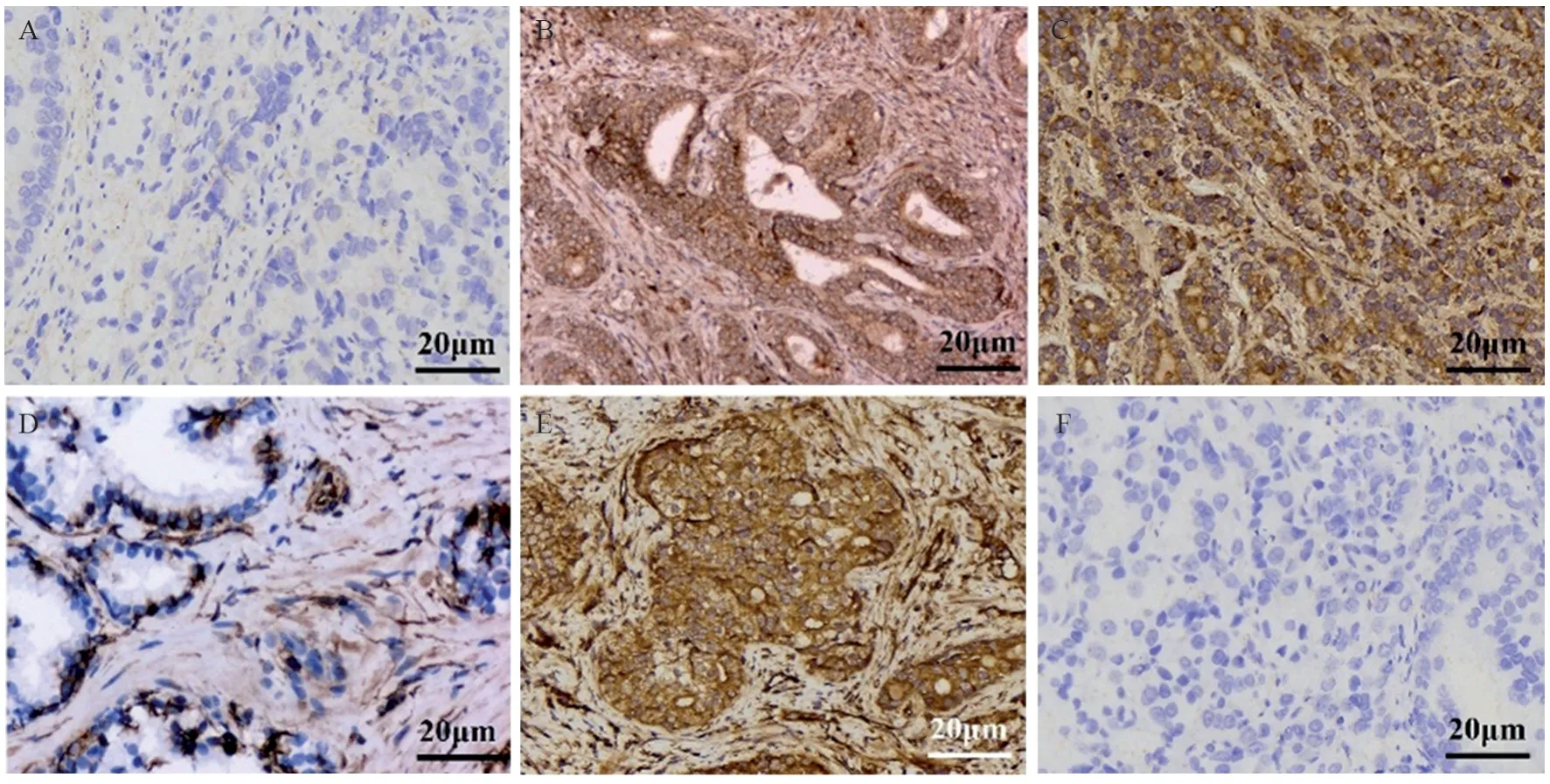
图3 免疫组织化学染色检测PCa组织中CSCs及EMT标志蛋白的表达情况 (×200)Figure 3 IHC staining results of CSCs/EMT-related proteins in prostate cancer tissues (×200)
2.4 PCa组织中Wnt5a的表达及VM与临床病理特征的关系
W n t 5a 蛋 白 的 表 达 与PCa的G lea so n 评 分(χ2=15.675,P<0.001)、输精管侵犯(χ2=4.049,P=0.044)及淋巴转移(χ2=1.049,P=0.044)均呈正相关。PCa组织中VM的形成同样与Gleason评分(χ2=12.738,P<0.001)、输精管侵犯(χ2=5.995,P=0.014)及淋巴转移(χ2=5.995,P=0.014)呈正相关,此外还与肿瘤T分期正相关(χ2=4.529,P=0.033),见表3。
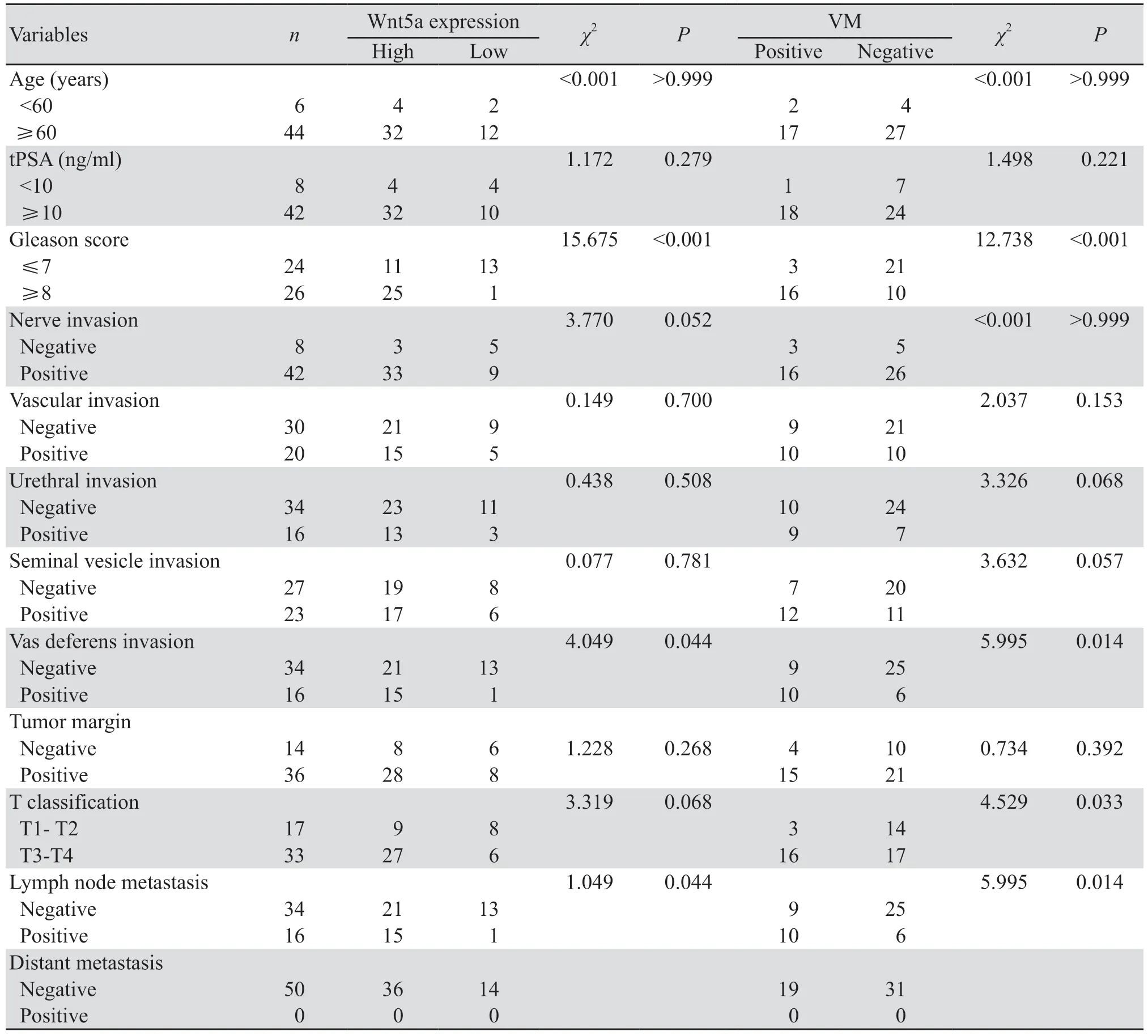
表3 PCa组织中Wnt5a的表达及VM与临床病理特征的关系Table 3 Relationship between Wnt5a expression, VM and clinicopathological factors of prostate cancer patients
3 讨论
血管作为维持肿瘤生长必需的营养通道,是肿瘤微环境的重要调节因素,靶向于肿瘤血管的治疗应为理想的抗癌方式,抗血管靶向药物已被证实对多种肿瘤显著有效。然而临床试验却发现,现有的抗血管靶向药物对PCa疗效甚微,尤其是对去势抵抗性PCa,其机制可能涉及肿瘤微环境缺氧及VM的激活[8]。既往研究表明肿瘤微环境与PCa的治疗耐受及进展密切相关,因此针对肿瘤微环境的研究可能是改善进展性PCa治疗现状的关键[9-10]。故本研究从VM的角度,在PCa组织水平初步探究Wnt5a与VM的相关性,同时分析其与CSCs和EMT的关系,为发掘新的PCa治疗靶点提供基础性依据。
本研究通过CD34/PAS双染对PCa组织进行VM检测,结果表明其与PCa的恶性程度、侵犯及转移呈正相关,提示VM可能为进展性PCa的潜在治疗靶点。靶向于VM的研究也证明,抑制VM的形成并与血管内皮细胞靶向药物或其他疗法进行组合,可能是治疗PCa(尤其是预后不良的PCa)的重要方向[2]。目前虽有研究表明一些有机化合物(如表没食子儿茶素没食子酸酯及山奈酚)能够抑制PCa的VM形成,但形成VM的机制尚未完全阐明,目前亦缺乏对PCa的VM形成机制的研究,这促使学者们对其展开探索[11-12]。
CSCs和EMT在VM的形成中起到重要作用[2-3,13]。已有研究证实,源自三阴性乳腺癌细胞的干细胞样细胞能够直接构成VM结构,然而目前尚无研究证实PCa的VM形成与CSCs及EMT的确切关系[14]。本研究从前列腺癌组织水平初步证明,CSCs标志因子CD133及间皮细胞特性标志因子Vimentin的表达与VM的形成具有明显正相关性,提示CSCs及EMT可能为促进PCa形成VM的因素。
CSCs、EMT 及VM受多种信号通路的调控,并存在交互、重叠,其中就包括Wnt信号通路[2,15-16]。研究表明Wnt信号通路与雄激素受体的交互作用在PCa的进展中起到重要作用,其中Wnt5a(Wnt非经典信号通路配体)对雄激素受体的抑制作用以及对PCa进展的促进作用较为显著[17-19]。进一步查阅文献发现Wnt5a能够促进卵巢癌、非小细胞肺癌及脉络膜黑色素瘤VM的形成,但Wnt5a对PCa的VM的调控作用及其机制尚未被探究[5-7]。本研究在PCa组织水平初步证实Wnt5a的表达不仅与VM的形成正相关,还与CD133及Vimentin的表达正相关。此外,通过对临床病理参数的分析发现,Wnt5a可能对PCa的进展起促进作用。由此可见,Wnt5a可能在PCa的发生和进展过程中扮演重要角色,并可能通过促进VM的形成参与PCa的进展,且其对PCa的CSCs及EMT可能存在调控作用。
综上所述,Wnt5a在PCa组织中的表达明显高于良性前列腺增生组织,且在PCa组织中Wnt5a的表达与VM的形成正相关;此外,二者的表达不仅与CSCs及EMT标志蛋白的表达具有正相关性,还与PCa的恶性程度、侵犯及转移正相关。以上结果提示Wnt5a具有作为评估PCa恶性程度及预后新指标的潜力,并有助于开拓PCa靶向治疗的新思路。
利益冲突声明:
所有作者均声明不存在利益冲突。

