NCA处理对鲜切苹果贮藏品质的影响
杨尚山,杨 悦,尚鹏鹏,朱树华,*,张丽丽,*
(1.山东农业大学化学与材料科学学院,山东 泰安 271018;2.农业农村部农膜应用重点实验室,山东 泰安 271018)
苹果富含多种人体必需矿物质元素,如钾、锌、铜和碘[1]。鲜切苹果具有清洁、天然、营养、方便等优点,已成为常见且受广大消费者欢迎的即食生鲜食品[2],具有广阔的消费前景[3]。然而,贮藏过程中发生的褐变和失水萎蔫等一系列问题限制了鲜切苹果的应用[4-5]。因此,科研人员一直在寻找安全和有效的方法来提高鲜切苹果的贮藏品质。
现有的鲜切苹果保鲜方法多为薄膜保鲜,这是一种具有商业价值的实用保鲜方法[6-8]。可食性膜与抗褐变抑制剂联合处理后,苹果的呼吸速率和微生物繁殖率显著降低,护色效果良好[9]。使用蜂胶提取物涂膜后,果蔬的硬度和表观品质有所提高[10]。Thivya 等[11]开发了一种含有葱废料提取物的海藻酸钠/羧甲基纤维素膜,该膜可有效控制鲜切苹果和马铃薯的褐变。然而,涂膜材料的毒性、不稳定性、可持续性以及保鲜效果是鲜切果蔬涂膜保鲜中面临的问题。除涂膜保鲜外,物理保鲜和化学保鲜方法也常应用于鲜切水果保鲜,如基于姜黄素的光动力处理鲜切哈密瓜[12]、低分子量岩藻依聚糖处理鲜切苹果[13]、马茶提取物处理鲜切苹果[14]等。
1-亚硝基环己基乙酸酯(NCA)是一种可以提供硝酰基(HNO)的酰基亚硝基化合物[15]。HNO 是一氧化氮(NO)的单电子还原和质子化同源物,已被证明在制药领域具有独特的药理作用,如治疗心力衰竭[16]。HNO 能与金属蛋白、硫醇和含硫醇的蛋白质等多种物质直接反应,从而改变酶的活性,如对蛋白中特定半胱氨酸残基的修饰能抑制线粒体的呼吸[17]。此外,HNO 是NO 和硫化氢(H2S)相互作用产生的反应中间体,而NO 和H2S 作为信号分子参与植物的多种生理过程,并在果实采后贮藏中发挥重要作用,因此可以推断HNO 对植物的生理过程有一定调节作用[18]。然而,关于HNO 在植物中生理作用的研究较少。最近的研究发现,在模式植物拟南芥的活细胞中能检测到内源性HNO的形成,并且HNO对植物的乙烯信号通路具有一定的调节作用,且氧化还原环境的改变可引发HNO 衰变及·NO/HNO 相互转化[19]。前期研究发现,适当浓度的HNO 供体处理能有效抑制西红柿多酚氧化酶和过氧化物酶的活性,减缓西红柿亮度值和VC含量的下降,抑制果实中丙二醛含量和失重率的上升,从而延缓西红柿的衰老[20]。基于此,本研究以NCA 为HNO 供体,探究HNO 对鲜切苹果贮藏品质的影响,以期为鲜切果蔬的保鲜提供一种新思路。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
‘红富士’苹果:购自山东省泰安市水果批发市场,选择无病虫害、色泽鲜艳、无机械伤痕、大小均匀、成熟度相近的新鲜、良好的苹果,立即运回实验室5 ℃保存。
NCA,本实验室自制;磷酸氢二钠(分析纯)、磷酸二氢钠(分析纯)、浓硫酸(98.3%)、浓氨水(23%)、过氧化氢(分析纯)和乙二胺四乙酸(EDTA,分析纯),天津市凯通化学试剂公司;邻苯二酚(99.5%)和2-脱氧核糖(分析纯),上海麦克林生化科技公司;甲硫氨酸(≥99.0%),北京全式金生物技术有限公司;氮蓝四唑(≥98.0%),苏州亚科科技股份有限公司;核黄素(98%),上海如吉生物科技发展公司;冰乙酸、联苯胺、硫代巴比妥酸(TBA)、邻苯二酚、丙酮,均为分析纯,上海源叶生物科技有限公司;次氯酸钠(NaClO,分析纯),成都华融化工有限公司;2,7-二氯荧光素(分析纯),广东元泰化工有限公司;2-脱氧-D-核糖(98%),南京杜莱生物技术有限公司。
1.1.2 仪器与设备
D3024R 型高速冷冻离心机,武汉华科达实验设备有限公司;UV-2700型紫外可见分光光度计,日本岛津公司;WY015R型手持折光仪,北京中西泰安技术服务有限公司;CR-10型色差计,美国柯尼卡美能达公司;GY-4型果实硬度计,青岛拓科仪器有限公司;食品级拉链袋(材质为聚乙烯,长度为70 mm,宽度为50 mm,厚度为70µm),桐城市天之锦包装有限公司。
1.2 方法
1.2.1 处理方法
试验前,所需仪器均使用0.02% NaClO 溶液浸泡30 min以消毒灭菌,取出仪器,晾干。用去离子水洗净5 ℃下预冷的苹果,之后使用0.02%NaClO 浸泡3 min消毒。将苹果表面的水分晾干,切成2~3 cm见方的苹果块,分别在5、10、15µmol/L NCA 溶液中浸泡5 min(以去离子水浸泡5 min 为对照(CK)),取出苹果块,用无菌纱布将苹果块表面的溶液吸干。将处理后的苹果块分组标记,放入食品级拉链袋(每袋140 g)中并置于冰箱中5 ℃冷藏。每48 h 取1 次样品,分组包装并在-80 ℃下冻藏。每次测试前,将每组冻藏样品取出,加入液氮研磨,取1 g 粉末加入试管,用于测样。
1.2.2 测定项目与方法
1.2.2.1 色差
使用色差计测定。测量前,采用标准白度进行校准测量(L*0=97.06,a*0=0.04,b*0=2.01)。随机选取3个自封袋,每个自封袋中随机选取3 块苹果,分别记录L*(亮度)、a*(红绿度)、b*(黄蓝度)值。色差用ΔE表示,其计算公式如下:
1.2.2.2 可溶性固形物含量(SSC)
使用手持式折光计测定[21]。
1.2.2.3 硬度
使用硬度计测定,探头直径为11 mm,结果取其平均值。硬度单位为N/cm2。
1.2.2.4 超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性
在3 mL 50 mmol/L 磷酸盐缓冲液(pH 7.0)中加入1 g样品粉末,提取10 min,在12 000×g条件下离心20 min,得到粗酶液。制备含13 mmol/L 蛋氨酸、63µmol/L 氮蓝四唑、1.3µmol/L 核黄素和10 mmol/L EDTA的50 mmol/L磷酸盐缓冲液作为反应溶液。取反应液1.5 mL,暗处加酶液10µL,5 ℃阳光下照射约15 min。当颜色发生变化后,立即停止光照,测定560 nm 处的吸光度。以不加酶溶液作为空白对照,以单位时间内抑制氮蓝四唑光还原率50%为1 个酶活力单位(U)[22],超氧化物歧化酶活性单位为U/mg。
3 mL 磷酸盐缓冲液(pH 7.0)中加入1 g 样品粉末,在12 000×g下离心20 min,得到粗酶液。吸取0.1 mL 酶液,加入2 mL 50 mmol/L 磷酸盐缓冲液和0.2 mL 0.3%H2O2,立即测定溶液在240 nm 处的吸光度值。其中一根装有2 mL 磷酸盐缓冲液、0.1 mL 去离子水和0.2 mL H2O2的管作为对照管,测定OD240nm以指示酶活性的变化[23]。以每秒内改变0.1个单位的吸光度定义为1 个酶活性单位(U),过氧化氢酶活性单位为U/mg。
1.2.2.5 多酚氧化酶(PPO)和过氧化物酶(POD)活性
在3 mL 磷酸盐缓冲液(pH 7.0)中加入1 g 样品粉末,再于12 000×g条件下离心20 min,得到粗酶液。将0.1 mol/L 儿茶酚和50 mmol/L 磷酸钠缓冲液(pH 6.8)-0.2 mmol/L EDTA 在30 ℃下预热30 min。在1 mL粗酶溶液中加入1 mL儿茶酚和1.5 mL 50 mmol/L磷酸钠缓冲液(pH 6.8)-0.2 mmol/L EDTA,立即测定420 nm 处的吸光度[24]。以每分钟吸光度变化0.01 为1 个酶活力单位(U),多酚氧化酶活性单位为U/mg。
在3 mL 0.4 mol/L NaCl 中加入1 g 样品粉末,浸提10 min,12 000×g下离心15 min,得到粗酶液。在3 mL联苯胺乙酸-乙酸钠溶液中加入0.1 mL酶溶液,30 ℃水浴5 min。加入0.5 mL 0.3%H2O2,测定580 nm处吸光度的变化。以每秒内吸光度变化0.001 个单位定义为1个酶活性单位(U)[25]。过氧化物酶活性单位为U/mg。
1.2.2.6 活性氧(ROS)和羟基自由基(·OH)含量
在3 mL 10 mmol/L Tris-HCl缓冲液(pH 7.2)中加入1 g样品粉末,12 000×g离心20 min,得到粗酶液。取0.2 mL 粗酶液加入1.8 mL Tris-HCl 缓冲液中,加入10µL 2.0 mmol/L 2,7-二氯荧光素,静置30 min,以Tris-HCl缓冲液调零,检测荧光强度。最大激发波长为485 nm,最大发射波长为530 nm,狭缝为5 nm[26]。活性氧含量单位为a.u/mg。
在2 mL 50 mol/L 磷酸盐缓冲液(pH 7.0)中加入1 g 样品粉末,10 000×g离心10 min。取0.5 mL 上清,加入0.5 mL 50 mol/L 磷酸盐缓冲液(pH 7.0)和1 mL 含2.5 mol/L 2-脱氧-D-核糖的25 mol/L 磷酸盐缓冲液(pH 7.0),35 ℃暗处反应1 h。加入1 mL 1%三丁基锡化合物和1 mL 醋酸,黑暗中煮沸30 min 后立即冰水中冷却10 min,于532 nm 处测定吸光度。羟基自由基含量单位为mmol/g。
1.2.3 数据处理
每组试验重复3 次,结果以x±s表示。使用Origin 2019软件进行数据整理和制图。
2 结果与分析
2.1 不同浓度NCA处理对鲜切苹果色差的影响
鲜切水果和蔬菜因其方便、营养、无污染和外观新鲜而受到消费者的欢迎[27],但苹果在鲜切加工后切面容易受损。L*值和色差是鲜切苹果保鲜过程中重要的理化参数,是反映果肉在贮藏过程中亮度和褐变程度的重要指标。由图1A 可见,随贮藏时间的延长,各组鲜切苹果L*值呈降低后升高再降低的变化趋势。NCA 处理鲜切苹果的亮度整体高于对照,贮藏第8 天,对照L*值为53.97,5、10、15µmol/L NCA 处理组分别为56.03、57.50、58.07,分别是对照的1.03、1.06、1.07 倍。由图1B 可见,鲜切苹果的色差值随贮藏时间的延长整体增大,且与对照相比,NCA处理组保持较低的色差值。第8 天时,对照色差值为6.55,而5、10、15 µmol/L NCA 处理的苹果色差值分别为4.05、2.87、2.90,分 别 为对 照的61.83%、43.82%、44.27%。ΔE值越大,说明苹果表面颜色越深,新鲜度越低。可见,NCA 处理可有效延缓鲜切苹果色差值的增大,保鲜效果较好。其中,10、15µmol/L NCA处理2 d后,果实ΔE值变化较小,说明NCA处理能延缓鲜切苹果褐变。综上所述,NCA 处理能有效延缓鲜切苹果的褐变,保持较好的外观品质。

图1 不同浓度NCA处理对鲜切苹果L*值(A)和ΔE值(B)的影响Fig.1 Effects of different concentrations of NCA treatment on L*(A)and ΔE(B)of fresh-cut apples
2.2 不同浓度NCA处理对鲜切苹果可溶性固形物含量的影响
可溶性固形物含量是影响水果口感的重要因素之一。由图2可见,5µmol/L NCA处理果实的SSC与对照呈相同变化趋势,但其SSC 始终高于对照,第2天和第4天有一定差异,6 d后相差不明显。10µmol/L NCA 处理维持果实SSC 效果较好,处理4~10 d,SSC无显著变化。15µmol/L NCA 处理4 d 内对果实SSC维持效果不明显,后期呈先增后减再增的波动变化。总体来看,NCA 处理对果实中SSC 的维持有积极作用,且NCA 处理浓度对鲜切苹果可溶性固形物含量有较大影响,其中10µmol/L处理的效果最好。

图2 不同浓度NCA处理对鲜切苹果可溶性固形物含量的影响Fig.2 Effects of different concentrations of NCA treatment on soluble solids content in fresh-cut apples
2.3 不同浓度NCA处理对鲜切苹果硬度的影响
果实硬度是影响鲜切苹果脆感的重要因素之一,也是反映其贮藏品质最直观的指标之一[28]。果实中的组织软化是由细胞壁成分的酶解、水分流失、渗透变化以及其他与组织相关的复杂机制引发的[29]。由图3可以看出,鲜切苹果的硬度随贮藏时间的延长而降低。对照初始硬度为56.97 N/cm2,第10 天时降至38.95 N/cm2,下降了31.63%。贮藏第10 天,5、10、15 µmol/L NCA 处理组的果实硬度分别为44.53、45.26、46.31 N/cm2,均显著高于对照(P<0.05),其中以15µmol/L NCA处理的果实硬度下降最缓慢,保持了较好的效果。说明NCA处理可以减缓鲜切苹果硬度的降低,抑制果实软化。

图3 不同浓度NCA处理对鲜切苹果硬度的影响Fig.3 Effects of different concentrations of NCA treatment on hardness of fresh-cut apples
2.4 不同浓度NCA 处理对鲜切苹果SOD 和CAT 活性的影响
抗氧化酶参与植物清除活性氧的过程,被认为是保护生物体免受有害物质负面影响的有效防御屏障,其中超氧化物歧化酶和过氧化氢酶是两种主要的酶促抗氧化剂[30]。由图4A 可见,不同浓度NCA 处理鲜切苹果的SOD 活性总体呈下降趋势,对照组SOD 活性随着贮藏时间的延长持续降低。5µmol/L NCA 处理组SOD 活性在第2 天达到峰值,是对照的1.3倍。10µmol/L和15µmol/L NCA处理组SOD活性在8 d 内保持较高水平,第8 天时果实的SOD 活性分别是对照的1.6 倍和2.0 倍。由图4B 可以看出,不同浓度NCA 处理后,鲜切苹果的CAT 活性整体呈下降趋势,除5µmol/L NCA 处理第4 天外,其余均高于对照。不同浓度NCA处理4 d后,CAT活性整体呈缓慢下降,第10天时,5、10、15µmol/L NCA处理组CAT活性分别为20、29、30 U/mg,分别为对照的1.43、2.07、2.14倍。CAT是一种能从苹果中去除过氧化氢的酶。当过氧化氢含量减少时,苹果的老化变质过程就会被延缓。因此,高活性的CAT 有利于鲜切苹果的贮藏。综上所述,NCA 处理有利于减缓鲜切苹果SOD和CAT 活性的下降,且以NCA 浓度为10 µmol/L 和15µmol/L时效果较好。
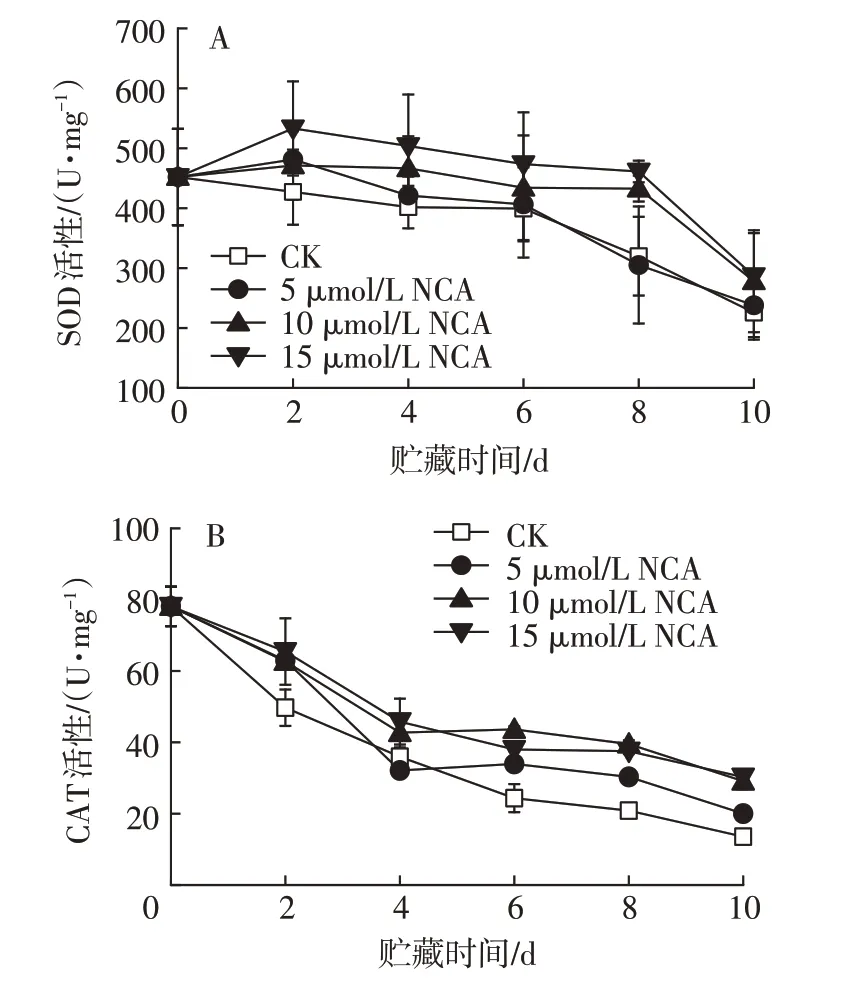
图4 不同浓度NCA处理对鲜切苹果SOD(A)和CAT(B)活性的影响Fig.4 Effects of different concentrations of NCA treatment on activities of SOD(A)and CAT(B)in fresh-cut apples
2.5 不同浓度NCA 处理对鲜切苹果PPO 和POD 活性的影响
研究证实,鲜切果蔬食品褐变的主要原因是酶促褐变,而参与酶促褐变的关键酶是多酚氧化酶和过氧化物酶[31-32],鲜切果蔬的褐变敏感性是褐变相关酶和酚类化合物之间发生复杂的相互作用的结果[33-34]。在氧气存在下,多酚氧化酶会催化单酚羟基化为邻二酚(甲酚酶活性),邻二酚氧化为邻醌(儿茶酚酶活性)[35],邻醌既能相互作用形成高分子聚合物,也能与氨基酸或蛋白质作用生成高分子络合物,从而生成棕色、红色或黑色物质。一般来说,PPO 活性的增强会导致苹果软化,不利于鲜切苹果的保存和贮藏,甚至会导致鲜切苹果变质。由图5A 可见,在5 ℃贮藏条件下,鲜切苹果的PPO 活性先升高后降低,均在第2天达到峰值。各浓度NCA处理组PPO活性均低于对照,且15µmol/L NCA处理组PPO活性最低,处理效果最佳。
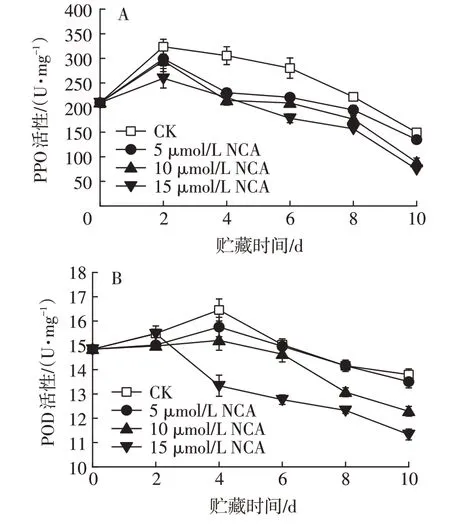
图5 不同浓度NCA处理对鲜切苹果PPO(A)和POD(B)活性的影响Fig.5 Effects of different concentrations of NCA treatment on activities of PPO(A)and POD(B)in fresh-cut apples
过氧化物酶(POD)是一种广泛存在于生物体内的酶类,具有氧化还原作用。许多研究表明POD 与褐变有关[36]。尽管POD 受到超氧自由基、过氧化氢、脂质过氧化等电子受体化合物可用性的限制,但它可以将组织中的一些碳水化合物转化为木质素,提高木质化程度。因此,POD可以作为组织老化的生理指标。由图5B可见,在贮藏期间,鲜切苹果的POD活性先升高后降低。不同浓度NCA处理组POD活性均低于对照,贮藏第4天,对照组POD活性为16.45 U/mg,而5、10、15 µmol/L NCA 处理组分别为15.75、15.20、13.34 U/mg,分别比对照降低4.26%、7.50%和18.91%。10µmol/L NCA 处理组贮藏第4 天POD 活性出现峰值,且较其他处理组的峰值低。15µmol/L NCA 处理组贮藏第2 天出现POD 活性峰值,贮藏2~10 d,POD 活性下降趋势明显。一般来说,POD 是一种氧化还原酶,会催化苹果的氧化,诱发一系列氧化反应,导致苹果老化。因此,POD活性过高不利于鲜切苹果的贮藏。比较发现,10 µmol/L 和15 µmol/L NCA处理可显著降低鲜切苹果POD活性。
2.6 不同浓度NCA处理对鲜切苹果活性氧和羟基自由基含量的影响
苹果细胞中的活性氧包括超氧阴离子、过氧化物和羟基,其可诱导膜脂氧化和细胞凋亡,是苹果变质的重要影响因素[37]。如果ROS含量超过阈值,则会直接触发或加剧膜脂过氧化,破坏细胞微环境和正常代谢。由图6A可见,贮藏过程中,鲜切苹果的ROS含量呈上升趋势,且不同浓度NCA处理组活性氧含量低于对照。贮藏6~10 d,对照鲜切苹果ROS含量的增加趋势显著高于NCA处理组,且15µmol/L NCA处理组增长趋势最慢,延缓鲜切苹果ROS含量升高的效果最好。

图6 不同浓度NCA处理对鲜切苹果ROS(A)和·OH(B)含量的影响Fig.6 Effects of different concentrations of NCA treatment on contents of ROS(A)and·OH(B)in fresh-cut apples
脂质过氧化是植物组织膜降解的主要机制,并导致许多副产物,如羟基自由基的形成。羟基自由基是一种活性氧,它可以破坏细胞中的大分子,如脂质、蛋白质或脱氧核糖核酸[38]。羟基自由基具有很强的氧化能力,会加速苹果的衰老、萎蔫等生理过程。因此,为了延长苹果的保存时间,应该降低苹果中羟基自由基的含量[39]。由图6B可见,随着贮藏时间的延长,鲜切苹果的羟基自由基含量整体呈先降低后升高的趋势。对照组羟基自由基含量在第6天达到最低水平,随后急剧上升,之后尽管有下降,但仍保持在较高水平。10 µmol/L 和15 µmol/L NCA 处理组变化趋势相同,0~4 d,羟基自由基含量急剧下降,6~10 d,羟基自由基含量增加。除第6天外,15µmol/L NCA处理组羟基自由基含量明显低于对照。可见,NCA处理可以减缓鲜切苹果活性氧含量的增加,延缓细胞壁的水解,从而提高鲜切苹果的硬度,保持较好的品质和外观。
3 结论
上述试验结果表明:不同浓度的NCA 处理可有效减缓鲜切苹果亮度、可溶性固形物含量和硬度的下降,保持色泽的稳定,较好地保持了鲜切苹果的外观和风味,抑制了PPO和POD活性的增加,减缓了鲜切苹果的褐变,提高了SOD 和CAT 活性,降低了活性氧和羟基自由基的含量,减轻了活性氧对鲜切苹果的伤害。推测可能是由于NCA 产生的HNO 能有效抑制鲜切苹果褐变,保持良好的贮藏品质,其中15µmol/L NCA处理效果最佳。

