浓香型白酒在新、老窖池发酵过程中酒醅微生物群落结构差异分析
邱显平,黄 桥,杨 静,田 蕾,刘 英,林宜锦,关统伟*
(1.四川全兴酒业有限公司,四川 成都 611637;2.西华大学 食品与生物工程学院,四川 成都 610039;3.食品微生物四川省重点实验室,四川 成都 610039)
中国白酒历史悠久,内涵丰富,是传统文化的代表符号之一。由于生产原料、工艺以及地理环境的差异,中国白酒经过长期的发展和演变形成了以三大香型(浓香、酱香和清香)为主导的产业格局。其中,浓香型白酒以其芳香浓郁、绵柔甘冽、余味悠长的风格和口感深受消费者的青睐,独占市场鳌头[1-2]。
浓香型白酒是以粮谷为原料,采用浓香大曲为糖化发酵剂,经泥窖固态发酵、固态蒸馏、陈酿、勾调而成[3]。其风味物质主要来自酒曲、原料及微生物发酵过程,其中微生物发酵是白酒风味的主要来源[4]。如乳酸菌产生大量有机酸,芽孢杆菌(Bacillussp.)产生特殊的风味成分,酿酒酵母(Saccharomyces)发酵产生酒精,而非酿酒酵母则负责代谢如酯类、酸类、高级醇类、醛类和萜烯类化合物[5-6]。因此,明确白酒发酵过程中相关微生物作用及其与特征风味的关系对其品质提升具有重要意义。而窖池是浓香型白酒发酵微生物主要来源之一,其四壁覆盖的窖泥中拥有丰富的微生物资源,特别是细菌和古菌[7]。这些微生物经过窖内低氧、低pH、高乙醇等极端环境的长期筛选,形成有益于浓香型白酒生香的群落结构,与白酒品质密切相关[8-9]。在无氧发酵过程中,窖泥和酒醅中的微生物借助固、液、气三相系统相互扩散和迁徙,该过程调控着窖池内部的物质转化和能量代谢,最终决定了发酵的进程和结果[10-11]。
一般认为,窖池越老,酒质越好[12]。有研究发现,与新窖泥相比,老窖泥中更丰富的菌属组成形成了完整的窖泥菌群代谢网络[13]。老窖泥中更加丰富的瘤胃菌科(Ruminococcaceae)和梭菌属(Clostridium)[14],可以降解乳酸生成己酸、丁酸和乙酸等;沉积物棒菌属(Sedimentibacter)和氨基酸杆状菌属(Aminobacterium)[15]可以降解氨基酸生成乙酸和丁酸等;互养单胞菌属(Syntrophomonas)[16]可以降解中链的脂肪酸形成乙酸和丙酸等。老窖泥中各类微生物相互作用,形成完整的窖泥菌群代谢链,其丰富的微生物群落也使得其生产的浓香型白酒风味更佳,品质更好。目前,对于窖池的探索更多的集中在不同窖龄或不同空间位置窖泥中微生物群落结构的演替与区别[17-18],以及窖泥中微生物群落与理化指标的相关性研究[19],对于新、老窖池中发酵酒醅微生物群落演替规律差异性研究较少。本研究采用高通量测序技术解析成都市某酒厂浓香型白酒酒醅在新、老窖池发酵过程中的微生物群落动态演替特征以及多样性组成,以期为浓香型白酒发酵过程微生态研究提供更多的有益信息,同时也为认识不同窖龄对浓香型酒醅微生物群落的具体影响提供数据参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醅样品:成都某酒业有限公司,发酵周期为95 d。
1.1.2 试剂
Power SoilR脱氧核糖核酸(deoxyribonucleic acid,DNA)分离试剂盒:美国MO Bio Laboratories公司;聚合酶链式反应(polymerase chain reaction,PCR)纯化试剂盒:日本TaKaRa公司;Illumina TruSeq DNA样品制备LT试剂盒:美国Life公司。
1.2 仪器与设备
Pico-21台式离心机:美国Thermo Fisher公司;GL-88B旋涡混合器:海门市其林贝尔仪器制造有限公司;3614 ZONKIA USTC Zonkia低速离心机:安徽科学仪器有限公司;TND03-H-H均匀型干式恒湿器:深圳拓能达科技有限公司;DYCZ-21电泳槽:北京市六一仪器厂;Qubit2.0荧光仪:新加坡Invitrogen公司。
1.3 方法
1.3.1 样品采集方法
从新(S组)、老窖池(T组)中采集浓香型白酒酒醅样品,新、老窖池分别经过了6年和30年的连续使用。为了满足生物学重复,每组样本由随机选择的3个平行窖池组成。依据发酵温度的变化过程,分别在发酵第0、7、15、25、45、70和95天收集酒醅样本,每个窖池样本由6个子样本(每个子样本200 g)均匀混合而成(图1)。新窖池样品编号为S0、S7、S15、S25、S45、S70、S95,老窖池样品编号为T0、T7、T15、T25、T45、T70、T95。酒醅样本的采集和运输过程遵循无菌原则,样本保存在-80 ℃保存条件下备用。
图1 酒醅样品采样示意图Fig.1 Sampling diagram of fermented grains
1.3.2 DNA提取、PCR扩增与Illumina Miseq高通量测序
称取酒醅样品6 g,根据Power SoilRDNA分离试剂盒的操作说明提取基因组DNA,以其为模板,采用包含barcode的引物对338F/806R和ITS1F/ITS2R[20]分别PCR扩增细菌16S DNA V3-V4和真菌ITS1的高变区基因序列,PCR扩增条件及体系参考TAN Y W等[21]的方法。PCR扩增产物用PCR纯化试剂盒进行纯化,并根据Illumina TruSeq DNA样品制备LT试剂盒的说明书构建文库,最后在Illumina Miseq(PE2500)平台上机测序。原始数据保存在美国国立生物技术信息中心(national center for biotechnology information,NCBI)数据库,登录号为PRJNA622890。
1.3.3 序列处理
原始序列通过QIIME pipeline(v.1.8.0)进行处理[22]:①序列解复用,去除标签、引物和接头序列;②过滤序列长度<110 bp、模糊碱基>2以及平均得分<30的低质量序列;③使用Uchime评估并去除嵌合体;④经过Uclust将过滤后的高质量序列按照最小置信阈值(0.97)聚类成不同的操作分类单元(operational taxonomic unit,OTU);最后,排除可能是叶绿体或线粒体的序列,并计算相应的Chao1、Shannon和Simpson指数(按照最低序列数进行归一化处理)。
1.3.4 数据分析
通过单因素方差分析(analysis of variance,ANOVA)中的Duncan检验计算Alpha多样性指数的组间差异;采用基于Bray-Curtis距离系数的主坐标分析(principal coordinate analysis,PCoA)比较新、老窖池发酵过程中微生物群落的组成和结构差异,并使用相似性分析(analysis of similarities,ANOSIM)检验显著性;通过计算属间的Spearman等级关联度揭示微生物群落之间的关系,为了降低网络复杂性,只有显著的相关性(P<0.05)才被认为是有效的相关性。通过Gephi对微生物之间的相互关系进行可视化。
2 结果与分析
2.1 新、老窖池浓香型白酒发酵过程中酒醅微生物菌群的α-多样性分析
α-多样性是能够反映特定区域或生态系统内生物丰富度和多样性的综合指标[21]。新、老窖池浓香型白酒发酵过程中酒醅样品微生物菌群的α-多样性见图2。由图2可知,整体而言,两组窖池浓香型白酒发酵过程中酒醅样品微生物菌群的α-多样性呈先增后减的变化趋势,并且细菌菌群的丰富度和多样性都远高于真菌菌群。在发酵前7 d,细菌和真菌菌群的α-多样性都有大幅度的提高,表明大量的微生物开始复苏增殖。在新窖池组中,细菌和真菌菌群的多样性分别在第7天和第15天达到最高,估计物种的总数分别为703种和116种。相比之下,老窖池组中细菌和真菌菌群的多样性要明显低于新窖池组。值得注意的是,老窖池组中细菌菌群多样性的增长趋势要滞后于新窖池组,而真菌菌群则呈现相反的趋势。在发酵70~95 d微生物菌群α-多样性降低,推测是因为发酵后期酒醅中乙醇含量和酸度过高,而有机物与氧含量过低所致[23]。
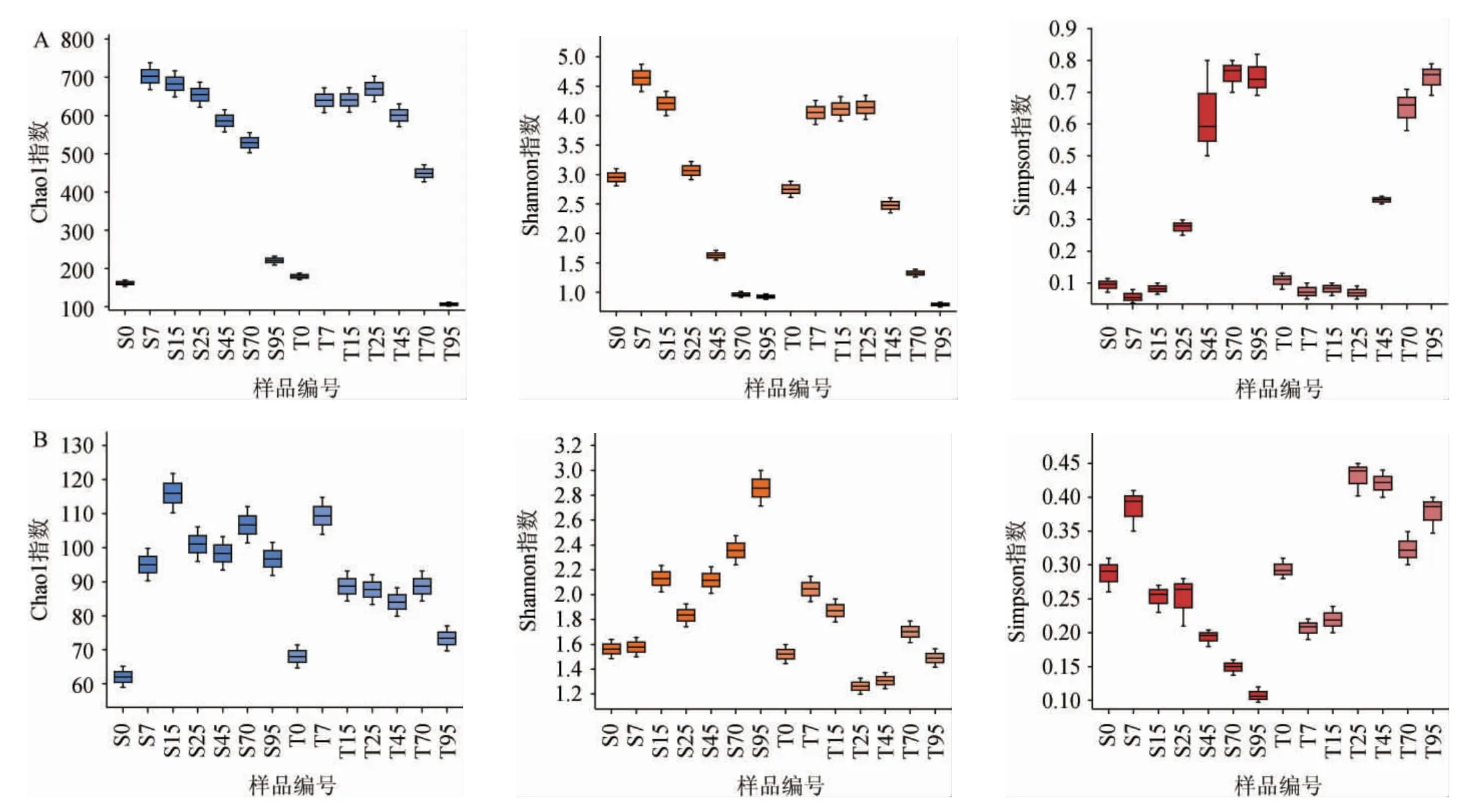
图2 新、老窖池浓香型白酒发酵过程中细菌(A)与真菌(B)菌群的α-多样性分析结果Fig.2 Analysis results of α-diversity of bacteria (A) and fungi (B) during strong-flavor Baijiu fermentation in new and old pits
2.2 新、老窖池浓香型白酒发酵过程中酒醅微生物群落差异
在了解新、老窖池组内微生物菌群多样性的基础上,通过PCoA比较新、老窖池浓香型白酒发酵过程中酒醅样品组间微生物群落的多样性,结果见图3。
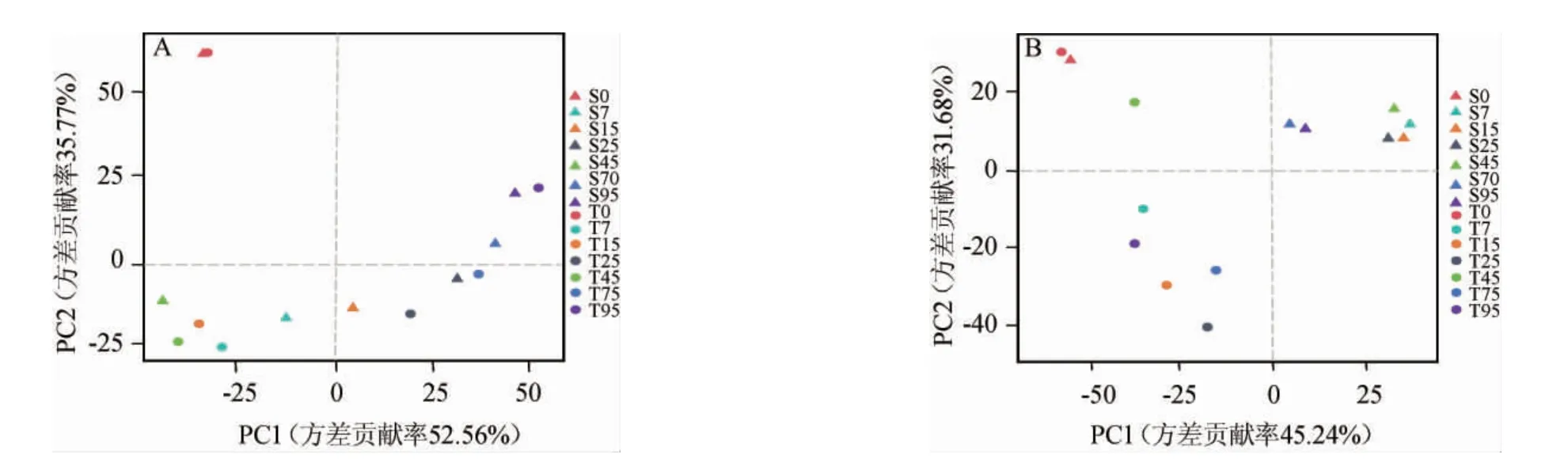
图3 基于Bray-Curtis距离系数新、老窖池酒醅样品细菌(A)和真菌(B)菌群的主坐标分析结果Fig.3 Principal coordinate analysis results of bacterial (A) and fungal (B) communities in fermented grains samples of new and old pits based on Bray-Curtis distance coefficient
由图3可知,整体而言,细菌群落的动态演替在新、老窖池浓香型白酒发酵过程中高度相似。两组酒醅样品在PCoA坐标空间中没有形成明显的聚集,说明细菌群落在整个发酵过程都处在不断的演替之中,而且发酵前期的结构变化较大,而后期则趋于稳定。相比之下,真菌群落的演替在两组窖池浓香型白酒发酵过程中有明显的差异,形成各自的集簇。尽管如此,两组窖池发酵酒醅样品S0、T0的细菌和真菌菌群在PCoA坐标空间相互接近或重合,说明发酵初始酒醅样本中细菌和真菌的群落结构十分相似,这可能归因于新、老窖池入池的初始糟醅是一样的结果所致[24]。
2.3 新、老窖池浓香型白酒发酵过程中酒醅微生物群落的组成及其动态演替特征
2.3.1 细菌群落组成及动态演替特征
在目和属水平,新、老窖池浓香型白酒发酵过程中酒醅细菌群落组成见图4,本研究将在某一样品中相对丰度>1%的微生物定义为优势微生物。由图4A可知,新、老窖池浓香型白酒发酵过程中具有高度相似的种群动态。乳杆菌目(Lactobacillales)、肠杆菌目(Enterobacteriales)和芽孢杆菌目(Bacillales)是新、老窖池酒醅样品S0、T0中的优势细菌目。但是,这些优势细菌目在发酵进行的前7天逐渐被厌氧绳菌目(Anaerolineales)、拟杆菌目(Bacteroidales)以及其他迅速增殖的类群所取代,这一动态过程代表了发酵早期(0~7 d)细菌群落的演替模式(方向)。随着发酵的进行,乳杆菌目的相对丰度逐渐回升并在中后期成为最主要的类群,这期间其他所有类群的相对丰度都呈连续下降趋势。厌氧绳菌目和拟杆菌目维持其优势地位直到发酵进行的第25天左右,随后相对丰度进一步下降至1%以下。值得注意的是,乳杆菌目在新窖池组中的增长趋势要明显快于老窖池组,乳杆菌目是乳酸和醋酸等有机酸的主要生产者[25],所形成的酸胁迫可能会抑制酸敏感类群的微生物正常生长,如芽孢杆菌属(Bacillus),而其中的蜡样芽孢杆菌(Bacillus cereus)和地衣芽孢杆菌(Bacillus licheniformis)是重要的己酸产生菌[26],这也可能是导致新窖池己酸乙酯含量偏低的一个主要因素。此外,其他优势细菌目还包括梭菌目(Clostridiales)(0.1%~6.6%)、假单胞菌目(Pseudomonadales)(0.2%~6.8%)、甲基球菌目(Methylococcales)(0~4.5%)、β变形杆菌目(Betaproteobacteriales)(0~3.0%)和微球菌目(Micrococcales)(0~4.5%)。这些类群大都在第7天大量出现,并随着发酵进行而逐渐减少。其中,梭菌目、假单胞菌目和甲基球菌目的相对丰度在老窖池组的发酵过中普遍高于新窖池组。有研究表明,梭菌目的相对丰度随着窖龄的增加而增加,而梭状芽孢杆菌(如科氏梭菌(Clostridium kluyveri))可以利用乙醇和乙酸产生己酸,是重要的己酸菌之一[27],这可能会使得老窖生产的浓香型白酒含有更高的己酸乙酯。
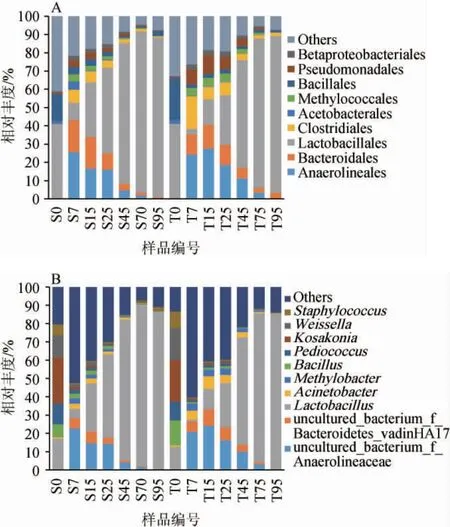
图4 基于目(A)和属水平(B)新、老窖池浓香型白酒发酵过程中酒醅细菌群落结构的动态变化Fig.4 Dynamic changes of bacterial community structure in fermented grains during strong-flavor Baijiu fermentation in new and old pits based on order(A)and genus level(B)
由图4B可知,乳杆菌属(Lactobacillus)(1.05%~91.24%)是乳杆菌目的代表菌属,也是发酵过程中最具优势的细菌类群,该菌属相对丰度的变化趋势与乳杆菌目基本一致。有研究表明,乳杆菌属(Lactobacillus)在发酵后期很大程度上主导了细菌群落的演替过程[28]。除此之外,乳杆菌目中的魏斯氏菌属(Weissella)(0.07%~17.57%)和片球菌属(Pediococcus)(0.01%~11.31%)只在酒醅样本S0、T0中占据优势地位,并且魏斯氏菌属在酒醅样品T0(17.57%)中的相对丰度要显著高于S0(12.08%)。随着发酵的进行,两者的相对丰度都呈连续下降的趋势。有研究发现,窖池发酵前期出现的Weissella、Pediococcus和部分Lactobacillus菌株能够快速产生乳酸、乙酸等有机酸,从而降低发酵体系的pH,抑制杂菌生长,代谢产生的二氧化碳则有助于维持发酵体系的厌氧环境,为后期乳酸菌的生长创造了有利的环境[29]。然而,随着发酵的进行,白酒发酵体系的酸度、乙醇浓度增加,含氧量降低,这些乳酸菌的生长受到了抑制而逐渐衰亡,直到消失,继而出现更耐酸、耐高浓度乙醇、耐低含氧量的乳酸菌完成后续发酵过程[30]。在芽孢杆菌目(Bacillales)中芽孢杆菌属(Bacillus)(0.27%~13.42%)和葡萄球菌属(Staphylococcus)(0.06%~9.15%)的相对丰度在酒醅样品T0中也显著高于S0,前者的相对丰度在发酵前25天内都>1%。Kosakonia(0.01%~21.18%)和泛菌属(Pantoea)(0.01%~10.78%)是肠杆菌目中的优势代表,其中,泛菌属在酒醅样品S0中的相对丰度(10.78%)显著高于T0(3.79%)。目前对泛菌属的研究主要集中在医疗与疾病方面,在白酒中还少有报道。有研究表明,泛菌属能够有效降解邻苯二甲酸酯[31],有助于控制白酒安全,但其对风味的具体影响还需继续挖掘。除上述优势细菌属之外,其他优势细菌属还包括Proteiniphilum(0~4.69%)、假单胞菌属(Pseudomonas)(0.02%~3.08%)、醋酸杆菌属(Acetobacter)(0.01%~4.17%)、拟杆菌属(Bacteroides)(0.05%~1.37%)、厌氧粘菌属(Anaeromyxobacter)(0~1.72%)、Fermentimonas(0~1.88%)、Saccharofermentans(0~1.14%)、互营菌属(Syntrophus)(0~1.07%)、黄杆菌属(Flavobacterium)(0~1.48%)、Longilinea(0~2.9%)等。黄杆菌属在土壤中广泛发现,但是在白酒酒醅中极少被鉴定为优势菌属,其具有高产α-淀粉酶能力,有利于原料中淀粉的利用[32]。综上,新、老窖池浓香型白酒发酵过程中酒醅细菌群落结构的演替较为相似。
2.3.2 真菌群落的多样性及动态演替特征
在目和属水平,新、老窖池浓香型白酒发酵过程中酒醅真菌群落的组成见图5。
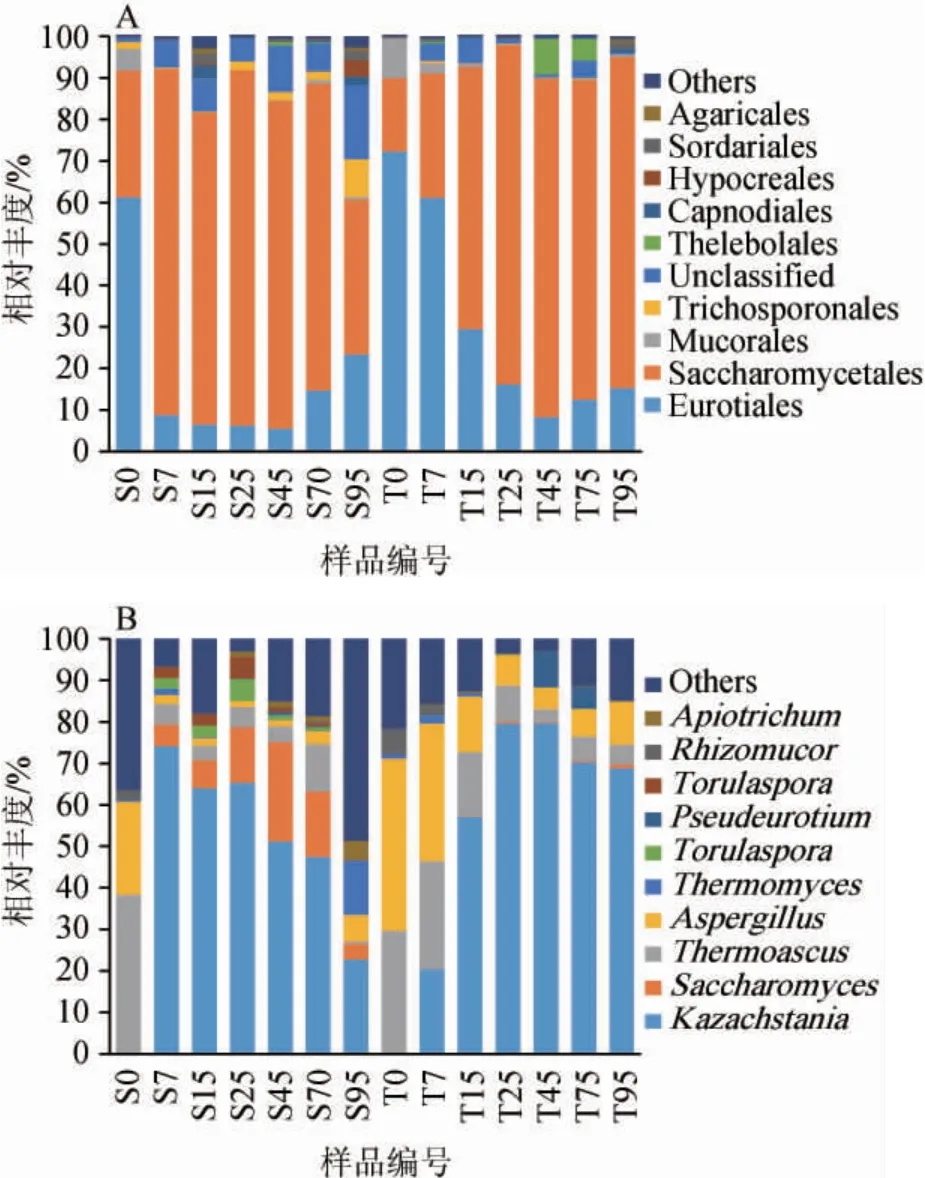
图5 基于目水平(A)和属水平(B)新、老窖池浓香型白酒发酵过程中酒醅真菌群落结构的动态变化Fig.5 Dynamic changes of fungal community structure in fermented grains during strong-flavor Baijiu fermentation in new and old pits based on order (A) and genus level (B)
由图5A可知,真菌群落的演替特征主要表现为优势类群散囊菌目(Eurotiales)向酵母菌目(Saccharomycetales)的过渡,且这种过渡演替的速率在新、老窖池浓香型白酒发酵过程中存在显著差异。在新窖池组中,酵母菌目的相对丰度在7 d内从最初的30.58%上升至83.47%,对应的散囊菌目相对丰度从61.24%下降至8.75%。然而,相似过程在老窖池组中在发酵第25天才完成。除此之外,毛霉目(Mucorales)是发酵前期的优势真菌目之一(5.24%~9.12%),并且在老窖池组中的相对丰度显著高于新窖池组(P<0.05)。毛霉代谢形成亚油酸乙酯和油酸乙酯,亚油酸乙酯具有花果的香气,使酒体结构更加丰满,有研究表明,油酸乙酯是茅台空杯香的主要物质,并且油酸乙酯也是鉴定不同窖龄白酒的重要标记物[33-34]。相反,丝孢酵母目(Trichosporonales)在新窖池组的相对丰度要普遍高于老窖池组,这可能就是新窖池的出酒率高于老窖池的主要原因。寡囊盘菌目(Thelebolales)在整个发酵阶段含量比较少(相对丰度<0.5%),仅在老窖池组的中后期(45~70 d)短暂的成为优势真菌目(4.35%~8.62%)。寡囊盘菌目与白酒相关性的研究十分少见,但在有关土壤的研究中发现其与纤维素降解密切相关[35]。
由图5B可知,在新、老窖池浓香型白酒发酵过程中,哈萨克斯坦酵母属(Kazachstania)(0.01%~79.33%)和酿酒酵母属(Saccharomyces)(0~23.50%)是酵母的代表类群。在宜宾的浓香型白酒产区中发现的酵母代表类群除这两类外,还包括拜氏接合酵母(Zygosaccharomyces bailii)与林生地霉(Geotrichum silvicola)[36]。在发酵前7 d时,哈萨克斯坦酵母属经历爆发式增长,另外老窖池组在发酵25~95 d时哈萨克斯坦酵母属的相对丰度要明显高于新窖池组。而酿酒酵母属仅在新窖池组的发酵过程中占据优势地位。已有研究表明,哈萨克斯坦酵母属能够在乳酸发酵过程中同化乳酸,并水解葡萄糖醛糖苷作为异型发酵乳酸菌的代谢底物,促进其利用果糖产乙酸[37],到目前为止,哈萨克斯坦酵母属只有少数几个种的代谢特性被表征。JOOD I等[38]研究发现,哈萨克斯坦酵母属的部分菌种具有积极的风味特性,但其发酵力要弱于酿酒酵母(Saccharomyces)。初步推测这是新窖池的产酒量较高,而老窖风味更优的原因之一。曲霉属(Aspergillus)(1.42%~41.20%)和嗜热子囊菌属(Thermoascus)(0.06%~37.06%)随着发酵的进行持续下降,且在老池组的相对丰度普遍高于新窖池组。曲霉属(Aspergillus)是诸多胞外酶(如淀粉酶和糖化酶)的主要贡献者,参与大分子物质的降解代谢,有利于白酒发酵的进行[39]。此外,老窖池组中假散囊菌属(Pseudeurotium)在发酵25~70 d呈现爆发式增长,相对丰度显著高于新窖池组。Apiotrichum(0~4.81%)则在新窖池组发酵的25~95 d有明显优势,相对丰度高于老窖池组。其他优势真菌属还包括丝孢酵母(Trichosporon)(0.11%~4.08%)、青霉属(Penicillium)(0~3.24%)、德巴利酵母属(Debaryomyces)(0~7.54%)、复膜孢酵母属(Saccharomycopsis)(0.01%~0.45%)、毕赤酵母(Pichia)(0.01%~1.46%)和Naumovozyma(0~1.97%)。之前有研究从冰葡萄汁中分离获得德巴利酵母菌,并发现其对糖、SO2、乙醇和酸均有较强的耐受性,可作为冰酒酿造的菌株[40],另外德巴利酵母能发酵葡萄糖产D-阿拉伯糖醇显著改善酒精饮品的品质[41],但其在白酒发酵的相关研究中少有报道,值得深入挖掘。综上,新、老窖池浓香型白酒发酵过程中酒醅真菌群落结构的演替差异较大。
2.3.3 微生物间的相关性与稳定性分析
有研究表明,微生物代谢物的多样化与其复杂多样相互作用有关,而微生物间相互作用则与微生物的演替与多样性相关[20]。采用基于Spearman等级相关性的共现性网络分析评估新、老窖池组优势微生物属的相互作用关系,结果见图6。由图6可知,在新、老窖池组中分别得到62和56个有效的连接节点,以及158和234对稳定的相关关系。与新窖池组的网络分析相比,老窖池组的微生物网络具有更高的聚集程度,微生物群落的共存关系更加复杂,稳定性更高,并且细菌之间的联系会比真菌更加紧密。另外发现同一种微生物在新、老窖池中表现出不同的相关性,如在新窖池中Aspergillus仅与Kazachstania呈现显著相关性(P<0.05),但在老窖池中Aspergillus与Lactobacillus、Saccharomyces、Bacteroides等微生物均呈现显著相关(P<0.05)。之前有研究表明,环境会影响微生物代谢从而改变微生物之间的相互作用[8]。窖池微生物群在窖池环境长时间的筛选下,不断适应窖池环境,形成更加稳定的群落结构。

图6 新(A)、老(B)窖池浓香型白酒发酵过程中酒醅优势微生物属网络分析结果Fig.6 Network analysis results of dominant microbial genera in fermented grains during strong-flavor Baijiu fermentation in new (A) and old (B) pits
3 结论
本研究采用高通量测序技术分析酒醅的微生物群落演替与组成结构,结果发现,老窖池中酒醅样品的细菌和真菌菌群多样性较低,且细菌菌群多样性的增长趋势也要滞后于新窖池,而真菌菌群多样性相反。新、老窖池酒醅样品中的真菌群落组成及演替规律存在明显差异,而细菌群落较为相似。老窖池酒醅样品中,曲霉属(Aspergillus)与哈萨克斯坦酵母属(Kazachstania)的相对丰度更高,而在新窖池酒醅样品中酿酒酵母(Saccharomyces)更具优势。通过相关性网络分析发现,随着窖池使用时间的增加,窖池中酒醅的微生物互作网络具有更高的聚集程度,微生物群落的共存关系也更加复杂,稳定性更高。后期研究中还需结合全基因组测序与代谢组学分析,进一步探究这些差异性菌株对浓香型白酒风味的影响机制,从而更好的为浓香型白酒的高质量发展提供科学依据。

