人原代呼吸道上皮细胞培养及抗呼吸道合胞病毒活性
丁惠如, 赵 敏, 程宁宁, 付远辉, 彭向雷, 虞结梅, 郑妍鹏, 何金生
(北京交通大学生命科学与生物工程研究院, 北京 100044)
人呼吸道合胞病毒(Respiratory syncytial virus, RSV)是人类呼吸道疾病的重要病原体,所引发的感染是导致儿童下呼吸道疾病和毛细支气管炎的主要病因,也是老年人和免疫功能低下患者发病和死亡的重要原因[1-3]。与RSV相关的呼吸道感染已成为全世界范围内主要的公共卫生问题之一,尽管从20世纪60年代起已开始研发RSV疫苗和治疗药物,但目前不仅仍无安全、有效的疫苗问世,针对RSV感染的抗病毒治疗药物也非常有限。迄今为止,仅有利巴韦林(Ribavirin)和帕利珠单抗(Palivizumab)两种药物用于防治RSV感染[4-6]。然而,Ribavirin疗效欠佳、副作用大,存在一定的健康风险,并不建议常规使用[7-9]。Palivizumab是特异性针对RSV F蛋白的人源化单克隆抗体,已获美国FDA批准,可用于预防高危婴幼儿因RSV感染而引发严重下呼吸道疾病,但其价格昂贵且不能用于RSV感染后的治疗[10-12]。因此,寻找安全、高效的抗RSV治疗性药物,仍是当前亟待解决的重要课题。
目前,抗RSV药物研发主要使用永生化的非极化上皮细胞系或RSV半许可复制动物模型[13-15]。永生化的呼吸道来源的细胞系,如HEp-2、BEAS-2B和A549细胞等,虽然在抗RSV药物体外药效评价具有一定价值,但很难反映呼吸道上皮细胞的复杂性[16-17]。小鼠等啮齿动物模型对RSV感染是半许可复制,亦难以再现人类RSV感染特征,作为抗病毒药物功效评价具有一定的局限性[18]。研究表明[19-23],人原代呼吸道上皮细胞(Human airway epithelial cell,hAEC)在允许细胞极化的条件下培养时会发生显著的形态变化,可准确重现其正常的在体形态。与非极化的上皮细胞相比,极化的呼吸道上皮细胞能够最大程度模拟体内呼吸道情况。因此,原代培养的呼吸道上皮细胞,尤其是分化良好的hAEC在抗RSV药物筛选、药效评价等方面受到广泛青睐。本研究建立了hAEC的培养方法并构建了RSV的体外感染模型,在该模型上检测了小分子化合物RSV-A-4和6-MMPr的抗RSV活性及其细胞毒性,进而探讨两种化合物抑制RSV复制的作用机制,为RSV药物研发和发病机制等研究提供实验基础。
1 材料与方法
1.1 材料
小鼠胚胎成纤维细胞(NIH/3T3)购自中国科学院上海细胞库;野生型RSV-long株购自美国ATCC;RSV-mGFP由法国Université de Versailles Saint-Quentin-en-Yvelines 大学Marie-Anne Rameix-Welti博士馈赠;RSV-A-4为前期本实验室从国家新化合物库筛选并结构优化的小分子化合物;6-MMPr和Ribavirin购自上海陶素生化科技有限公司;RSV-604和GS-5806购自美国MCE公司。
1.2 方法
1.2.1 hAEC标本的获取及培养
采集志愿者鼻拭子(志愿者为本课题组学生,均获知情同意,并经北京交通大学理学院伦理审查委员会批准),浸泡于培养基中,充分洗涤后,450 g,室温离心5 min,弃上清液,用F培养基(DMEM/F12,Gibco BRL, 美国)重悬后,加入到生长有NIH/3T3细胞的T25培养瓶中,37 ℃、5% CO2细胞培养箱培养;每天更换F培养基,5 d后更换为无抗生素的培养基继续培养,hAEC生长密度达50%以上时进行传代。
1.2.2 hAEC形态学观察和活力测定
每天定时在倒置显微镜下观察细胞形态,当hAEC生长密度达到80%时,采用胰酶消化细胞,制备单细胞悬液,0.4%台盼蓝染液染色后,置于倒置显微镜下观察,随机取3个视野统计死细胞与活细胞数目,进而计算hAEC的细胞存活率。
1.2.3 hAEC免疫荧光染色鉴定
按5×104个细胞/孔,将hAEC接种于置入细胞爬片的6孔板中,37 ℃、5% CO2培养,每天换液并记录细胞状态,当细胞丰度达到80%左右时,吸出培养基,PBS洗3次后,用预冷的95%乙醇4 ℃固定30 min;弃去乙醇,PBS洗3次,加入含5%胎牛血清的封闭液,37 ℃封闭30 min;PBS洗3次,加入兔抗人角蛋白单克隆抗体(Abcam,Cat.No.ab53280)(1∶1 000稀释),37 ℃孵育1 h;PBS 洗3次,加入山羊抗兔 DyLight488 荧光二抗(Abcam,Cat.No.ab96899)(1∶5 000稀释),37 ℃孵育1 h;PBS洗涤后,加入DAPI 核染剂染色15 min,最后用90%甘油进行封片后在显微镜下观察。
1.2.4 RSV感染hAEC
P3代hAEC生长密度达到60%时准备接毒,弃去原培养基,PBS洗1次,加入7 mL 2%细胞维持液,按0.1 MOI接种 RSV-mGFP病毒,混匀,37 ℃、5% CO2培养,接毒约20 h后,更换维持液,每天观察细胞病变情况,待细胞完全病变后,收集病毒。
1.2.5 细胞活性检测(MTS法)
按1.5×104个细胞/孔将hAEC接种于96孔板,37 ℃、5% CO2培养过夜;弃去原培养基,PBS洗过后,将0.1、1、10、100和1 000 μmol/L的待测化合物加入96孔板中,100 μL/孔,设置阴性对照、阳性对照组(Ribavirin)及空白对照。37 ℃培养48 h,弃原培养基,PBS洗1次,避光将MTS和PMS按照20∶1混合,并将20 μL混合液与100 μL 2%细胞维持液加入到96孔板中,37 ℃孵育3 h后,使用多能酶标仪检测490 nm处OD值,计算细胞活性CC50。
细胞活性=(实验组吸光度值-空白对照组吸光度值)/(细胞阴性对照组吸光度值-空白对照组吸光度值)×100%
1.2.6 化合物抑制RSV复制活性分析
按2×104个细胞/孔将hAEC接种于黑色透明底96孔板,37 ℃、5% CO2培养24 h后,将浓度为0.02、0.2、2、20和200 μmol/L的待测化合物分别与3 000 PFU/50 μL的 RSV-mGFP等体积混合,按100 μL/孔加入96孔板中,同时设置阴性对照(DMSO稀释50倍)和病毒对照组(只加3 000 PFU的RSV-mGFP),37 ℃,5% CO2培养48 h,用多功能酶标仪检测绿色荧光蛋白的荧光强度,并计算IC50。
1.2.7 Time-of-addition assay分析
将hAEC按1.5×104个细胞/孔接种于96孔板,37 ℃培养24 h后弃培养基,PBS洗1次,加入用2%维持液稀释的RSV病毒液,每孔3 000 PFU/100 μL,37 ℃、5% CO2孵育2 h,此时间点定位第0小时,弃去培养基,PBS洗涤1次,加入90 μL维持液,37 ℃培养;将化合物用维持液稀释,使稀释浓度低于其CC50,但大于IC50,RSV-A-4、6-MMPr、RSV-604、GS-5806及Ribavirin分别为1 mmol/L、50 μmol/L、10 μmol/L、1 mmol/L和100 μmol/L,设立阴性对照组;分别于-1、0、1、2、3、4、5、6、7、8、9、10、11、12、13及14 h时,加入10 μL不同化合物及DMSO,加入病毒约24 h后,PBS洗3次,提取细胞与病毒RNA,RT-qPCR测定RSV病毒滴度。
1.3 数据处理与分析
正态分布数据选用t检验和单因素方差分析方法,非正态分布数据采用非参数检验,通过IBM SPSS statistics 22软件进行统计学分析,通过GraphPad Prism 8作图,以P<0.05作为不同组间差异具有显著性的标准。
2 结果与分析
2.1 hAEC细胞培养与鉴定
2.1.1 hAEC形态学观察
显微镜下观察hAEC生长情况,结果如图1所示。接种hAEC第2 天,即可见有原代细胞出现;第3~5天,细胞团逐渐变大,细胞聚集成团;第5~8天,细胞数量逐渐增多,细胞团面积也逐渐变大,细胞呈扁平状、多边形状,密集呈鹅卵石铺路样分布生长(图2),约占细胞培养瓶的80%以上;第10天,细胞汇合度达90%,说明hAEC在滋养层细胞上生长良好。
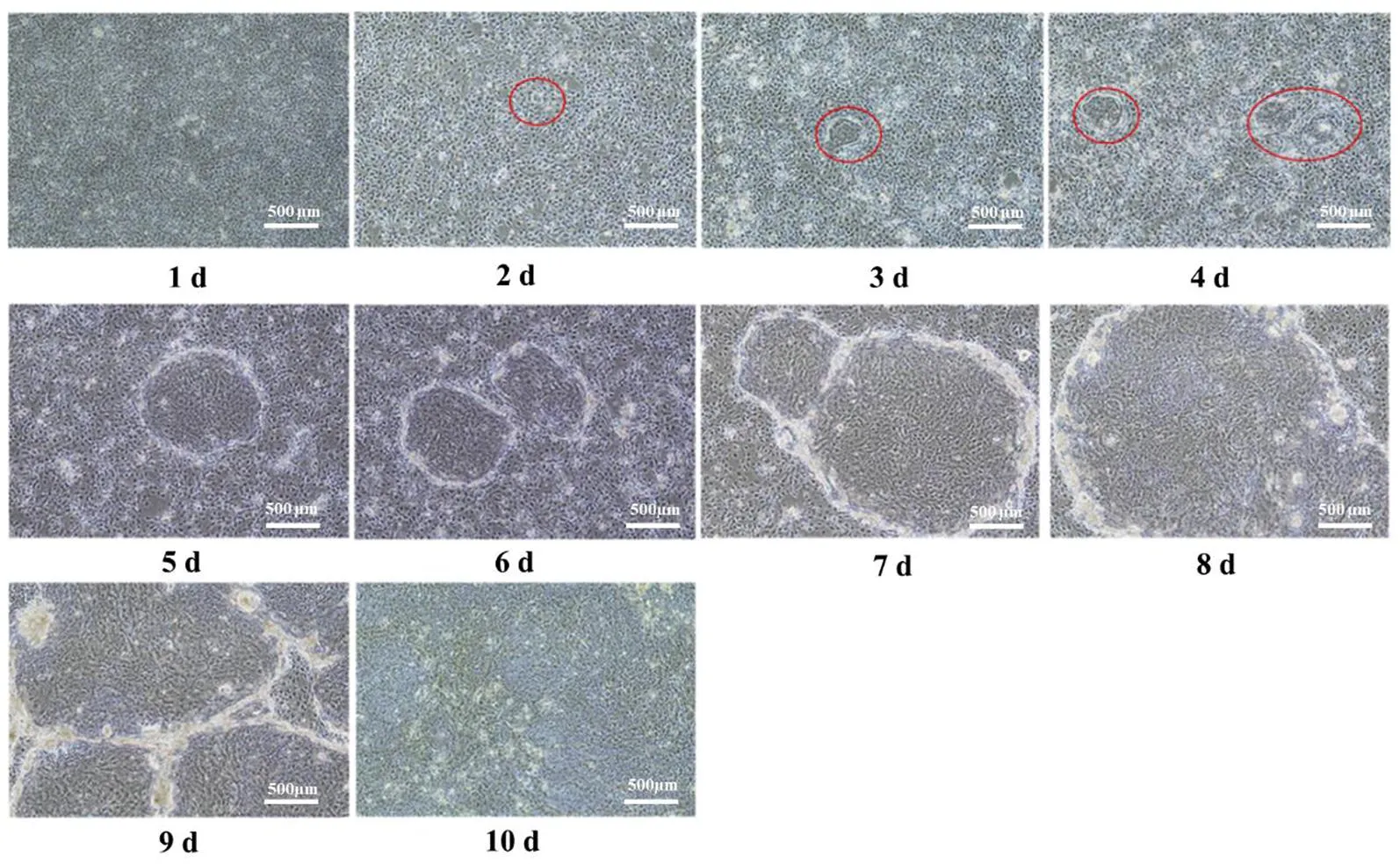
红圈标示的是原代细胞,第10天时原代细胞汇合度达90%左右。图1 hAEC的连续培养状态(4×)Figure 1 The continuous culture of hAEC (4×)
hAEC传代结果显示(图3),在首次传代的第1天,即可见有小的原代细胞团出现,待细胞长到第4天时,汇合度可达90%左右,表明首次传代的细胞比原代培养的细胞生长更快。

图3 hAEC首次传代后生长状态(4×)Figure 3 The growth status of hAEC after the first cell passage(4×)
2.1.2 hAEC活力测定
hAEC用0.4%台盼蓝染色后镜检显示多数为强光点,只有较少数为蓝色点。结果提示,原代培养的hAEC细胞活性较高。随机选取3个样本(图4),计算hAEC存活率分别为94.23%、90.10%和95.19%,培养的hAEC平均细胞活力则为93.51%。
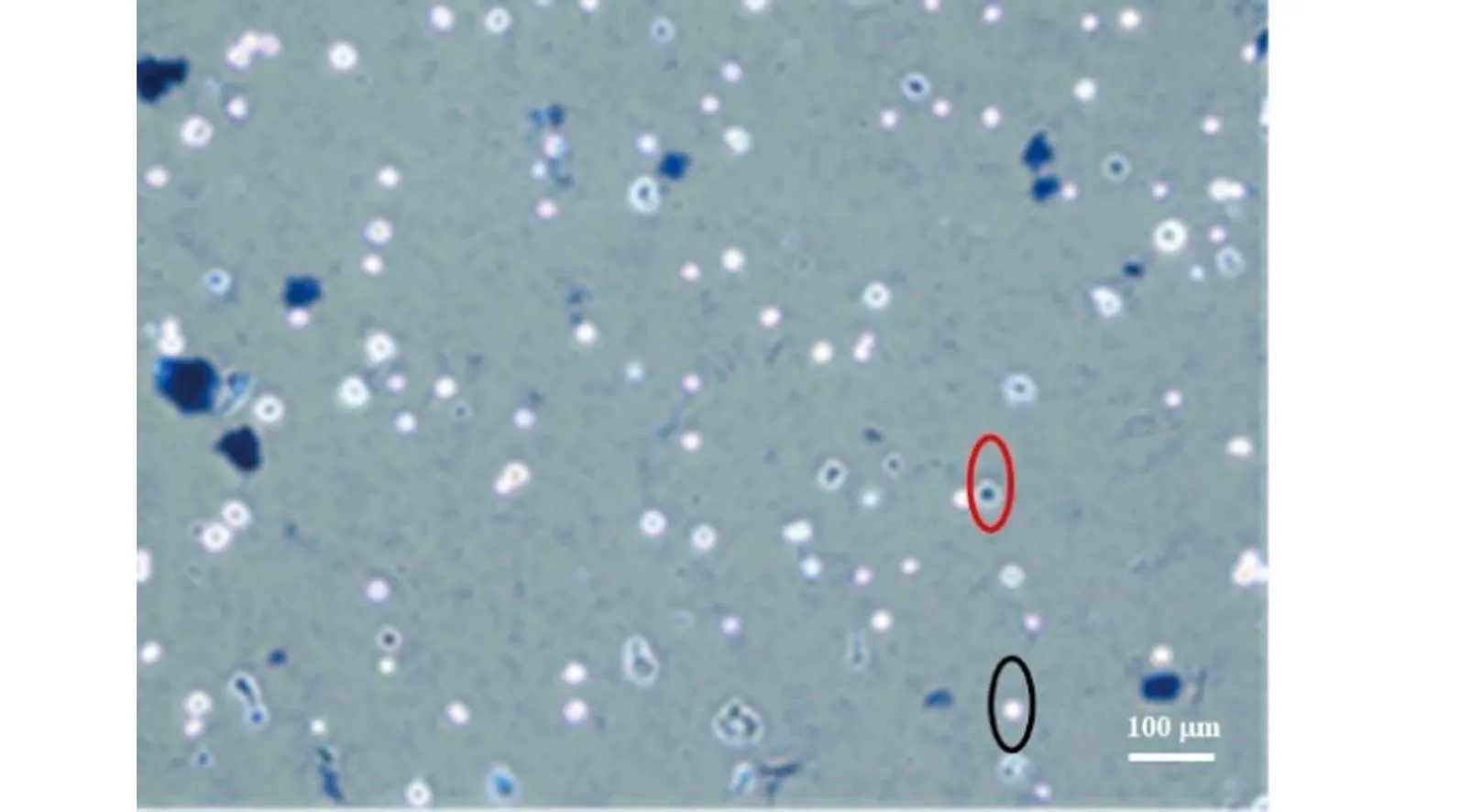
活细胞未被染色用黑色圈标示;死细胞被染色为深蓝色用红色圈标示。图4 台盼蓝染色检测hAEC存活率 (10×)Figure 4 The hAEC survival rate determined by trypan blue staining (10×)
2.1.3 hAEC免疫荧光染色鉴定
细胞免疫荧光染色结果显示(图5),hAEC经兔抗人角蛋白单克隆抗体与山羊抗兔 DyLight488 荧光二抗结合孵育后呈阳性,胞浆着色为绿色,细胞经DAPI复染后,细胞核为蓝色,人角蛋白单克隆抗体能与培养的原代细胞特异性结合,表明培养的细胞为hAEC。

(a)hAEC细胞胞浆着色(10×);(b)hAEC细胞胞浆着色(20×);(c)hAEC细胞核经DAPI复染后着色(10×);(d)hAEC细胞核经DAPI复染后着色(20×);(e)merge后图像(10×);(f)merge后图像(20×)。图5 免疫荧光染色鉴定hAECFigure 5 Identification of hAEC by immunofluorescence staining
2.1.4 RSV感染hAEC
如图6所示,P3代hAEC接种RSV-mGFP 24 h时,仅有极小的融合现象,提示病毒开始在细胞中复制;接种48和72 h时,可见病毒大量复制,出现大面积细胞融合、细胞核核聚集等典型的CPE,这表明RSV能够在hAEC中有效复制,也说明原代培养的hAEC可作为一种较为理想的RSV体外感染模型。
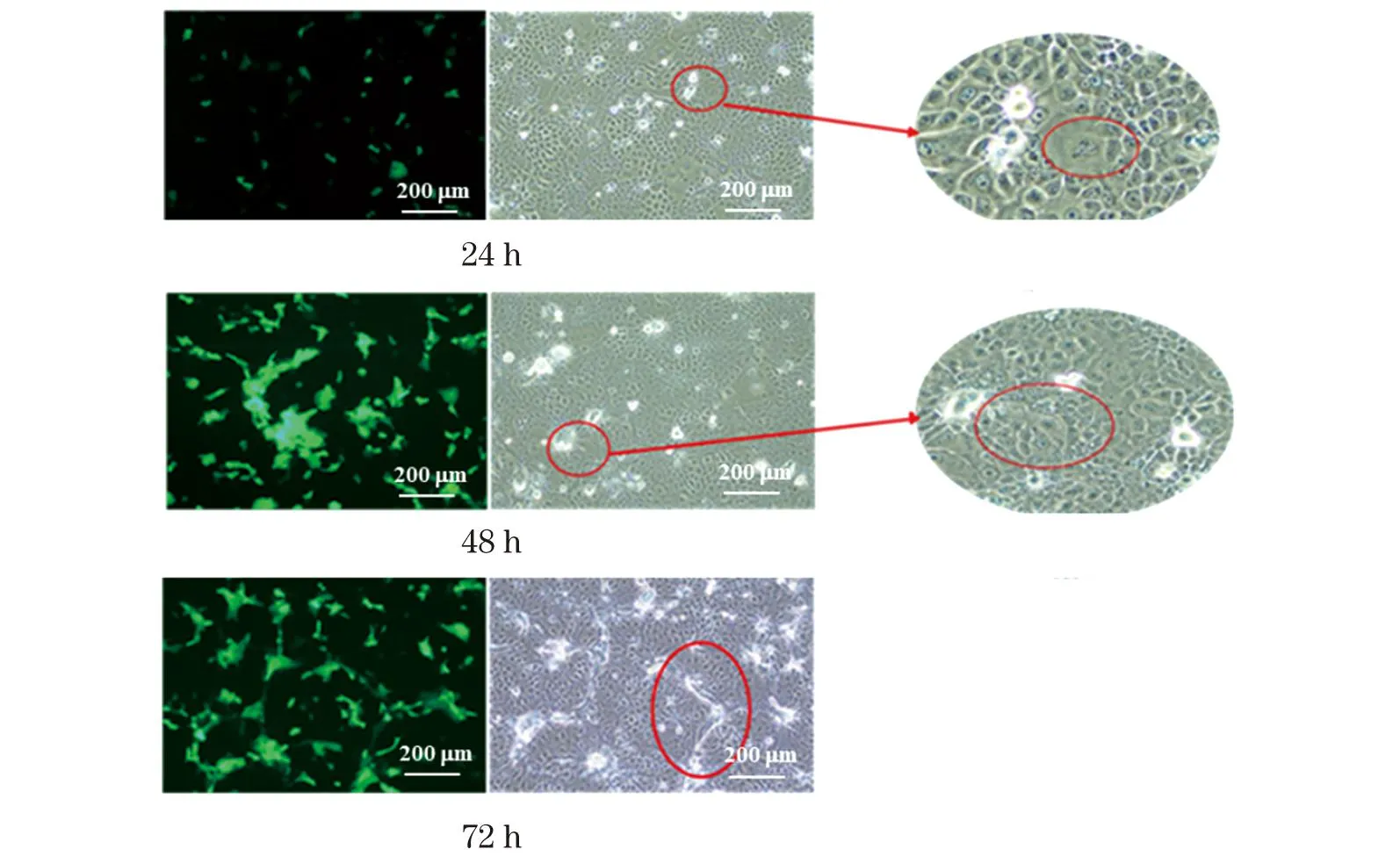
图6 RSV-mGFP感染hAEC后细胞病变状态Figure 6 The cytopathic effect (CPE) of hAEC infected with RSV-mGFP at different time points
2.2 RSV-A-4和6-MMPr的体外抗RSV活性
相对永生化的细胞系,原代培养的呼吸道上皮细胞能够最大程度模拟体内真实的生理状态和个体之间的差异,因此,根据课题组前期实验基础,本研究选取了RSV-A-4与6-MMPr两种小分子化合物进行基于hAEC的抗RSV活性研究,RSV-A-4与6-MMPr对hAEC的细胞毒性及对RSV的抑制效果如表1和图7所示。
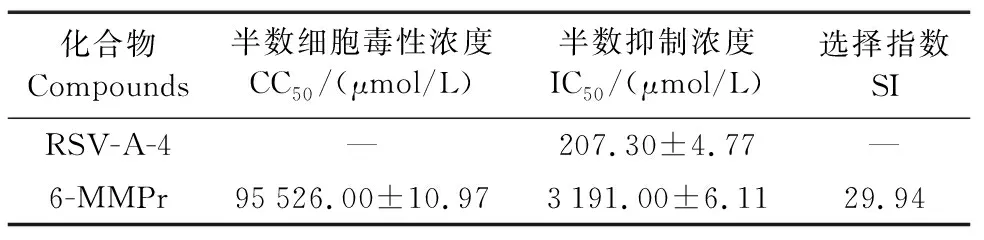
表1 RSV-A-4和6-MMPr基于hAEC的CC50、IC50及SITable 1 The CC50, IC50 and SI of RSV-A-4 and 6-MMPr based on hAEC
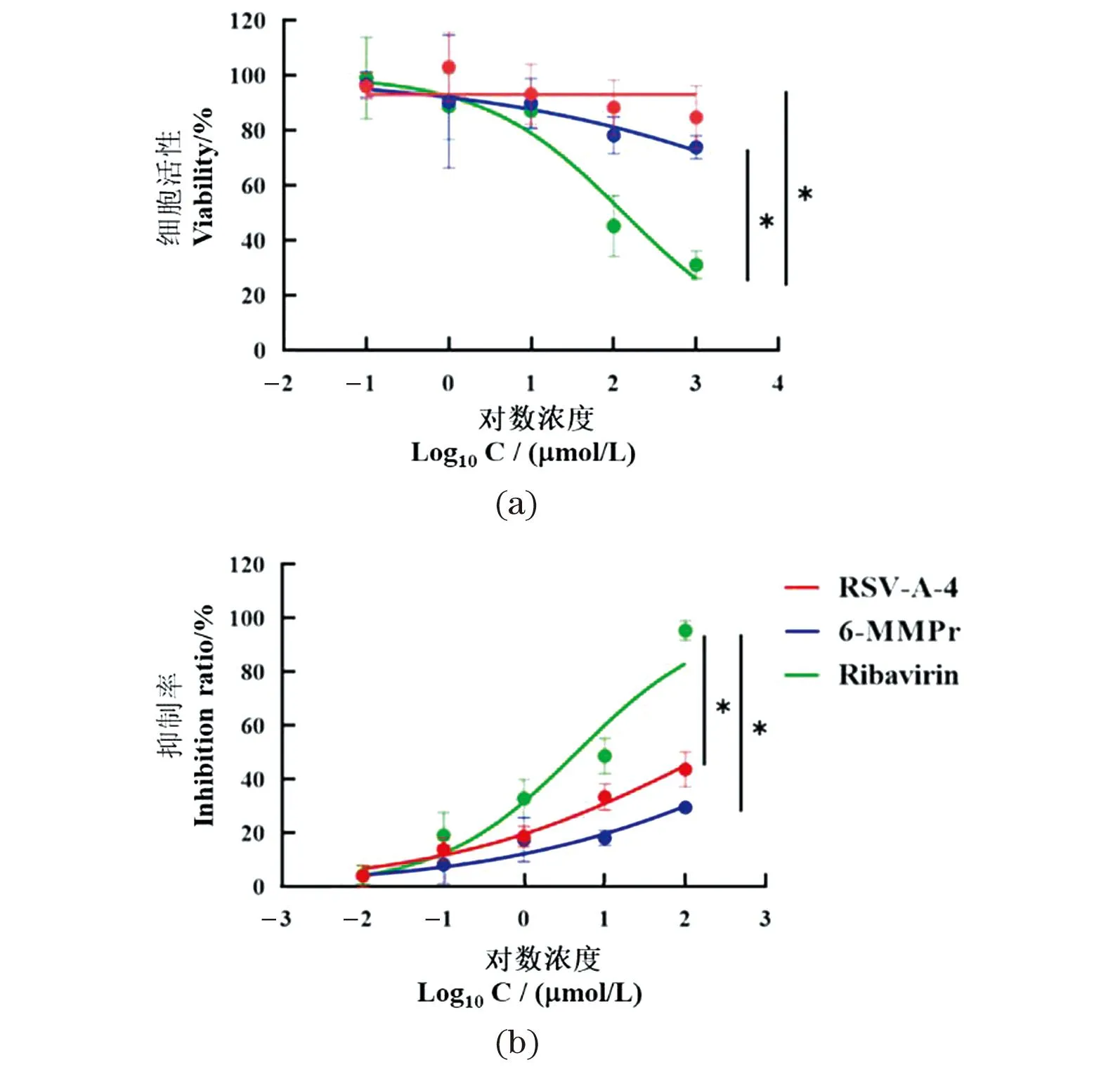
(a)RSV-A-4和6-MMPr的细胞毒性检测结果;(b)RSV-A-4和6-MMPr的抗RSV活性检测结果。实验结果以平均值±标准差表示,* 为P<0.05。图7 基于hAEC的RSV-A-4和6-MMPr细胞毒性和抗RSV活性Figure 7 The cytotoxicities and anti-RSV activities of RSV-A-4 and 6-MMPr on hAEC
由表1可见,6-MMPr在hAEC上的CC50值为(95 526±10.97) μmol/L,而RSV-A-4对hAEC几乎无毒性,RSV-A-4与6-MMPr 的IC50值分别为(207.3±4.766) μmol/L和(3 191±6.106) μmol/L。
2.3 RSV-A-4与6-MMPr均于病毒基因组复制阶段抑制RSV复制
鉴于筛选的RSV-A-4和6-MMPr在hAEC体系中具有良好的抗RSV活性,本研究在hAEC中采用Time-of-addition assay对其抗病毒作用机制进行了初步探讨。结果如图8所示,在-1、0、1、2、3、4和5 h给予RSV-A-4或6-MMPr均可有效抑制RSV复制,与靶向N蛋白药物RSV 604相似,由此推测RSV-A-4和6-MMPr主要是在RSV的感染晚期或进入细胞后发挥抗感染作用。
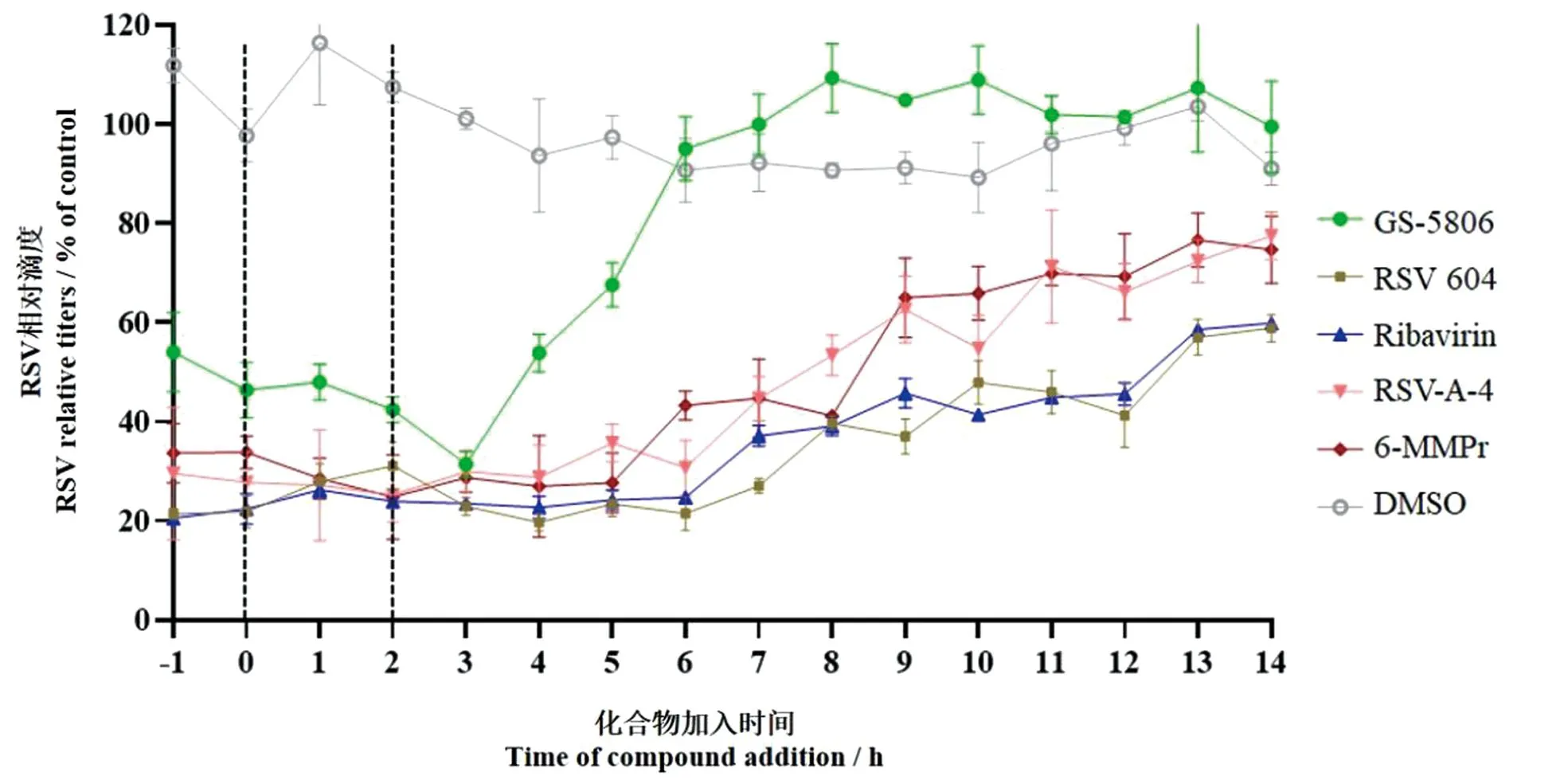
虚线指示RSV感染细胞的时间为2 h;实验结果以平均值±标准差表示。图8 RSV-A-4和6-MMPr抑制RSV复制周期结果Figure 8 The experimental results of RSV-A-4 and 6-MMPr inhibit RSV replication cycle
3 讨论与结论
呼吸道上皮是呼吸道重要天然屏障,作为人类呼吸道与外界环境相连的第一道免疫防线,hAEC对维持防御功能和各项生理功能的运行起关键作用[24-25]。分化良好的hAEC由多层上皮细胞组成,包括纤毛、杯状细胞和基底细胞等,可模仿人呼吸道的生理功能和形态环境,是研究RSV感染更为合适的体外模型。目前,全球范围内已有多个研究小组建立了人呼吸道上皮细胞的原代培养方法,且已将hAEC用于呼吸道病毒感染和呼吸道固有免疫等领域的研究[26-28]。但需要指出的是,hAEC培养在我国尚处于起步阶段,因此,建立hAEC培养对开展RSV疫苗和抗RSV药物研究具有重要价值和意义。
本文通过采集志愿者鼻拭子分离和培养出hAEC,并对hAEC细胞形态、活性及纯度进行了鉴定,结果显示hAEC的培养方法成功建立。相对细胞系,hAEC对培养环境和实验操作的要求更苛刻,不规范的实验操作可能会导致细胞生长缓慢、表型不一致甚至细胞污染,因而,规范实验操作和有效控制细胞污染是获得高质量hAEC的关键因素。此外,对人呼吸道上皮细胞培养模型,通常从呼吸道中鼻上皮、鼻咽上皮(腺样体)和气管支气管上皮这3个区域来获得原代上皮细胞,因而优化取材获得合格质量的样本是成功培养hAEC的另一个关键因素。hAEC在体外通常只能传代20多次,因而,如何围绕有限传代次数的hAEC设计实验,经济高效地利用好hAEC,也是一个挑战。当新收获的或传代的hAEC在允许细胞极化的条件下培养时,其细胞形态会发生显著变化,使得细胞更准确地重现其正常的体内形态,获得分化良好的极化的hAEC。在不断探索之后发现,当人呼吸道上皮细胞被体外培养在多孔载体上的气-液两相界面处时,其表现出了与体内几乎相同的形态学和关键生理学过程[29-31]。我们也曾尝试建立基于气-液两相的hAEC培养方法,但目前尚未获得分化良好的极化的hAEC,因而,将hAEC培养于多孔载体的气-液两相界面,获得分化良好的极化的hAEC将是我们下一步工作的重点。
在成功培养出hAEC后,考察了课题组前期在Hep-2和BEAS-2B细胞系中筛选出具有抑制RSV增殖的活性骨架化合物RSV-A-4和具有广谱抗病毒作用的硫唑嘌呤(AZA)三级代谢产物6-MMPr在hAEC体系中的抗RSV活性及其抗RSV活性的可能作用机制。实验结果显示:6-MMPr在hAEC上的CC50值为(95 526±10.97) μmol/L,而RSV-A-4对hAEC几乎无毒性,RSV-A-4与6-MMPr 的IC50值分别为(207.3±4.766) μmol/L和(3 191±6.106) μmol/L;Time-of-addition assay实验结果则揭示,RSV-A-4和6-MMPr的体外抗病毒活性主要是作用于RSV的复制阶段,二者均是于RSV感染早期,RSV复制阶段抑制RSV活性,但还需要进一步阐明RSV-A-4和6-MMPr的有效作用靶点和确切分子机制等。
综上所述,研究成功构建了RSV的体外感染模型hAEC,并在hAEC上考察了RSV-A-4和6-MMPr的抗RSV活性,并探讨二者抗RSV的可能作用机制,为进一步研发抗RSV药物奠定了重要基础。但后续工作尚需在小鼠体内进一步验证RSV-A-4和6-MMPr的体内抗病毒活性,以明确其应用前景。

