基于上转换纳米颗粒的肿瘤光动力治疗研究进展
王 芳,孙照刚,褚洪迁,
(1.首都医科大学附属北京胸科医院转化医学研究室,北京 101149;2.北京市结核病胸部肿瘤研究所耐药结核病研究北京市重点实验室,北京 101149)
目前,癌症依然是威胁人类健康的重要原因之一[1]。经统计显示,2020 年全球约有1 930 万癌症新发病例和近1 000 万癌症死亡病例[2],因此研究有效的癌症治疗新技术备受关注。传统的癌症治疗方法主要包括手术、化学疗法、放射疗法等[3]。但是,传统疗法存在较大的缺陷,如疗效差、毒副作用大和免疫耐受等[4]。因此,亟需开发有效的新型癌症治疗方案。光动力疗法(photodynamic therapy,PDT)是一种非侵入性的肿瘤治疗方法,已被广泛应用于临床抗肿瘤治疗领域[5]。然而,PDT 的临床应用还面临许多挑战,比如光敏剂(photosensitizer,PS)的激发光多为可见光,其组织穿透能力弱,导致PDT 的治疗局限在表层病灶,对深部肿瘤治疗效果差[6],严重限制了其实际临床应用,因此,开发具有高穿透深度的近红外光激活的光敏剂具有重要的意义。
上转换纳米颗粒(upconversion nanoparticle,UCNPs)是一类掺杂镧系元素的光学纳米晶体,在近红外光(near infrared,NIR)激发下,可将两个或多个低能光子转换为单个高能输出光子[7]。由于UCNPs 的NIR 激发光具有更深的组织穿透能力,并且其发射的紫外光或者可见光可激活光敏剂,从而产生具有高度反应性的活性氧(reactive oxygenspecies,ROS),达到直接杀死肿瘤细胞或者激活免疫系统的目的。因此,具有毒性小、化学稳定性高和光稳定性好等优点的UCNPs在PDT抗肿瘤治疗中具有广泛的应用前景[8]。
1 光动力疗法
PDT作为一种新型的微创性抗肿瘤治疗手段,逐渐引起研究者的兴趣。PDT 主要由3 种元素组成:PS、特定波长的激发光和氧气(O2)。PDT 根据光物理和光化学可分为Ⅰ型和Ⅱ型两种类型[9](见图1)。Ⅰ型PDT 是基于电子转移的光动力反应,可产生自由基(如、HO·和H2O2),但不是大多数PDT 的主要机制;Ⅱ型PDT 是三重态光敏剂与三重态分子氧发生相互作用,形成单线态氧(1O2),进而诱导细胞凋亡杀伤肿瘤细胞,这个过程需要O2的参与[10]。

图1 光动力疗法的机制示意图[9]
除了光和O2之外,光敏剂(PS)是PDT 的关键因素之一。PDT 的优点在于可通过控制光照对肿瘤部位进行针对性的治疗,而PS在黑暗环境下不会被激活。在激发光存在的条件下,可以引发PS 发生光化学或光物理反应[11]。但是PS 的组织渗透性差,自聚集使其无法渗透脂质双层,导致PDT 疗效降低[12]。目前,PS 的研究已经发展至第3 代[5]。第1 代PS 是卟啉类,其中血卟啉最早应用于临床治疗[13],但是存在纯度低、穿透能力差及毒性强的缺点;第2代PS是基于第一代发展而来,主要是血卟啉衍生物(hematoporphyrin derivative, Hp D)、 氯6(chlorine6,Ce6)、5-氨基酮戊酸(5-aminolevulinic acid,5-ALA)、3,7-双(二甲氨基)吩噻嗪-5 鎓氯(methyleneblue,MB)等,改善了第一代PS的缺点,但存在水溶性差的特点[13];第3代PS 是对第二代PS 进行化学修饰、结合靶向分子或者负载在纳米颗粒,具有更好的靶向性和生物相容性[14]。
2 上转换纳米材料
UCNPs 主要由敏化剂离子、活化剂离子和基质材料组成。其中,敏化剂镧系离子(如Yb3+)可以吸收近红外光,并将两个或多个光子传递给发射镧系离子(最常见的是Er3+、Ho3+和Tm3+)[15]。基质材料主要提供结晶主晶格结构,用于活化离子并将离子敏化到正确的位置,为其提供适当的光照条件[16]。
上转换发光(upconversion luminescence,UCL)是指将两个或多个低能泵光子从近红外(NIR)光谱区域转换为波长较短的高能量输出光子的非线性光学过程[17]。UCNPs 的发光机制主要分为3 个过程:激发态吸收(excited state absorbption,ESA)、能量转移(energy transfer,ETU)和光子雪崩(photon avalanches,PA)[18],见图2。ESA中的激发态吸收过程是基于同一离子通过连续多光子吸收从基态(G)达到更高能激发态能级的原理[19]。由于敏化离子和活化离子的激发态和初始能量状态之间的能量差是相同的,当它们之间的距离足够近时,激活离子中的电子跳跃到更高的激发态能级,两者之间可以发生共振产生能量,从而发生ETU[20]。PA是将ESA和ETU相结合的过程[21]。

图2 镧系元素掺杂的UCNP上转换发光过程[18]
合成UCNPs最常用的方法是热分解法、微乳液法、相转移水热合成法、溶胶-凝胶法等[22]。与传统发光材料(包括有机染料和量子点)相比,UCNPs 具有化学稳定性高、光学稳定性好、带隙发射窄等优点[23]。此外,在近红外光的激发下,具有较强的生物组织穿透力,对生物组织无损伤,信噪比高,在肿瘤治疗领域得到了广泛的应用[24]。
3 UCNPs在光动力治疗肿瘤中的应用
UCNPs具有将NIR光转换为可见光的能力,然后可以通过电子激发能量的转移激活PS,可改善传统PDT组织穿透受限的问题[25]。通常,与UCNPs 结合的PS 分为有机分子和无机分子。在大多数有机分子作为PS 的情况下,UCNPs 首先涂有聚合物或二氧化硅壳,实现PS的高有效载荷,保护其免受恶劣环境的降解。有机PS主要是通过物理吸附、静电吸附、物理包埋法、共价偶联等方法负载在UCNPs上[26]。对于无机晶体作为PS的情况,它们通常被设计成由UCNPs 为核、PS 为壳的核-壳结构。UCNPs 与PS 的结合不仅可以解决PDT 中PS 的组织渗透能力差的问题,还可以改善PS递送以及靶向性低等问题,在医学领域具有很好的应用前景[27],见表1。

表1 UCNPs的修饰及对应的肿瘤治疗改善效果
3.1 UCNPs增加PDT的组织穿透能力
Zhang 等[28]最先报道了PS-UCNPs 用于PDT 治疗肿瘤的例子,该体系是由二氧化硅涂层的NaYF4∶Yb3+,Er3+纳米颗粒包裹光敏剂M-540组成,可显著增加PDT的穿透深度,并有效诱导细胞死亡。Wang 等[29]将光敏剂Ce6 加载到基于NaFY4的聚乙二醇(PEG)功能化的UCNPs 上,形成一个超分子复合物UCNPCe6。与依靠可见光激发的传统PDT相比,使用UCNP-Ce6纳米复合物的近红外光触发的PDT显著改善组织穿透深度,可能更适合治疗大肿瘤或内部肿瘤。Hou 等[30]介绍了一种基于无机PS二氧化钛(TiO2)包覆在上转换纳米颗粒(UCNP)核/壳的纳米复合材料(UCNPs@TiO2NCs),其中NaYF4∶Yb3+,Tm3+@NaGdF4∶Yb3+核/壳UCNPs可以有效地将近红外光转化为与TiO2壳层吸收匹配的紫外线,见图3。此外,UCNPs@TiO2NCs 可以通过980 nm 近红外光的激发有效地产生细胞内ROS,诱导体外癌细胞凋亡。实验结果显示对照组和UCNPs@TiO2未照光组有大量的活细胞群,早期和晚期凋亡细胞很少。然而在500 μg/mL剂量下,近红外或紫外光介导的UCNPs@TiO2组凋亡细胞群显著增加。
3.2 UCNPs提高PDT的靶向性
UCNPs递送肿瘤治疗药物的方式包括被动和主动。被动靶向是经高渗透滞留效应(enhanced permeability and retention effect,EPR)实现材料在肿瘤的聚集,但是效率偏低[40]。主动靶向是根据UCNPs材料的可修饰性,利用纳米系统表面的特定分子与肿瘤部位的特定分子间、蛋白间(如叶酸受体,适配体等)的主动识别而结合,达到药物在肿瘤部位特异性聚集的目的[41]。
叶酸(folic acid,FA)受体在多种肿瘤中过表达,而在绝大多数正常组织中基本不表达或低表达[42],因此可对UCNPs进行叶酸修饰,借助叶酸-叶酸受体的相互作用将药物主动靶向至肿瘤部位。Zhao等[31]开发了一种基于叶酸-聚乙二醇-聚天冬氨酸-腙-二氢硫辛酸(FA-PEAH)聚合物改性的UCNPs载体,偶联疏水性PS pheophorbide a(Pha)的新型治疗诊断系统(FA-PEAHUCNPs-Pha,见图4A。与游离Pha 和非FA-配体偶联的CH3-PEAH-UCNPs-Pha 相 比,FA-PEAH-UCNPs-Pha 对MCF-7 细胞的细胞毒性和细胞摄取均显著增强,并产生高效率的PDT作用。值得注意的是,FA-PEAH-UCNPs-Pha 组在30 μg/mL 浓度下处理5 min 后,MCF-7 细胞的存活率下降到近25%。Lu等[32]把UCNPs、酞菁锌(II)和叶酸共价组装成一种高效的纳米颗粒(UCNPs-ZnPc/FA),可以通过980 nm 的近红外光照射触发PDT产生高效的单线态氧,还可以通过肿瘤成像引导PDT抑制肿瘤生长。生理盐水组、生理盐水+NIR 组和UCNPs-ZnPc/FA组在皮下注射Hepa1-6 细胞2 周后长成直径为10~15 mm 的实体瘤,而UCNPs-ZnPc/FA+NIR 组肿瘤细胞的生长受到明显抑制,相比于对照组肿瘤抑制率约为80.1%。
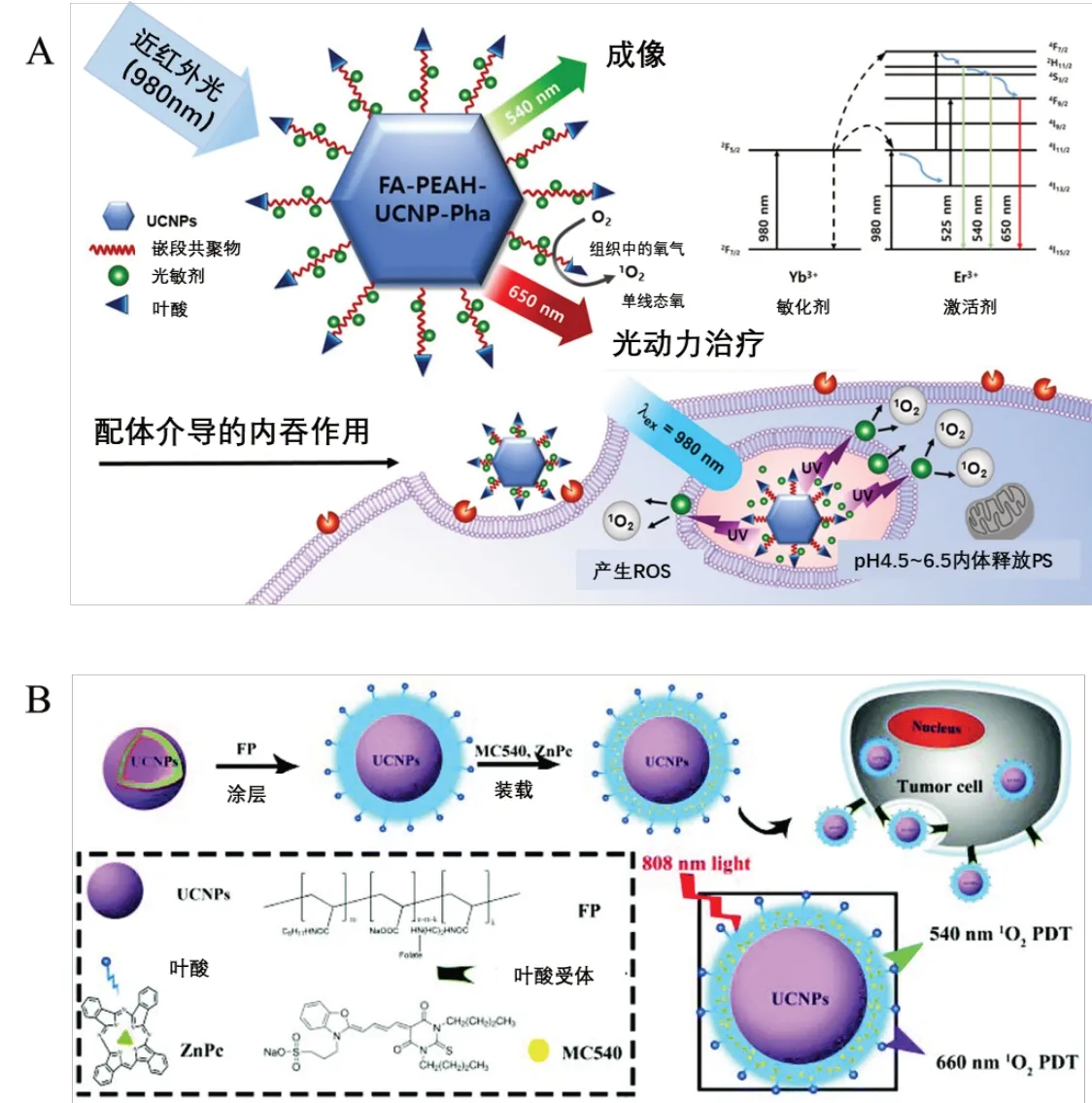
图4 利用叶酸修饰UCNPs实现主动靶向的抗肿瘤治疗体系[31,33]
与单一PS 相比,将单一光源对UCNPs 的多次发射应用于纳米体系,可以明显提高PDT疗效。Yang等[33]首先利用叶酸改性的两亲性聚合物叶酸-聚丙烯酸-辛胺(FA-PAA-octylamine,FP)包覆在疏水性UCNPs 的表面,促进UCNPs 的分散性和肿瘤细胞的靶向性,并充分利用UCNPs 在808 nm 光激发下的多色发射能力,同时激活两种不同的PS(MC540 和ZnPc)达到增强PDT的功效,见图4B。暴露在808 nm光下,随着FPUMZ浓度的增加,与FPUMZ 孵育的HeLa 细胞的活力显著下降。在808 nm激光照射下,当纳米系统与单一光敏剂MC540或ZnPc 结合时,肿瘤明显缩小。与单一PS 治疗相比,激活两种光敏剂的PDT导致更明显的肿瘤抑制。体外和体内的治疗效果均表明双PS纳米结构为增强PDT治疗提供了一种简单而有效的方法。
3.3 基于UCNPs的光动力联合其他疗法
单一的PDT疗法难以完全抑制肿瘤生长和/或消除肿瘤,多平台的协同疗法备受关注。Xu 等[34]设计了同时负载PS Ce6 和Toll 样受体7 激动剂咪喹莫特(R837)的UCNP-Ce6-R837,通过NIR 激发诱导PDT 并引发抗肿瘤免疫治疗。在NIR 的照射下,UCNP-Ce6-R837 不仅增强组织穿透深度,还有效地触发PDT破坏肿瘤细胞产生肿瘤相关抗原,同时作为佐剂的R837 可诱导产生强烈的抗肿瘤免疫反应。Ding等[35]制备了以介孔二氧化硅为免疫佐剂包裹的上转换纳米粒子(UCMS),同时负载光敏剂MC540、鸡OVA或者肿瘤细胞碎片,用于抗肿瘤治疗。在NIR光照射下,UCMSs-MC540-TF激活MC540,诱导PDT产生ROS杀伤肿瘤细胞,从而释放TAA 刺激DC 细胞,引发一系列免疫反应以增强抗肿瘤作用。目前,已有许多研究表明基于UCNPs的PDT与免疫疗法的联合使用,在增强消除肿瘤效果的同时还具有长期免疫记忆的功能,可预防肿瘤复发。
化疗与PDT 的联合使用也被广泛应用于抗肿瘤研究[43]。Rafique 等[36]以UCNPs 为核心和mSiO2为壳,并将其与DOX 和Ce6 结合构建了一个新型输送系统(UCNPs@mSiO2-DOX/Ce6)。该系统可通过吸收近红外光激活Ce6,诱发PDT 产生ROS,并释放化疗药物DOX,实现有效的协同治疗,增强肿瘤治疗效果。当UCNPs@mSiO2-DOX/Ce6浓度为200 μg/mL时,与SCC7细胞系孵育12、24 和48 h 后,细胞存活率分别下降到89%、80%和51%。由于Ce6 分子产生单线态氧并释放DOX 分子,UCNPs@mSiO2-DOX/Ce6 在NIR 光诱导下的治疗效果(即使孵育时间仅为12 h)也明显高于黑暗环境下的治疗效果(存活率:41%)。Lv等[37]基于UCNPs以光敏剂NH2-MIL-53(Fe)为外壳,负载DOX,构建一种多功能纳米药物平台(UMD)。在NIR 照射下,UCNPs激活NH2-MIL-53(Fe)诱导PDT,并在TME的酸性条件下释放DOX,协同化疗抑制胶质瘤的生长。
肿瘤微环境具有含氧量低的特点,对氧依赖的PDT也是一种重大挑战[44]。Ji等[38]使用光敏剂PFNS修饰在UCNPs 表面,包被上pH 敏感的Mn-Ca3(PO4)2(MnCaP)层,并将缺氧激活的前药AQ4N 纳入其中,形成73 nm 的纳米复合材料(UCNP@PFNS/AQ4N)@MnCaP。该纳米颗粒具有显著增强的渗透性和EPR 效应,并在酸性肿瘤微环境中分解MnCaP层,释放出UCNP@PFNS和AQ4N,在NIR光照射下产生串联激活的PDT和化疗效果。在pH=7.4、980 nm 激光照射下,HeLa 细胞有很高的细胞存活率;而在pH=6.8、980 nm 激光照射下,UCNP@PFNS@MnCaP 组和UCNP@PFNS/AQ4N)@MnCaP 组的HeLa 细胞表现出明显的细胞毒性,表明在酸性环境下释放的MnCaP壳将PDT从关闭状态转换到打开状态。值得注意的是,UCNP@PFNS@MnCaP组的中位致死剂量(LD50)值约是(UCNP@PFNS/AQ4N)@MnCaP 组的100 倍。Shao 等[39]设计了由单个UCNP 为核心和卟啉MOF 为壳组成的核心-壳异质结构(UCS),将缺氧激活前药替拉帕胺(TPZ)包封在异质结构MOF壳的纳米孔中形成TPZ/UCSs,联合PDT、缺氧激活的化疗和免疫疗法达到增强抗肿瘤效果(图5)。与UCNP-MOF异二聚体(UCDs)相比,UCNP@MOF 核壳纳米结构(UCSs)表现出更高的近红外光激活1O2效率,UCS和NIR辐照处理的细胞诱导的DCF荧光细胞为前者的1.4倍。TPZ受肿瘤微环境缺氧刺激,通过单电子还原反应产生有毒的氧化自由基,对缺氧癌细胞的细胞毒性高于正常细胞。未加载TPZ的UCSs在缺氧条件下无细胞毒性,低氧和常氧条件下TPZ/UCSs 对CT26 细胞的半数抑制浓度(IC50)分别为3.02 和55.04 μg/mL,而TPZ/UCSs 缺氧后经近红外照射的细胞毒性更强(IC50=0.74 μg/mL)。此外,该纳米平台(TPZ/UCSs)与α-PD-L1 检查点阻断疗法的组合不仅可以根除原发肿瘤,还可通过全身抗肿瘤免疫抑制未经治疗的远端瘤。
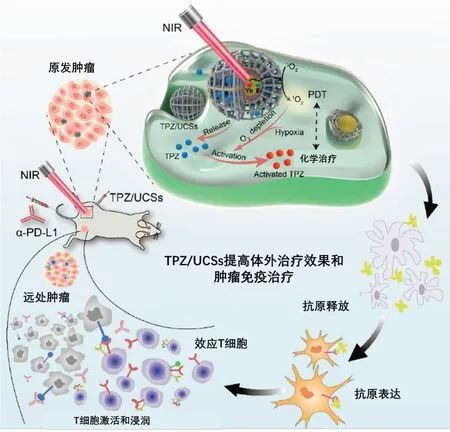
图5 TPZ/UCSs的结构及其触发光动力疗法联合缺氧激活化疗和免疫治疗抗肿瘤的示意图[39]
4 结语与展望
目前,PDT因其独特的优点被广泛应用于临床研究,但传统PDT依然存在局限性。随着纳米技术的不断发展,UCNPs在医学领域受到越来越多的关注,本文主要概述了基于UCNPs的PDT在抗肿瘤治疗中的应用。作为光敏剂载体和光能转换器的UCNPs可以显著提高PDT的治疗深度,降低光毒性,并且其可以通过表面修饰改变水溶性以提高生物相容性。此外,在药物递送和释放方面,UCNPs 对肿瘤的PDT 疗效明显优于传统的PDT疗法,在临床治疗中具有更大的应用潜力。
但是,在设计UCNPs 负载PS 用于PDT 时,需要认真考虑以下几个方面:①UCNPs 发出的光与PS 的最大吸收波长之间的光谱是否重叠;②UCNPs 内核与PS 之间的距离(有效能量转移的关键);③PS 担载量,PS 过量会对PDT 效果产生相反的影响;④壳的厚度,当选择核-壳策略时,由于PS药物与发光核之间的距离影响激活PS 的能量转移过程,从而影响PDT 效率;⑤纳米系统的生物相容性;⑥靶向PDT 策略[15]。除此之外,还需要考虑UCNPs在临床应用中的最适安全剂量、毒性潜伏期以及在人体中的代谢过程等问题,为UCNPs在医学领域提供更宽广的应用前景。

