酒精性肝病中的铁死亡机制研究进展
李雪梅,康 萌,万静之,李澳忠,刘启玲,,秦绪军
(1.陕西中医药大学公共卫生学院,陕西 咸阳 712046;2. 西北工业大学生命学院,陕西 西安 710072)
全世界约20亿人饮酒,导致每年有超330万例死亡病例(约占总死亡人数的5.9%)[1]。据不完全统计,中国每年因饮酒死亡人数高达70万,饮酒所致死亡人数占全球之首[2]。饮酒已经成为严重的公共卫生事件。酒精性肝病(alcoholic liver disease,ALD)是由长期大量饮酒或短期酗酒而引起的复杂的肝脏代谢性疾病,具有较高的发病率和死亡率。临床上可将其分为酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和酒精性肝硬化4个阶段[3]。目前已报道的ALD 发病机制主要涉及肝脂肪变性、氧化应激、乙醛毒性和炎症反应等多种机制。但ALD的具体分子机制仍不清楚,且尚无明确有效的治疗药物[4]。因此,探讨新的分子机制对于寻找预防和治疗ALD 有效药物和策略具有重要意义。
铁死亡(ferroptosis)是由哥伦比亚大学Dr.Stockwell于2012年提出的一种新型程序性细胞死亡,在肿瘤、神经疾病、急性肝肾损伤、缺血再灌注等多种疾病中发挥着重要作用[5]。铁死亡是细胞内大量的活性氧(reactive oxygen species,ROS)在铁离子(Fe2+/Fe3+)存在的情况下,脂膜上多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)发生氧化产生大量的脂质过氧化物(lipid peroxide,LPO),如丙二醛(malonaldehyde,MDA)和4-羟基壬烯酸等,引起生物膜损伤,最终导致细胞死亡[6]。与其他细胞死亡形式相比,铁死亡具有独有的特征:①细胞形态方面,如细胞膜破裂、线粒体皱缩破裂、膜密度增高和嵴减少;②细胞分子方面,如胱氨酸/谷氨酸逆转运受体(system XC-)、谷胱甘肽(glutathione,GSH)、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPx4)水平抑制,以及Fe2+/Fe3+、ROS、PUFA、多不饱和脂肪酸-磷脂(PUFA-PLs)和LPO 等的过度积累[7-8]。
1 ALD中的铁死亡
研究表明,ALD伴随着铁死亡的发生,酒精能够通过多种机制引起铁死亡[9]。肝脏是人体重要的代谢器官,也是酒精代谢的主要场所。酒精可引起肝脏氧化应激,而氧化应激是触发铁死亡的必要条件之一。Liu等[10]通过酒精灌胃小鼠,发现酒精暴露后体内可产生过量ROS,引发氧化应激,诱导铁死亡发生。除氧化应激外,铁离子积累也是诱导铁死亡的主要原因之一。有研究发现有超过一半的ALD患者肝脏内会出现铁离子的沉积[11]。Luo 等[12]研究发现,酒精可诱导肝脏内铁离子浓度升高,导致铁死亡的发生。此外,脂质代谢紊乱所导致的LPO积累也能影响铁死亡。Liu等[13]通过酒精灌胃小鼠,发现酒精引起体内的LPO 积累可诱导铁死亡。Choi 等[14]发现,酒精会增加体内脂肪的合成,促进体内脂质过氧化进程,导致LPO积累,诱导铁死亡的发生。而抑制铁死亡能够改善ALD。He等[15]研究发现,抑制体内氧化应激,平衡铁代谢和脂质代谢等,会有效抑制铁死亡,保护肝脏。由此说明,铁死亡可能在ALD发生和发展中起着重要作用,是防治ALD的潜在靶点。因此,有必要对铁死亡进行深入研究,揭示铁死亡在ALD 中发挥的具体作用,为防治ALD提供新的策略和干预靶点。
2 酒精调控铁死亡的机制
2.1 酒精通过ROS调控线粒体及脂质过氧化诱导铁死亡
ROS是由氧分子不完全还原所产生的一类分子,具有分子量小、寿命短和高反应活性等特点。常见的ROS主要包括:超氧阴离子(·-O2)、羟自由基(·OH)、单线态氧(1O2)、过氧化氢(H2O2)以及各种过氧化物等[16]。这些ROS主要产生于线粒体、过氧化酶体以及内质网等细胞器[17]。当ROS水平过高时,会引发氧化应激,损伤细胞内蛋白质、脂质以及DNA等大分子,干扰正常的细胞信号转导,影响线粒体膜电位和电子传递链,导致细胞死亡,如凋亡、自噬以及铁死亡等[18]。
脂质过氧化是指在ROS存在的情况下,脂质分子受到氧化作用形成过氧化物的过程。其脂质过氧化产物被认为是铁死亡的标志之一。一些脂质过氧化酶在脂质过氧化过程中发挥着重要作用,包括乙酰基辅酶A 合成酶长链家族成员4(acyl-CoA synthetase long chain family member 4,ACSL4)、脂氧合酶和溶血磷脂酰胆碱酰基转移酶3(lysophosphatidyl-choline acyltransferase 3,LPCAT3)等[19]。ACSL 主要在内质网和线粒体外膜表达,其功能是将游离的长链脂肪酸和CoA结合形成脂肪酰基辅酶A。ACSL 共有5 种亚型,但只有ACSL4 与铁死亡有关,并被认为是铁死亡的敏感性标志物[20]。Xu 等[21]通过Lieber-DeCarli 液体酒精饲料诱导小鼠建立慢性ALD 模型,发现酒精引起肝脏发生氧化应激引起铁死亡,具体机制主要是酒精暴露导致体内ACSL4上调,产生过量LPO在体内积累而导致的。脂氧合酶是一类非血红素含铁双加氧酶,花生四烯酸15脂氧合酶(arachidonate-15-lipoxygenase,ALOX15)是人类脂氧合酶家族成员之一。ALOX15 能够将PUFA 作为底物进行氧化反应,诱导铁死亡的发生[20]。Zhang等[22]在研究慢性ALD模型中发现,酒精会上调ALOX15 表达,并增加ALOX15 产物的生成,从而诱导铁死亡的发生。LPCAT3 是一种调节花生四烯酸水平的酰基转移酶。当LPCAT3 高表达时,花生四烯酸的水平显著增加,导致LPO生成增加,破坏细胞膜结构,诱导铁死亡的发生[19,23]。Lu 等[24]通过对小鼠进行5%液体酒精饲料Lieber-DeCarli 喂养10 d,并在最后一天单次大剂量酒精灌胃(5 g/kg,30%体积比酒精)诱导成慢性加急性酒精性损伤小鼠模型(NIAAA 模型)[25],发现酒精引起肝脏ROS 产生增加,导致LPCAT3 过度表达,增加了LPO 浓度,诱导铁死亡的发生。这些研究结果表明,在ALD的发生的过程中,酒精的摄入上调了ACSL4、ALOX15 和LPCAT3 等酶的活性,加快脂质过氧化进程,破坏细胞膜结构,最终诱导铁死亡,可能促进了ALD的发生发展,因此抑制这些酶的表达或活性,或者增加体内抗氧化活性有助于抑制铁死亡,保护防治ALD。
线粒体是细胞主要的能量生产和转化场所。线粒体是双膜结构的细胞器,由外膜和内膜包裹基质构成。线粒体基质中含有高浓度的三羧酸循环酶混合物以及对ROS高度敏感易受氧化损伤的线粒体DNA。线粒体通过三羧酸循环、氧化磷酸化等过程进行营养代谢产生能量以供机体活动所需[26]。在能量代谢的过程中,电子传递链复合物I和III的电子泄漏产生,然后通过线粒体超氧化物歧化酶2的作用转化产生H2O2。生成的H2O2会与Fe2+发生Fenton 反应,产生高活性的·OH。这些ROS 会与PUFA发生反应,形成PUFA自由基,并与氧分子迅速反应生成LPO,导致线粒体氧化损伤[27]。
酒精会对线粒体产生明显损伤作用。酒精摄入后,部分酒精在肝脏线粒体代谢,产生过量ROS及线粒体氧化应激,导致线粒体形态和功能障碍[28]。酒精的代谢消耗了NAD+,引起NADH/NAD+的比值增加,使体内Fe3+转化为Fe2+,引发Fenton反应,产生过量的·OH,进一步加剧氧化应激和线粒体损伤[29]。Xue 等[30]在56%体积比酒精以6 mL/kg 灌胃SD 大鼠16周,诱导慢性ALD,结果发现酒精摄入引起肝组织线粒体结构的改变,包括线粒体膜密度的增加,线粒体嵴减少或消失以及外膜破裂等。Samuvel等[31]通过采用单剂量酒精灌胃诱导C57小鼠急性ALD,结果表明酒精暴露会损伤线粒体DNA,阻碍线粒体内脂肪酸β-氧化的正常进行。Ding 等[32]采用5%的液体酒精饲料Lieber-DeCarli 喂养C57 小鼠12 周,诱导慢性ALD,发现酒精摄入可导致线粒体形态和功能障碍,引起LPO 大量积累,诱导铁死亡的发生。而改善线粒体功能可以减轻酒精引起的铁死亡。Dong 等[33]通过NIAAA 法诱导C57 小鼠慢性加急性ALD,发现通过药物马鞭草干预激活过氧化物酶体增殖激活受体α可改善线粒体结构和功能障碍,能够抑制铁死亡,保护酒精引起的肝损伤。Frataxin 是一种位于线粒体基质的与线粒体功能和铁硫簇生物发生相关的蛋白,对维持线粒体能量代谢具有重要作用[34]。Liu 等[10]发现,酒精能够抑制Frataxin 的表达,使线粒体形态功能受到损伤,增加ROS 及脂质过氧化,诱导铁死亡,促进ALD,而过表达Frataxin 能够降低铁死亡,减轻酒精引起的肝损伤。综上,酒精摄入引发线粒体ROS产生,导致氧化应激以及线粒体功能障碍,诱导铁死亡,促进ALD;而抑制线粒体氧化应激,提高线粒体功能可以减轻铁死亡改善ALD。
2.2 酒精通过GSH/GPx4调控铁死亡
GSH/GPx4 系统是体内维持氧化和抗氧化平衡的重要途径。该系统的上游组件是system XC-,由调节溶质载体家族3成员2(regulatory subunit slute carrier family 3 member 2,SLC3A2)和溶质载体家族7 成员11(catalytic subunit solute carrier family 7 member 11,SLC7A11,也称xCT)组成[6]。xCT主要负责转运活性,而SLC3A2 作为伴侣蛋白发挥作用,促进细胞内谷氨酸排出和细胞外半胱氨酸(cysteine,Cys)的摄取。通过system XC-的作用,Cys参与谷氨酸半胱氨酸连接酶和谷胱甘肽合成酶的合成过程,生成GSH。GSH 与GPx4 相互协作,发挥抗氧化作用。GPx4 是GPxs 家族成员之一,能够清除H2O2,将有毒的过氧化物如LOOH转化为无毒的脂质醇,从而抑制铁死亡发生。因此,GPx4 被认为是抑制铁死亡的重要因素之一[27,35]。不同的内外环境损伤因素可以通过抑制system XC-减少Cys 的摄取,从而导致GSH 的合成减少,抑制GPx4的活性,进而导致LPO积累,促使铁死亡的发生[36]。
酒精摄入可对GSH/GPx4 系统产生影响。Zhou 等[37]通过NIAAA法诱导C57小鼠慢性加急性ALD,发现小鼠肝脏GSH减少,GPx4 活性降低,抗氧化能力减弱,并伴随LPO 含量增加,从而导致铁死亡;但通过特异性敲除肠道SIRT1可以增加肝脏的GSH 和GPx4 含量,提高抗氧化能力,抑制LPO 含量,发挥酒精肝损伤的保护作用。Shah等[38]采用NIAAA 法诱导C57小鼠急性加慢性ALD,发现酒精暴露引起小鼠肝脏ROS产生的同时,system XC-、GSH、GPx4 以及SOD 水平降低,LPO 含量增加,诱导铁死亡发生。激活GSH/GPx4 系统可以抑制铁死亡。通过胸腺素β4 干预发现,增加肝脏抗氧化剂xCT、GPx4、GSH和SOD等含量,降低肝脏ROS和LPO的积累,从而抑制氧化应激和铁死亡,改善酒精诱导肝脏损伤。Xue 等[30]用酒精灌胃SD 大鼠16 周,诱导ALD,发现褐藻多糖可以通过增加system XC-以及GPx4 蛋白的表达等方式,提高肝脏抗氧化能力,抑制铁死亡,改善ALD。综上,system XC-和GSH/GPx4系统在调控铁死亡中发挥重要的作用。酒精摄入可降低system XC-和GSH/GPx4的表达,促进铁死亡,导致ALD的发生;提高体内system XC-和GSH/GPx4表达水平以提高抗氧化水平可能是防治ALD的一个新途径。
2.3 酒精通过铁代谢调控铁死亡
铁离子代谢异常也是影响铁死亡的重要因素。细胞内的铁代谢相关蛋白在维持铁代谢平衡中扮演着重要的角色。这些蛋白包括转铁蛋白(transferrin,TF)、转铁蛋白受体1(transferrin receptor 1,TFR1)、铁转运蛋白1(ferroportin 1,FPN1)、二价金属离子转运蛋白1、铁蛋白重链1 和铁蛋白轻链等[39]。TFR1是细胞摄取铁的主要途径,当铁离子和TF 结合后,再与细胞表面的TFR1 结合,通过内吞作用将铁离子摄入细胞。相反,FPN1是唯一能将铁从细胞内排出到胞外的蛋白。TFR1和FPN1共同调节细胞内外的铁平衡,前者将铁输送到细胞内,后者将铁输出到细胞外[39]。当细胞内铁代谢稳态受损时,导致细胞内铁离子增多,与H2O2发生Fenton 反应,进而诱导LPO 的积累,驱动铁死亡[7]。
研究表明,酒精能够影响细胞铁离子浓度。Zhao等[40]通过诱导C57小鼠慢性加急性ALD,发现细胞内铁离子浓度显著增加,可引发肝脏内脂质积累,进而导致铁死亡的发生。褪黑素可通过增加FPN和FTH等蛋白的表达,促进细胞内铁离子向外转运抑制铁死亡,保护肝脏免受酒精侵害。Zhou等[41]研究发现脂肪特异性高表达磷脂酸磷酸酶1会增加酒精引起的铁离子累积和铁死亡,从而加重ALD。相反,减少铁离子累积能够减轻铁死亡。Gao等[42]发现,缺铁情况下对小鼠进行3次酒精灌胃诱导急性ALD,发现肝脏损伤明显减轻,主要是因为铁离子的减少抑制了铁死亡的发生,这也从侧面表明铁离子依赖的铁死亡在ALD中具有重要作用。此外,Song等[43]研究表明,酒精可以激活核受体激活因子4干扰铁代谢,导致细胞内铁离子浓度升高,驱动铁死亡的发生。采用药物水飞蓟素干预可以抑制核受体激活因子4 的表达,进一步抑制细胞内铁离子浓度的升高,从而发挥肝脏保护作用。综上,铁代谢与铁死亡密切相关,酒精引起的铁代谢相关蛋白异常,引起铁离子累积是酒精引起铁死亡的重要机制之一,调控特定铁代谢相关蛋白也有望成为调控铁死亡防治ALD的潜在靶点。因此,本文对酒精调控铁死亡的机制作了一个示意图,见图1。
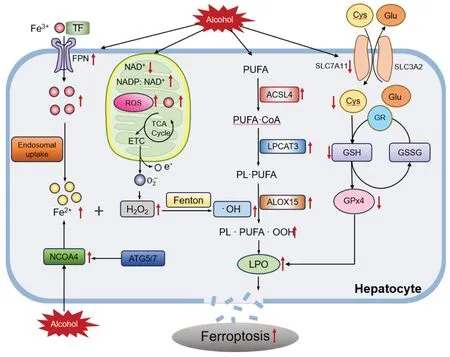
图1 酒精调控铁死亡的机制示意图
3 小结与展望
随着人们生活水平提高和饮酒的增加,ALD患病率日益增加,给肝脏甚至机体健康带来严重挑战,但目前为止临床尚无有效防治药物。探索ALD新机制对于寻找开发基于靶点且有效的临床药物具有重要意义。铁死亡是近年来新发现的一种细胞死亡形式,主要以铁离子依赖的脂质过氧化损伤为主要特点。酒精代谢引起的氧化应激早已被广泛报道,同时肝脏又是铁离子储存的主要器官,提示铁死亡很可能在ALD中扮演了重要角色。最近多项研究也证实了酒精能引起铁死亡,抑制铁死亡可改善ALD。多种干预策略包括提高抗氧化系统(如xCT、GSH和GPx4 等)活力,减少ROS 和LPO 的过度产生和积累,改善线粒体应激和呼吸功能,以及调控铁代谢蛋白等抑制异常铁摄取等,从而抑制铁死亡改善ALD。其中线粒体作为细胞产生ROS的主要位点,既是酒精损伤的靶点,也是激发铁死亡的起点,同时也是联系氧化抗氧化的重要枢纽,提示线粒体是未来调控铁死亡防治ALD的潜在靶点。此外,国内外对铁死亡的分子机制仍在不断探索中,许多新的调控铁死亡机制不断被发现,这也必将给ALD的铁死亡机制提供新的研究思路和线索。但目前对ALD不同阶段铁死亡的变化及机制知之尚少,酒精对铁死亡的具体调控机制研究相对有限,故进一步加强酒精诱导铁死亡具体机制的探究,寻找通过调控铁死亡防治ALD的潜在干预靶点,将成为今后ALD发生机制以及探索防治策略和药物研究的新方向。

