银耳二型态编码MAPK关键差异基因的克隆及生物信息学分析
徐涛 孔旭强 占观平 陈雅芳 曹继璇 李亚星 孙淑静
银耳二型态编码MAPK关键差异基因的克隆及生物信息学分析
徐涛 孔旭强 占观平 陈雅芳 曹继璇 李亚星 孙淑静*
(福建农林大学生命科学学院,福建 福州 350002)
银耳是我国特色的食用菌品种,其二型态转换与实际生产密切相关并制约着育种工作的进展,而丝裂原活化蛋白激酶(Mitogen activated protein kinase,MAPK)途径在真菌二型态转换中具有重要调控作用。根据转录组测序数据克隆了银耳二型态编码MAPK的关键差异基因,包括基因、基因和基因分析表明,、、基因的基因组DNA序列全长分别为1 721 bp、1 865 bp、1 903 bp,ORF序列全长分别为1 191 bp、1 281 bp、1 149 bp,分别含有10、12、16个内含子,编码396、426、382个氨基酸,相对分子质量在43.61 kDa~48.15 kDa间,理论等电点在5.82~6.89。序列同源性分析表明,、、基因所编码的氨基酸序列分别与中同源蛋白的相似性最高。结构域分析表明,TfFus3、TfSlt2、Kss1蛋白都具有典型的蛋白激酶保守结构域且同属于PKc_like super family。本研究结果为进一步探究MAPK信号通路在银耳二型态转换中的作用奠定了基础。
银耳;丝裂原活化蛋白激酶;二型态;生物信息学
银耳(Berk)隶属于真菌门、担子菌纲、银耳目、银耳科、银耳属,为我国久负盛名的食药用菌[1],素有“菌中之冠”的美称。银耳是典型的二型态真菌,具有酵母型和菌丝型2种生长阶段。其酵母型包括由担孢子芽殖生成的单核酵母状孢子和由双核菌丝或子实体在游离水过多、高温、机械刺激等不良条件下形成的双核酵母状孢子[2]。而其菌丝型则包括单核菌丝、双核菌丝和假菌丝3种类型[3]。具有不同极性的银耳担孢子可在和双因子控制的四极性交配型系统的控制下形成具锁状联合的双核菌丝[4],双核酵母状孢子也可在适宜条件下萌发形成双核菌丝和假菌丝。银耳酵母状孢子直接与香灰菌配对时萌发率低、很难形成白毛团,更无法获得子实体,而用银耳菌丝体与香灰菌配对时则可大大提高银耳的成品率,因此探究银耳酵母状孢子向菌丝转变的调控机制对今后银耳的育种工作及生产至关重要。
真菌二型态转变受外界环境因子和内部信号转导途径的影响,其中丝裂原活化蛋白激酶(Mitogen activated protein kinase,MAPK)信号通路在真核细胞中较为保守,与真菌二型态的转变密切相关[5]。1994年Liu等[6]最先发现MAPK途径在酿酒酵母()形态转化中有重要作用,后又发现该途径与白念珠菌()的二型态也有关。在模式真菌酿酒酵母中,MAPK信号通路主要包括由Fus3介导的信息素反应(pheromone response),Kss1介导的丝化和侵袭性生长(filamentation and invasive growth),Slt2介导的细胞壁完整性(cell wall integrity),Hog1介导的高渗透压应激反应(high-osmolarity stress response)[7]。、作为2个同源基因主要调控酿酒酵母有性生殖和菌丝生长过程[8]。新生隐球菌()的二型态转变一直被认为是一个依赖信息素的过程,其交配反应通过信息素受体级联反应介导,其中与酿酒酵母、分别具有52%和51%的相似性[9]。白念珠菌中与菌丝生长有关的MAPK通路为Cek1和Cek2信号转导通路,Cek1与Kss1同属一个家族,Cek2与Fus3有55%的相似性,其可恢复酿酒酵母Fus3/Kss1缺失菌株的交配缺陷[10]。此外,有研究发现白念珠菌中(同源基因)双敲除菌株无法在Spider培养基上形成侵袭性菌丝,而在酿酒酵母中过表达基因则可促进在氮饥饿条件下假菌丝的形成[11]。/同源基因在许多植物病原体中也同样起重要作用,禾谷镰刀菌()中同源基因的缺失会导致气生菌丝生长减少,减弱了对植株的侵染能力,并且它对于有性生殖过程中的雌性生殖能力是必不可少的[12]。玉米小斑病菌()中的和酿酒酵母()的氨基酸序列有59%的相似性。缺失突变体的气生菌丝发育不良,无附着孢,侵染能力严重降低,不产分生孢子,菌丝内部有自溶现象[13]。
银耳作为典型的二型态真菌可在酵母态与菌丝态之间相互转变,且一旦形成酵母状芽孢便很难形成菌丝。目前有关银耳二型态的研究多集中于外界环境条件上,对二者转变过程中的关键基因及其调节网络知之甚少。本课题组前期研究发现,银耳在二型态转变过程中MAPK信号通路中有多个基因出现了差异性表达,本研究根据银耳酵母状芽孢与菌丝体的转录组数据设计引物,对银耳二型态编码MAPK的关键差异基因、、进行克隆及生物信息学分析,为研究该通路在银耳二型态转变中的作用奠定基础。
1 材料与方法
1.1 材料
(1)供试菌株。银耳“绣银1号”,编号TWW01-AX,由福建农林大学生命科学学院特色食用菌品种创新与代谢工程团队选育并保存。
(2)供试培养基。PDA加富液体培养基:马铃薯200 g,葡萄糖20 g,蛋白胨3 g,酵母粉3 g,MgSO4·7H2O 1.5 g,KH2PO41.5 g,水1 L。
(3)试剂。Ezup柱式真菌基因组DNA抽提试剂盒、DEPC水、氨苄青霉素均购自生工生物工程(上海)股份有限公司;®DNA Polymerase、2K DNA Marker、Trans1-T1感受态细胞均购自北京全式金生物技术有限公司;TRIzol(Invitrogen);Prime Script®RT regent Kit With gDNA Eraser反转录试剂盒(TaKaRa); Hieff Clone® Zero TOPO-Blunt Simple Cloning Kit(上海翊圣生物科技有限公司);D2500 Gel Extraction Kit(OMEGA),其余试剂均为国产分析纯。
1.2 方法
(1)银耳基因组DNA的提取。将银耳酵母状芽孢接种于PDA加富液体培养基中,25 ℃、150 r/min培养7 d,12 000 r/min离心10 min收集菌体,根据Ezup 柱式真菌基因组 DNA 抽提试剂盒说明书提取基因组DNA。
(2)银耳总RNA的提取及cDNA合成。用Trizol法提取银耳酵母状芽孢总RNA并根据PrimeScript®RT regent Kit With gDNA Eraser反转录试剂盒说明书合成ORF模板。
(3)银耳二型态差异基因的克隆及测序。根据银耳酵母状芽孢与菌丝体转录组数据库中各基因在NR及KEGG数据库的注释结果,运用NCBI的ORFfinder功能搜寻MAPK信号通路中富集到的含有完整开放阅读框的各差异基因序列,用Primer Premier 6软件设计引物(表1)。分别以银耳基因组DNA及总ORF为模板,根据DNA Polymerase说明书设置各基因的PCR反应体系及程序(表2),并扩增各基因序列。PCR产物经1%琼脂糖凝胶电泳后,用D2500 Gel Extraction Kit试剂盒对目的片段进行回收纯化,连接至pESI-Blunt simple vector中并转入Trans1-T1感受态细胞,挑选阳性菌落,送生工生物工程(上海)股份有限公司进行测序。

表1 引物序列

表2 Hieff Canace® High-Fidelity DNA Polymerase PCR反应体系
注:基因组DNA 50 ng~200 ng,质粒DNA 10 pg~20 ng,cDNA 1~5 μL;PCR反应程序为98 ℃预变性3 min,98 ℃变性10 s,60 ℃退火20 s,72 ℃延伸(速度为30 s/kb),35个循环,72 ℃继续延伸5 min,4 ℃保存。
(4)差异基因的生物信息学分析。将克隆得到的各基因序列,通过在线网站(http://gsds.cbi. pku.edu.cn/index.php)绘制基因的结构图;采用ProtParam(http://www.expasy.org/)分析蛋白质的分子量大小、等电点等理化性质;利用Expasy在线服务器上的SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/ npsa_automat.pl?page=/NPSA/ npsa_sopma.html)分析蛋白质的二级结构;利用在线网站(https:// swissmodel.expasy.org/interactive)预测蛋白质的三级结构;蛋白质信号肽预测与分析采用SignalP(http://www.cbs.dtu.dk/services/SignalP/);蛋白质跨膜结构分析采用TMHMM程序(http://www.cbs.dtu.dk/services/TMHMM/);根据各基因的Blastp结果下载不同物种的同源蛋白序列,同时在NCBI搜索下载该基因酵母的蛋白序列。用ClustalX软件将上述蛋白质序列进行同源比对,参数为默认值,以同源比对数据为基础,采用MEGA7软件中的近邻法,Bootstrap值设置为1 000,其余参数为默认值,构建系统进化树。
2 结果与分析
2.1 TfFus3、TfSlt2、Kss1基因组DNA及ORF的扩增
分别以银耳酵母状芽孢基因组DNA及cDNA为模板,以引物-F、-R克隆银耳基因、以引物-F、-R克隆银耳基因、以引物-F、-R克隆银耳基因。cDNA扩增产物电泳结果(图1),扩增得到的基因组DNA序列全长1 721 bp,开放阅读框(ORF)序列全长1 191 bp;基因组DNA序列全长1 865 bp,ORF序列全长1 281 bp;基因组DNA序列全长1 903 bp,ORF序列全长1 149 bp。
2.2 TfFus3、TfSlt2、Kss1基因结构及蛋白质理化性质
基因测序结果(图2)显示,3个基因的基因组序列全长分别为1 721 bp、1 865 bp、1 903 bp,ORF全长分别为1 191 bp、1 281 bp、1 149 bp,分别含有10、12、16个内含子。其中,基因共编码396个氨基酸,分子式为C2030H3156N542O591S16,相对分子质量45.12 kDa,其中带负电荷的残基(Asp + Glu)49个,带正电荷的残基(Arg + Lys)48个,理论等电点为(pI)6.89,不稳定性系数45.09(>40)为不稳定蛋白,脂肪指数78.46,总平均亲水系数(GRAVY)− 0.352<0,推测该蛋白为亲水性蛋白,无信号肽及跨膜结构域。Blast结果显示,该基因编码的氨基酸序列与隐球菌属MAPK蛋白激酶相似性最高,为86.41%。基因共编码426个氨基酸,分子式为C2155H3331N595O623S19,相对分子质量48.15 kDa,其中带负电荷的残基(Asp + Glu)52个,带正电荷的残基(Arg + Lys)44个,理论等电点(pI)为6.06,不稳定性系数37.31(<40)为稳定蛋白,脂肪指数82.89,总平均亲水系数(GRAVY)− 0.344<0,推测该蛋白为亲水性蛋白,无跨膜结构域及信号肽。基因共编码382个氨基酸,分子式为C1953H3035N529O571S17,相对分子质量43.61 kDa,其中带负电荷的氨基酸残基(Asp + Glu)52个,带正电荷的氨基酸残基(Arg + Lys)43个,理论等电点为(pI)5.82,不稳定性系数38.03(<40),为稳定蛋白,脂肪指数为84.79,总平均亲水系数(GRAVY)− 0.358<0,推测该蛋白为亲水性蛋白。无信号肽,无跨膜螺旋区。Blast结果显示,该基因编码的氨基酸序列与黄金银耳丝裂原活化蛋白激酶相似性最高,一致性为82.4%。

图1 TfFus3、TfSlt2、Kss1基因ORF序列扩增结果

图2 TfFus3、TfSlt2、Kss1基因结构
2.3 TfFus3、TfSlt2、Kss1蛋白质结构预测
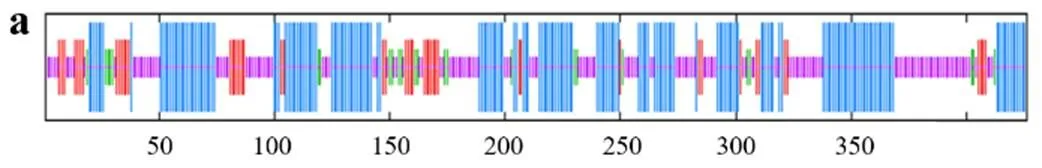
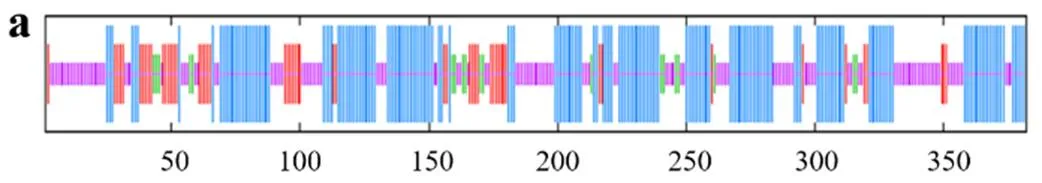
TfFus3蛋白质二级结构预测结果如图3a所示,该蛋白质主要由41.41%α-螺旋、13.13%延伸链、4.55%β-转角和40.91%无规则卷曲构成,分别由164个、52个、18个和162个氨基酸参与形成。TfFus3蛋白质三级结构预测结果如图3 b所示,该蛋白与模板2b9h.1.A一致性达54.89%,GMQE为0.73(可信度较好),QMEAN为− 2.04(与模板的匹配度较好),该模板蛋白为丝裂源活化蛋白激酶Fus3。
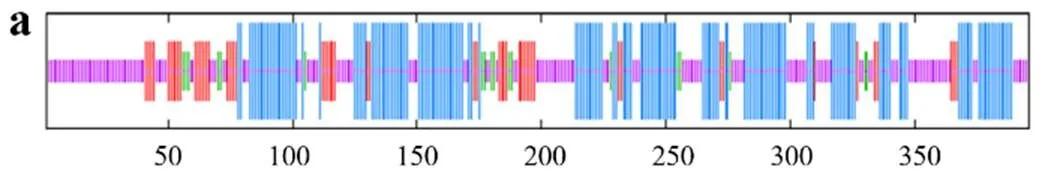
TfSlt2蛋白质二级结构预测结果如图4 a所示,其主要由43.9%α-螺旋、11.74%延伸链、5.87%β-转角和38.5%无规则卷曲构成,分别由187个、50个、25个和164个氨基酸参与形成。TfSlt2蛋白质三级结构预测结果如图4 b所示,该蛋白与模板5z33.1.A一致性达65.36%,GMQE为0.75(可信度较好),QMEAN为− 1.41(与模板的匹配度较好),该模板蛋白为丝裂源活化蛋白激酶Slt2。
Kss1蛋白质二级结构预测结果如图5 a所示,该蛋白质主要由46.34%α-螺旋、14.14%延伸链、4.97%β-转角和34.55%无规则卷曲构成,分别由177个、54个、19个、132个氨基酸参与形成。Kss1蛋白质三级结构预测结果如图5 b所示,该蛋白与模板2b9h.1.A一致性达54.49%,GMQE为0.71(可信度较好),QMEAN为− 2.41(与模板的匹配度较好),该模板为丝裂原活化蛋白激酶Kss1。
2.4 TfFus3、TfSlt2、Kss1蛋白保守结构域预测
TfFus3TfSlt2Kss1蛋白保守结构域预测结果如图6、7、8所示。TfFus3蛋白在第44~390位氨基酸间含有一个胞外信号调节激酶1和2样丝氨酸/苏氨酸激酶的催化结构域(STKc_ERK1_2_ like结构域),属于PKc蛋白超家族。该结构域主要是将ATP上的γ-磷酰基转移到蛋白质底物上的丝氨酸/苏氨酸残基上,该亚家族由丝裂原活化蛋白激酶(MAPK)ERK1、ERK2、酿酒酵母Fus3和类似蛋白质组成。TfSlt2蛋白在第21~358位氨基酸间含有一个真菌丝裂原活化蛋白激酶MPK1结构域(STKc_MPK1),属于PKc_like超家族。同样催化将γ-磷酰基从ATP转移到蛋白质底物上的丝氨酸/苏氨酸残基上,该亚家族由酿酒酵母的MPK1、粟酒裂殖酵母()的Pmk1和相似的蛋白质组成。Kss1蛋白在第32~375位氨基酸间含有一个细胞外信号调节激酶1和2类丝氨酸/苏氨酸激酶的催化结构域(STKc_ERK1_2_like),属于PKc_like超家族。STK催化γ-磷酰基从ATP转移到蛋白质底物上的丝氨酸/苏氨酸残基,这个亚家族由丝裂原活化蛋白激酶(MAPKs)ERK1、ERK2、酿酒酵母Fus3和类似的蛋白质组成。

图6 TfFus3蛋白保守结构域预测结果

图7 TfSlt2蛋白保守结构域预测结果

图8 Kss1蛋白保守结构域预测结果
2.5 TfFus3、TfSlt2、Kss1蛋白系统进化分析
(1)TfFus3蛋白系统进化分析。用ClustalX2及MEGA7软件将TfFus3蛋白与酿酒酵母中已知的相关蛋白进行同源性比对,结果显示该蛋白与酵母中的Fus3蛋白聚为一支(图9)。

图9 TfFus3蛋白与酿酒酵母(Saccharomyces cerevisiae)中相关蛋白序列同源比对结果
TfFus3蛋白系统进化分析如图10所示,银耳TfFus3蛋白与、、隐球酵母菌属的新型隐球酵母()、盖替隐球酵母()、亲缘关系较近。而与角状胶角耳()、草菇(、毛韧革菌()、斑玉蕈()、灰树花()等担子菌亲缘关系次之,与白地霉()、黑曲霉()酿酒酵母()等子囊菌亲缘性较远。
(2)TfSlt2蛋白系统进化分析。用ClustalX2及MEGA7软件对TfSlt2蛋白与酿酒酵母中已知的相关蛋白进行同源性比对,结果显示该蛋白与酵母中的Slt2蛋白聚为一支(图11)。
TfSlt2蛋白系统进化分析如图12所示,银耳TfSlt2蛋白序列与亲缘关系最近,并与、新型隐球酵母()、盖替隐球酵母()聚为一类。而与立枯丝核菌()、胶角耳()、、陶兰柱担菌()、绒毛栓菌()、玉米黑粉菌()等担子菌亲缘关系次之,与黑酵母菌()酿酒酵母()、核盘菌()等子囊菌亲缘性较远。

图10 TfFus3蛋白系统进化树
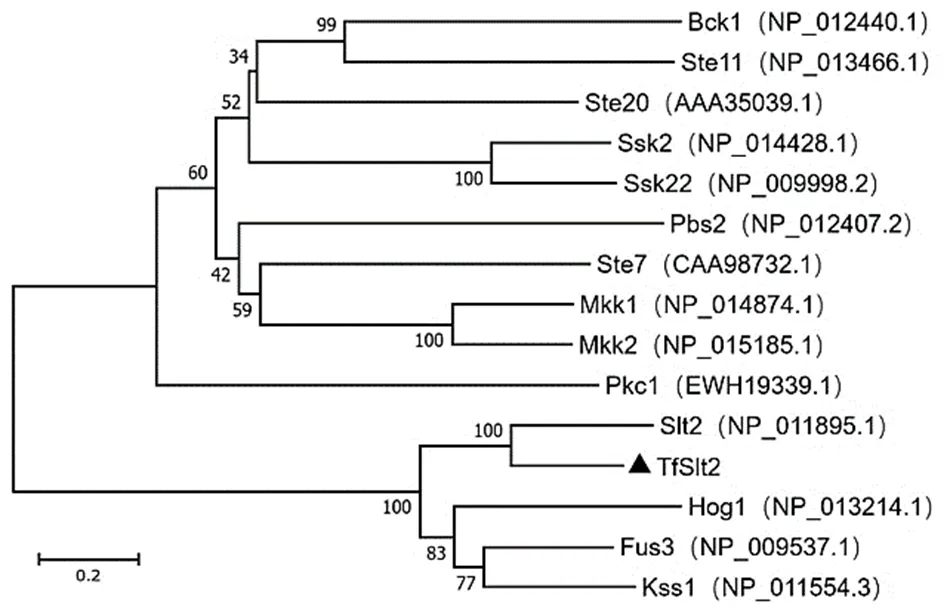
图11 TfSlt2蛋白与酿酒酵母(Saccharomyces cerevisiae)中相关蛋白序列同源比对结果
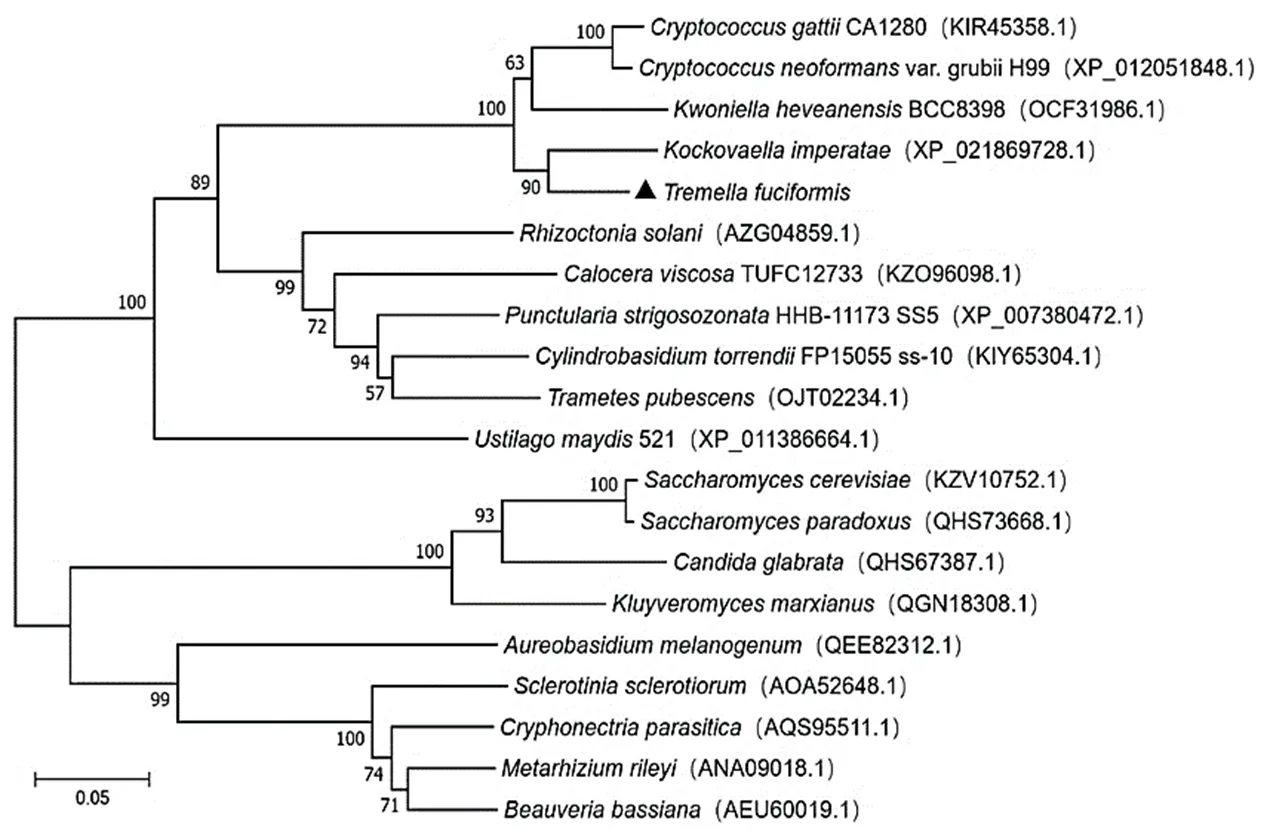
图12 TfSlt2蛋白系统进化树
(3)Kss1蛋白系统进化分析。用ClustalX2及MEGA7软件将银耳Kss1蛋白与酿酒酵母中已知的相关蛋白质进行同源性比对,结果显示该蛋白与酿酒酵母中的Kss1蛋白聚为一个分支(图13)。
Kss1蛋白系统进化如图14所示,银耳Kss1蛋白与亲缘关系最近,与、、、、、、的亲缘关系次之,与酿酒酵母()、光滑念珠菌()亲缘关系较远。
3 讨论
在真核生物中,异三聚体G蛋白可介导Ca2+、cAMP 和 MAPK 3条信号转导途径将胞外环境信号传递到细胞内[14]。在MAPK信号通路中主要通过交配信息素途径介导两单倍体的交配反应[15]。当交配信息素与相应的受体结合后激活Gα亚基使GDP转变为GTP,此时Gαβγ三聚体解离为Gα和Gβγ复合体,他们分别通过cAMP、MAPK信号转导途径将信号传递至下游的效应分子调节相应的细胞活动[16]。G蛋白继续通过支架蛋白将信号传递至MAPK信号通路中,再经MAPKKK-MAPKK-MAPK三级磷酸化过程最终将信号传递至TfFus3从而使酿酒酵母的单倍体细胞发生交配反应,除此之外该通路还与菌丝生长、孢子生成、致病性有关[17]。

图13 Kss1蛋白与酿酒酵母(Saccharomyces cerevisiae)中相关蛋白序列同源比对结果
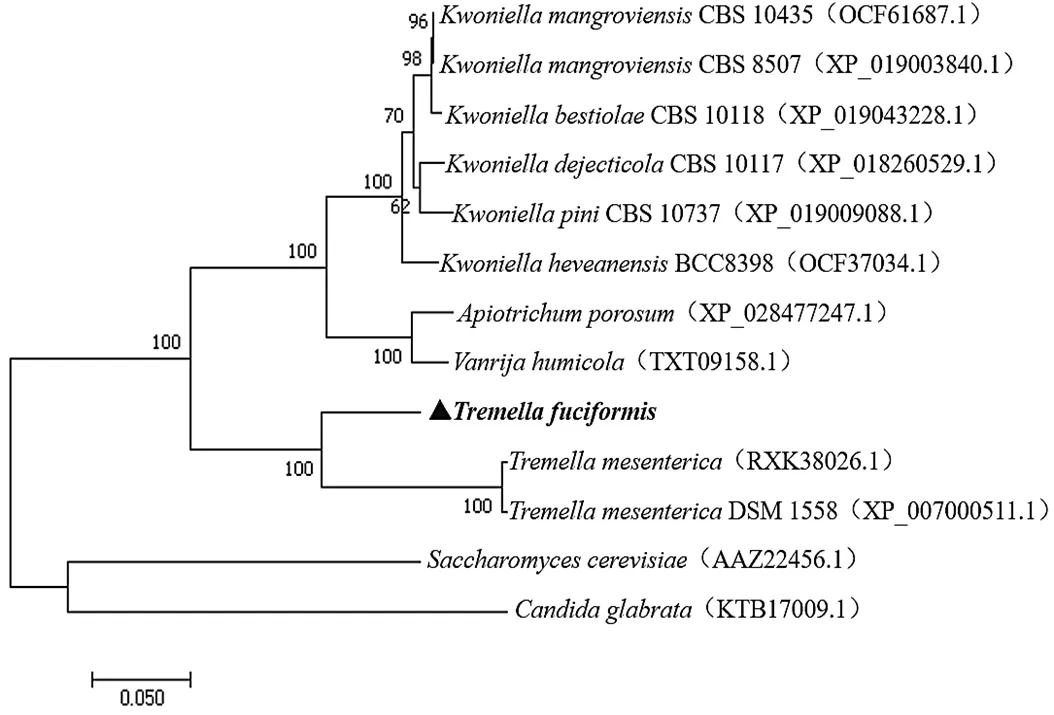
图14 Kss1蛋白系统进化树
银耳酵母状芽孢在非适宜条件下,往往通过芽殖、裂殖的方式进行无性增殖,当其向菌丝态转变时与白念珠菌侵染宿主的过程类似,即首先会在一端形成芽管,芽管不断伸长后成为菌丝,在这一过程中细胞以单一或特定的方向进行生长延伸,称为细胞的极性生长[18]。酵母中极性生长主要发生在三个时期:酵母细胞极性位点的选择、酵母细胞向菌丝的转变过程、两单倍体细胞的接合生长[19]。菌丝顶端这种高度极性生长的方式依赖于内质网的功能及细胞壁的有序合成及重塑[20]。研究发现,白念珠菌中同源基因敲除后与野生型相比其在42 ℃条件下培养时生长速率降低,且对热敏感。在高Ca2+浓度、高渗透压条件下突变体菌落变得光滑,菌丝生长受到抑制[21]。同时Slt2对球孢白僵菌、的毒力、侵袭性生长至关重要[22-23]。
在酿酒酵母中,有5条分别调控高渗环境生长的逆境反应、交配反应、菌丝生长、细胞壁完整性和孢子形成的MAPK途径已被鉴定研究[24-26]。MAPKK是MAPK三级级联信号途径的中间蛋白,其高度保守的SxxxS/T位点受上一级双特异性MAPKKK的双重磷酸化诱导激活,其中Fus3和Kss1受同一个MAPKK蛋白的激活,共同调控交配反应和菌丝生长[23]。所以克隆基因有助于研究银耳二型态转变的关键基因。分析结果显示,银耳基因与酿酒酵母中的基因具有高度同源性,银耳Kss1蛋白与亲缘关系最近,本研究结合银耳不同形态下的基因表达差异分析,发现基因在菌丝形态中相较酵母形态上调表达。推测基因可能在银耳菌丝形成过程中起正调控作用。
4 结论
将获得的银耳酵母状芽孢及菌丝体的转录组数据,通过NR注释、KEGG富集后查找含有完整开放阅读框的差异基因序列。克隆并分析了编码丝裂原活化蛋白激酶的基因、和。
序列分析发现,基因组序列全长1 721 bp,ORF全长1 191 bp,含有10个内含子,共编码396个氨基酸,含有丝氨酸/苏氨酸激酶催化结构域(STKc_ERK1_2_like结构域),与、、新型隐球酵母、盖替隐球酵母的丝裂原活化蛋白激酶编码基因亲缘关系最近。基因组序列全长1 865 bp,ORF全长1 281 bp,含有12个内含子,共编码426个氨基酸,含有丝裂原活化蛋白激酶MPK1结构域(STKc_MPK1),与亲缘关系最近,并与、新型隐球酵母、盖替隐球酵母聚为一类。基因基因组序列全长1 903 bp,ORF全长1 149 bp,包含16个内含子,共编码382个氨基酸,含有丝氨酸/苏氨酸激酶的催化结构域(STKc_ERK1_2_like),与亲缘关系最近。
[1] 彭卫红, 王勇, 黄忠乾, 等. 我国银耳研究现状与存在问题[J]. 食用菌学报, 2005, 12(1) : 51-56.
[2] 孙淑静. 画说银耳优质高效生产技术[M]. 北京: 中国农业科学技术出版社, 2020: 10-11.
[3] 朱季红. 群体效应因子影响银耳二型态转变的研究[D]. 武汉: 华中农业大学, 2015: 7.
[4] 陈明, 陈立国, 汪国莲. 银耳极性测定的初步研究[J]. 华中农业大学学报, 2000, 19(2): 138-141.
[5] 胡鹏, 张雅芬, 崔海峰, 等. 菰黑粉菌MAPKK同源基因UeMkk1的全长克隆及表达[J]. 农业生物技术学报, 2016, 24(3): 406-415.
[6] LIU H, KOHLER J, FINK G R. Suppression of hyphal formation inby mutation of ahomolog[J]. Science, 1994, 266(5191): 1723-1726.
[7] CHEN R E, THORNER J. Function and regulation in MAPK signaling pathways: lessons learned from the yeast[J]. Biochim Biophys Acta, 2007, 1773(8) : 1311-1340.
[8] 陈江野, 陈曦. 酵母交配过程的极性生长及其调控机制[J]. 生命科学, 2002(3): 159-162.
[9] 张科贵, 何光军. 新生隐球菌细胞通讯研究进展[J]. 微生物学通报, 2020, 47(1): 272-281.
[10] 陈静, 王勤, 陈江野., 一个白色念珠菌新的能互补fus/kss突变株的交配缺陷[J]. 生物化学和生物物理学报, 2000, 32(3) : 299-304.
[11] NAVARRO-GARCIA F, Alonso-Monge R, Rico H, et al. A role for the MAP kinase genein cell wall construction and morphological transitions in[J]. Microbiology, 1998, 144 (2): 411-424.
[12] HOU Z, XUE C, PENG Y, et al. A mitogen-activated protein kinase gene () inis required for female fertility, heterokaryon formation, and plant infection [J]. Molecular Plant-Microbe Interactions®, 2002, 15(11): 1119-1127.
[13] LEV S, SHARON A, HADAR R,. A mitogen-activated protein kinase of the corn leaf pathogenis involved in conidiation, appressorium formation, and pathogenicity: diverse roles for mitogen-activated protein kinase homologs in foliar pathogens[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(23): 13542-13547.
[14] NEVES S R, RAM P T, IYENGAR R. G protein pathways [J]. Science, 2002, 296(5573): 1636-1639.
[15] 张海峰. 稻瘟病菌G蛋白及MAPK信号途径相关基因的功能分析[D]. 南京: 南京农业大学, 2011: 1-3.
[16] 刘娟, 吴尧, 马爱民, 等. 真菌二型态环境因子及信号转导途径研究进展[J]. 微生物学通报, 2008, 35(7): 1102-1106.
[17] 彭静静. 植物病原真菌中MAPK级联通路研究进展[J]. 江苏农业科学, 2014, 42(9) : 11-15.
[18] GOW N A R, VAN DE VEERDONK F L, BROWN A J, et al.morphogenesis and host defence: discriminating invasion from colonization[J]. Nature Reviews Microbiology, 2013, 10(2): 112-122.
[19] PRUYNE D, BRETSCHER A. Polarization of cell growth in yeast[J]. Journal of Cell Science, 2000, 113 (Pt 4): 571-585.
[20] 张冰. 白念珠菌Sac1蛋白的鉴定及其功能的研究[D]. 天津: 南开大学, 2015: 79-82.
[21] NAVARRO-GARCIA F, Sánchez M, PLA J. Functional characterization of thegene of, which encodes a mitogen-activated protein kinase homolog related to cell integrity[J]. Molecular and Cellular Biology, 1995, 15(4): 2197-2206.
[22] LUOP X, KEYHANI N O, YU X, et al. The MAP kinase Bbslt2 controls growth, conidiation, cell wall integrity, and virulence in the insect pathogenic fungus[J]. Fungal Genetics and Biology, 2012, 49(7): 544-555.
[23] ONYILO F, TUSIIME G, TRIPATHI J N, et al. Silencing of the mitogen-activated protein kinases (MAPK)andinreduces growth and virulence on host plants[J]. Frontiers in Plant Science, 2018, 9: 291.
[24] ZHAO X, MEHRABI R, XU J R. Mitogen-activated protein kinase pathways and fungal pathogenesis [J]. Eukaryot Cell, 2007, 6(10): 1701-1714.
[25] GUSTIN M C, ALBERTYN J, ALEXANDER M, et al. MAP kinase pathways in the yeast[J]. Microbiology and Molecular Biology Reviews, 1998, 62(4): 1264-1300.
[26] HERSKOWITZ I. MAP kinase pathways in yeast: for mating and more[J]. Cell, 1995, 80(2): 187-197.
Cloning and bioinformatics analysis of key differential-expression genes encoding MAPK indiformis
XU Tao KONG Xuqiang ZHAN Guanping CHEN Yafang CAO Jixuan LI Yaxing SUN Shujing*
(College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
is a characteristic edible fungus in China. The diformis transformation is closely related to the actual production and restricts the progress of breeding. Mitogen activated protein kinase (MAPK) pathway plays an important role in the regulation of diformis transformation. Based on transcriptome sequencing data, key differential-expression genes encoding MAPK indiformis were cloned, includinggene,gene andgene. Analysis showed that the total length of genomic DNA sequence of,andgenes was 1 721 bp, 1 865 bp and 1 903 bp, and the total length of ORF sequence was 1 191 bp, 1 281 bp and 1 149 bp, containing 10, 12 and 16 introns, respectively. Coding 396, 426, 382 amino acids, the molecular weight ranging from 43.61 kDa to 48.15 kDa, the theoretical isoelectric point between 5.82 and 6.89. Sequence homology analysis showed that the amino acid sequences encoded by,andwere the most similar to homologous proteins in,and, respectively. Domain analysis showed that TfFus3, TfSlt2 and Kss1 all had typical conserved kinase domains and belonged to PKc_like super family. The results of this study laid a foundation for further exploring the role of MAPK signaling pathway in tremella dimorphism transformation.
; Mitogen activated protein kinase; dimorphic; bioinformatics
S646
A
2095-0934(2024)01-031-09
国家自然科学基金青年科学基金项目(31801556);福建省种业工程特色食用菌育种与产业化开发(zycxny2021011);福建省食用菌现代农业产业体系
徐涛(2003—),男,在读本科生,研究方向为食药用真菌学。E-mail:2071463989@qq.com。
孙淑静(1978—),女,博士,教授,主要从事食药用真菌学研究。E-mail:shjsun2004@126.com。

