甘蔗与斑茅杂交染色体组构成特征研究
薛 丽 李心怡 黄勇泰 欧财篮 吴小青 余泽怀 崔泽田张木清 邓祖湖 余 凡,*
1 亚热带农业生物资源保护与利用国家重点实验室 / 广西甘蔗生物学重点实验室/广西大学农学院, 广西南宁 530004; 2 福建农林大学农学院国家甘蔗工程技术研究中心, 福建福州 350002
甘蔗(Saccharumspp.)作为最重要的糖料作物以及可再生能源作物[1], 可为全球提供约80%的食用糖产量。甘蔗病害是目前导致其产量损失的重要因素之一, 因此导入近缘野生种质血缘提高甘蔗抗性是育种家们努力的目标[2]。近几十年来, 甘蔗的近缘属种植物逐渐受到了甘蔗育种家们的关注, 河八王属(Narenga)、蔗茅属(Erianthus)、芒属(Miscanthus)等成为拓宽甘蔗遗传基础的重要种质资源[3]。其中,斑茅(Tripidiumarundinaceum)因具有生长旺盛, 抗旱耐贫, 抗病好, 抗虫性强, 适应性广, 宿根性强等优异性状获得了国内外学者的亲睐[4]。育种者们期望通过引入野生种质资源斑茅的优良性状对甘蔗进行遗传改良, 将优良的基因引入甘蔗以获得抗逆、高产、高糖的优良品种[5]。
由于甘蔗细胞的多倍性和异质性, 基因组庞大,染色体数目多等特点[6-7], 使甘蔗的分子细胞遗传学方面的研究受到了一定阻碍, 特别是在染色体构成及遗传机制方面未有重大突破。而在甘蔗的远缘杂交过程中, 双亲的染色体在后代材料中的传递方式复杂, 荧光原位杂交技术逐渐成为揭示甘蔗杂交后代亲本染色体遗传的有效手段[8]。甘蔗属间杂种的细胞学研究表明, 甘蔗远缘杂交后代染色体遗传具有n+n、2n+n、n+2n等多种复杂的传递方式[9-14], 这种配子数目常有增减的现象被称为“不平衡遗传”。Li 等[15]应用FISH 技术观察到甘蔗与斑茅杂交F1在减数分裂过程中存在染色体滞后、不同步、微核、不能形成细胞板等多种异常现象。Piperidis 等[16]试验结果表明斑茅甘蔗BC1染色体遗传为2n+n。但Wu 等[17]研究表明, 甘蔗与斑茅杂交BC1后代不止存在2n+n的遗传方式, 还出现超2n+n的染色体传递现象。陈健文等[18]利用 GISH (genomic in situ hybridization, GISH)技术对来自崖城96-40 × CP84-1198 组合的后代进行鉴定, 后代中来自斑茅的染色体从BC1到BC2的染色体传递也基本符合n+n方式。Huang 等[19]研究甘蔗与斑茅杂交后代染色体的遗传方式时, 结果显示BC2和BC3代染色体传递基本符合n+n遗传, 但部分后代斑茅染色体发生丢失, 除此之外还发现了斑茅与甘蔗杂交后代发生了可遗传的易位现象。因此, 甘蔗与斑茅不同杂交后代的染色体组结构特征具有明显差异, 进一步研究不同杂交组合高世代的斑茅染色体组组成对于分析不同数量的斑茅染色体对农艺性状的表现具有重要意义。
由于不同野生近缘属血缘的渗入, 加大了甘蔗与斑茅杂交后代组成鉴定分析的难度。利用特异重复序列和基因组探针的FISH (Fluorescence in situ hybridization, FISH)技术成为了高效区分甘蔗远缘杂交后代中染色体组结构特征的有效工具。本研究应用斑茅特异性引物和特异的FISH 探针, 对甘蔗与斑茅杂交高世代材料快速进行了真实性鉴定并分析了其染色体组的结构特征, 为今后进一步揭示斑茅的染色体对甘蔗抗性表型贡献奠定了细胞遗传学基础, 为高效利用斑茅种质资源提供了参考。
1 材料与方法
1.1 试验材料
取用斑茅原始种海南92-77 (2n= 6x= 60), 甘蔗热带种拔地拉 (2n= 8x= 80), 甘蔗割手密种Np-X (2n= 4x= 40), 甘蔗栽培种柳城05-136 (母本,♀)与前课题组创制斑茅与甘蔗杂交无性系BC3材料崖城05-164 (父本, ♂)及第89 批次杂交后代组合BC4材料(89 组合)为研究对象, 所有材料均保育在广西大学扶绥农科新城甘蔗研究基地(图1 和表1)。
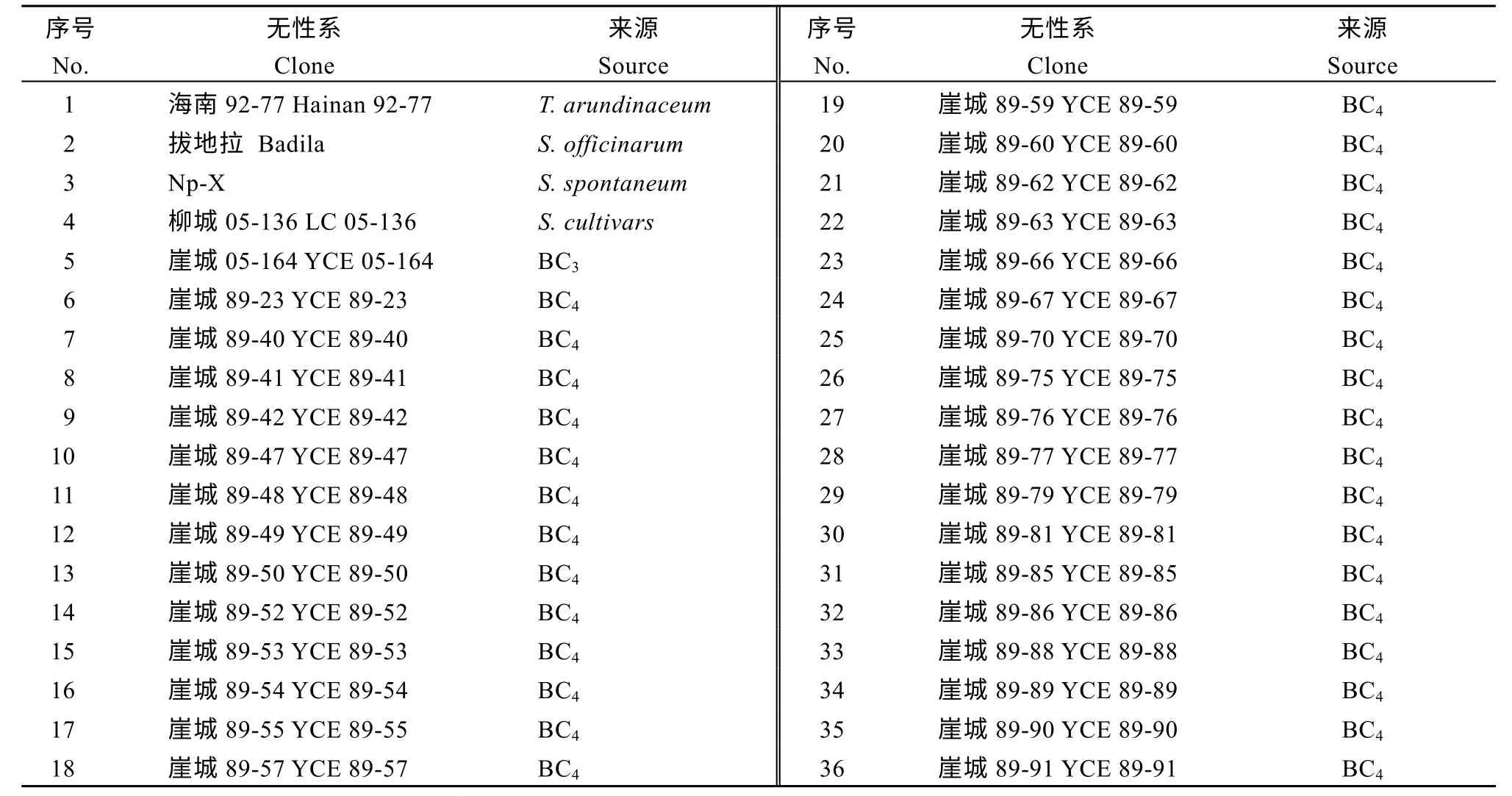
表1 供试材料Table 1 Experimental materials in this study

图1 甘蔗与斑茅杂交系谱图Fig. 1 Hybridized pedigree chart between sugarcane and T.arundinaceum
1.2 试验方法
1.2.1 基因组DNA 提取及杂交后代真实性分子鉴定 参考Mace 等[20]改良的CTAB 法提取供试材料叶片的基因组DNA。以斑茅杂交后代材料DNA 为模板, 经过已开发设计的1 对斑茅物种特异重复序列分子标记引物(AGRP-52 和AGRP-53)扩增出含有斑茅血缘的目的条带[21]。反应总体系为10 μL, 包括50 ng μL-1基因组DNA 1 μL, 2×RapidTaqMaster Mix 5 μL, 上、下游引物(10 µmol L-1)各1 μL, ddH2O 2 μL。扩增程序: 95℃预变性3 min; 95℃变性30 s, 52℃退火20 s, 72℃延伸20 s, 32 个循环; 72℃终延伸3 min。
1.2.2 根尖细胞培养与染色体制片 中期染色体制片参考Braz 等[22]和Yu 等[23]研究方法, 截取适当蔗节在营养土中进行培根, 剪取约1 cm 健壮根尖于对二氯苯-α-溴代萘溶液中避光处理2.5~3 h, 再用无水乙醇和冰醋酸(3∶1)溶液固定过夜, 固定后可用75%酒精保存。处理后的根尖用刀片切成薄厚均匀的小块, 再使用适量的果胶酶和纤维素酶制备成混合液在37℃恒温箱酶解去除细胞壁4 h, 吸去酶液后用现配的固定液反复吸打成细胞悬液, 最后吸取适量细胞悬液均匀涂抹在载玻片上制备成中期玻片。
1.2.3 探针制备 采用CTAB 法提取的斑茅原始种海南92-77 (2n= 6x= 60)基因组, 使用缺口平移法以斑茅基因组 DNA 为模板与酶切混合溶液在15℃酶切2 h 40 min, 将基因组序列酶切至大小约200~600 bp (表2)。割手密特异重复序列探针参考Huang 已发表的引物序列进行克隆, 将提取的质粒采用缺口平移法进行制备[24](表2)。

表2 基因组探针制备体系Table 2 Genomic probe preparation system
1.2.4 荧光原位杂交及数据分析 每个编号材料选取3~5 个形态完整良好的中期细胞进行FISH, 具体方法参考Meng 等[25], 略微修改。杂交前先用HCl(0.01 mol L-1)和胃蛋白酶 (10 μg mL-1) (99 ∶1)处理1 h 30 min, 用2×SSC 清洗, 3×3 min; 用100 µL 的4%多聚甲醛固定形态5 min, 1×PBS 清洗, 3×3 min;清水洗净晾干, 依次用75%、100%酒精脱水3 min后晾干; 接着用70%甲酰胺(FD)于70℃变性1 min 40 s; 加热后依次转置-20℃的70%酒精、95%酒精、100%酒精内浸泡 4 min; 晾干后加入杂交液含有5 µL FD、2 µL 50% DS、1 µL 20×SSC、1 µL 基因组探针, 盖上盖玻片, 37℃温育过夜。杂交后室温2×SSC、42℃预热的2×SSC 和室温1×PBS 分别漂洗5 min、10 min 和3 min, 漂洗结束后用清水润洗, 风干; 最后滴加10 µL DAPI, 盖上盖玻片, 后于奥林巴斯BX53 正置荧光显微镜(https://om-digitalsolutions.cn/)下观察。捕获到的信号通过ImageJ (https://imagej.net/ij/)和Photoshop CS6 (https://www.adobe.com/cn/products/photoshop.html)处理。热带种、割手密及重组血缘的判定参考Huang 等[24]和Wang 等[26]的方法,具有完整或着丝粒区域明显分布割手密特异重复序列信号的判定为割手密染色体, 具有完整或着丝粒区域分布斑茅基因组杂交信号的染色体判定为斑茅染色体; 未分布割手密、斑茅杂交信号判定为热带种染色体, 含有割手密特异重复序列、斑茅基因组杂交信号但不包含着丝粒区域的判定为重组染色体。
2 结果与分析
2.1 亲本染色体构成分析
对亲本染色体构成进行鉴定能够更好的探究在甘蔗与斑茅远缘杂交中斑茅染色体的遗传特征。本试验通过斑茅基因组探针与割手密特异探针对父本材料YCE05-164 与母本材料LC05-136 进行染色体分型。结果表明, 在YCE05-164 中, 具有斑茅染色体15 条, 占全基因组的13.04%, 而母本LC05-136未携带斑茅染色体(图2-a)。进一步统计了YCE05-164 中热带种血缘, 割手密血缘与重组血缘占比分别为64.35%、12.17%和10.43% (图2-b); 而LC05-136中, 热带种血缘占比为63.89%, 割手密血缘占比为15.74%, 两者间的染色体重组占比为20.37% (图2-a)。
图2 崖城05-164 和柳城05-136 的染色体组成鉴定Fig. 2 Identification of chromosomal composition of YCE 05-164 and LC 05-136
2.2 斑茅特异引物鉴定甘蔗与斑茅杂交后代材料的真实性
为快速鉴定得到甘蔗与斑茅杂交真实后代材料,利用斑茅的特异重复序列引物 A G R P-5 2 和AGRP-53 对31 份后代材料进行初步鉴定。1.5%的凝胶电泳结果显示(图3), 利用特异引物可对含斑茅血缘的材料扩增出约350 bp 的特异条带, 而热带种Badila、割手密Np-X、LC 05-136 均检测不出条带,说明该引物对检测斑茅血缘材料具有可靠性。泳道31 为YCE89-66 编号材料, 分子标记初步鉴定其为假的斑茅后代, 结合GISH 结果最终确定为假种, 其余材料均为真种, 真实率为96.77%。
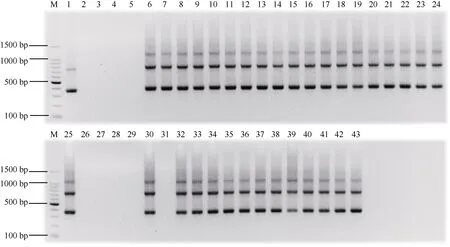
图3 甘蔗与斑茅BC4 杂交后代PCR 产物电泳检测Fig. 3 Electrophoretic detection of PCR products of the BC4 hybrid between sugarcane and T. arundinaceum
2.3 甘蔗与斑茅杂交后代GISH 鉴定
使用制备的斑茅基因组探针对31 份BC4材料进行GISH 鉴定分析发现, 杂交后代中30 份材料为甘蔗与斑茅的真实杂交后代, 均含有斑茅染色体, 与PCR 鉴定结果一致。此外, 30 份甘蔗与斑茅杂交后代中斑茅染色体数目具有明显差异, 根据斑茅染色体数目可分为6 种类型, 分别为6 条斑茅(图4); 7 条斑茅(图5); 8 条斑茅(图6); 9 条斑茅(图7); 1、10 条斑茅染色体(图8); 未含斑茅染色体材料结果与分子标记鉴定一致(图8-c)。
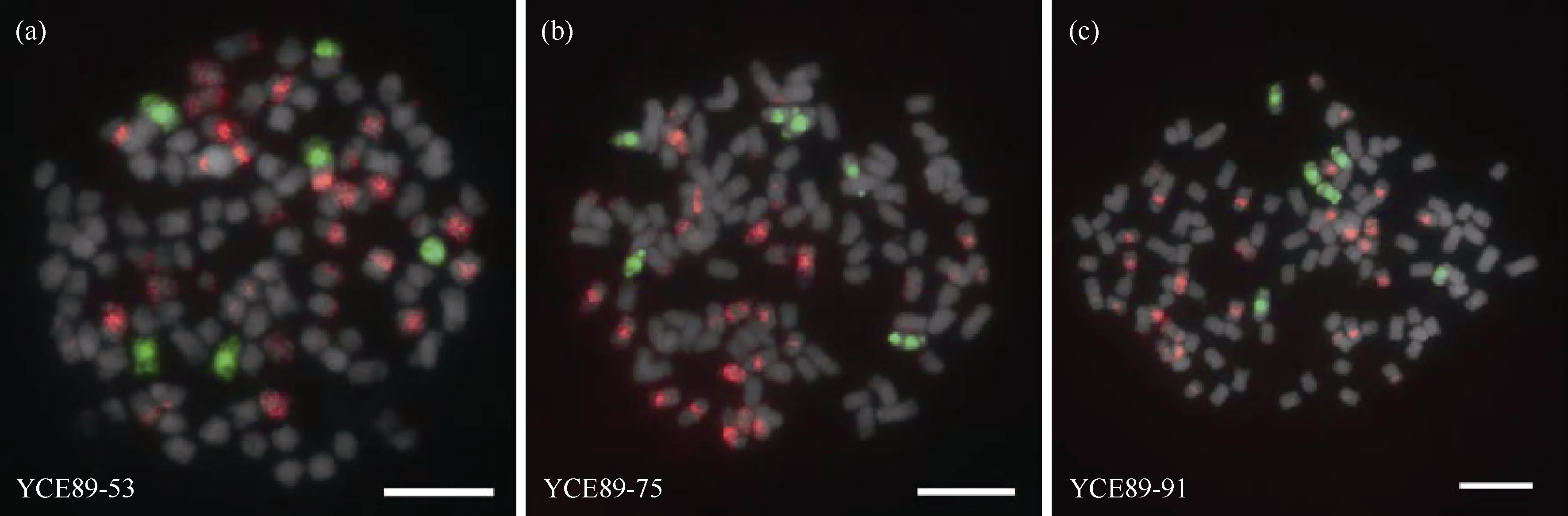
图4 甘蔗与斑茅杂交后代中包含6 条斑茅染色体Fig. 4 Hybrid between sugarcane and T. arundinaceum contained six chromosomes of T. arundinaceum
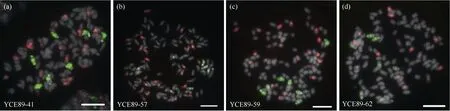
(图5)

图6 含8 条斑茅染色体的杂交后代Fig. 6 Hybrid between sugarcane and T. arundinaceum contained eight chromosomes of T. arundinaceum

(图7)

图8 含0、1 和10 条斑茅染色体的杂交后代Fig. 8 Hybrid between sugarcane and T. arundinaceum contained zero, one, and ten T. arundinaceum chromosomes
2.4 甘蔗与斑茅杂交后代遗传与结构分析
2.4.1 甘蔗与斑茅杂交后代群体染色体遗传分析
我们感兴趣的是, 斑茅染色体传递给后代的遗传特征。为此, 本研究对甘蔗与斑茅杂交后代群体进行了斑茅染色体遗传统计(图9)。通常情况下, 配子体一半的遗传物质源自于母本, 一半源自于父本。根据上述结果可知, LC05-136 作为母本未携带斑茅染色体, 表明其后代的斑茅染色体均来自于父本YCE05-164。其中, 父本YCE05-164 携带的15条斑茅染色体以7 条和8 条2 种均等分离的遗传类型进行向后代传递的比例占该群体的60.00%。在以非均等分离方式传递斑茅染色体, 后代继承父本斑茅染色体数目主要为6 条和9 条2 种类型, 占整个群体的33.33%, 而1 条和10 条斑茅染色体两种遗传类型在群体中各占3.33% (图10-a)。表明, 尽管在后代斑茅染色体遗传数目存在大量的分离, 但在对子代传递的斑茅染色体主要服从n+n的遗传方式。

图9 甘蔗与斑茅杂交后代BC4 群体斑茅染色体遗传图谱Fig. 9 Chromosome genetic mapping of T. arundinaceum from the BC4 population between sugarcane and T. arundinaceum
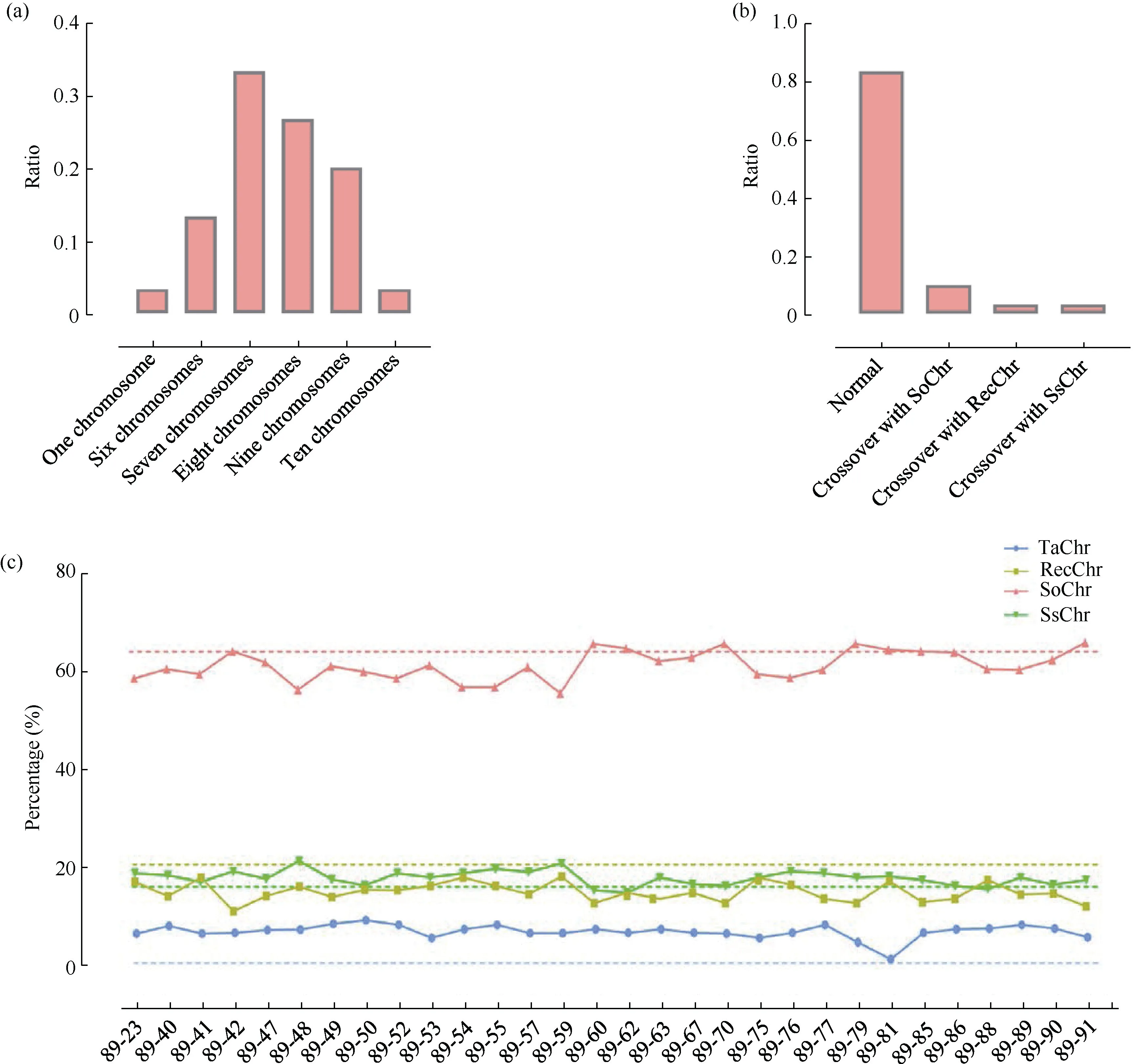
图10 甘蔗与斑茅真实杂交后代染色体遗传特征Fig. 10 Chromosomal genetic characteristics of the true progenies between sugarcane and T. arundinaceum
2.4.2 甘蔗与斑茅杂交后代群体染色体结构分析
利用远缘杂交将野生种质的优良抗性导入作物内, 这一过程中基因之间交流与重组的程度是决定品种种质的关键。为了进一步探究斑茅染色体与甘蔗之间的重组特征与规律, 基于上述结果对完整斑茅的染色体、斑茅与甘蔗染色体重组进行统计(图10-b)。结果表明, 在30 份真实后代群体中, 斑茅与甘蔗染色体出现易位的概率为16.67% (图10-b)。其中, 有3 份材料出现斑茅染色体与热带种染色体易位, 1 份材料出现斑茅与热带种割手密重组染色体易位, 1 份材料出现斑茅与割手密染色体重组(图9和图11)。斑茅与三者染色体发生易位的材料数目比例为3∶1∶1 (图11), 这基本与近现代栽培甘蔗的血缘占比一致, 表明斑茅染色体与甘蔗不同血缘的染色体发生易位重组的概率基本相同。
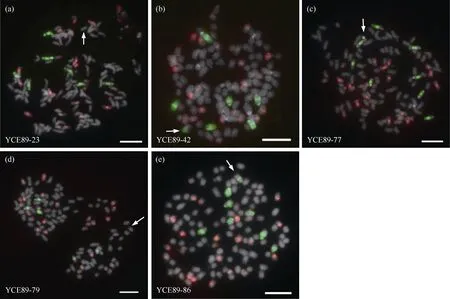
图11 甘蔗斑茅杂交后代群体材料中鉴定的染色体易位Fig. 11 Chromosomal translocations identified in population from the progeny between sugarcane and T. arundinaceum
2.4.3 甘蔗与斑茅杂交后代群体血缘结构分析
以母本LC05-136 为参考, 统计后代群体的血缘结构, 并比较各个基因型与亲本的差异(表3)。结果表明, 群体热带种血缘占比介于55.36%~65.77%之间, 相较于母本, 整体降低; 重组血缘(热带种与割手密重组), 平均为 14.71%, 相较于母本的重组率占比降低 5.66%; 割手密占比介于 14.55%~21.05%, 平均为17.59% (图10-c), 相较母本和父本显著增加。说明当斑茅染色体导入近现代栽培甘蔗中, 其热带种血缘与重组血缘下调, 而割手密血缘有所提高。
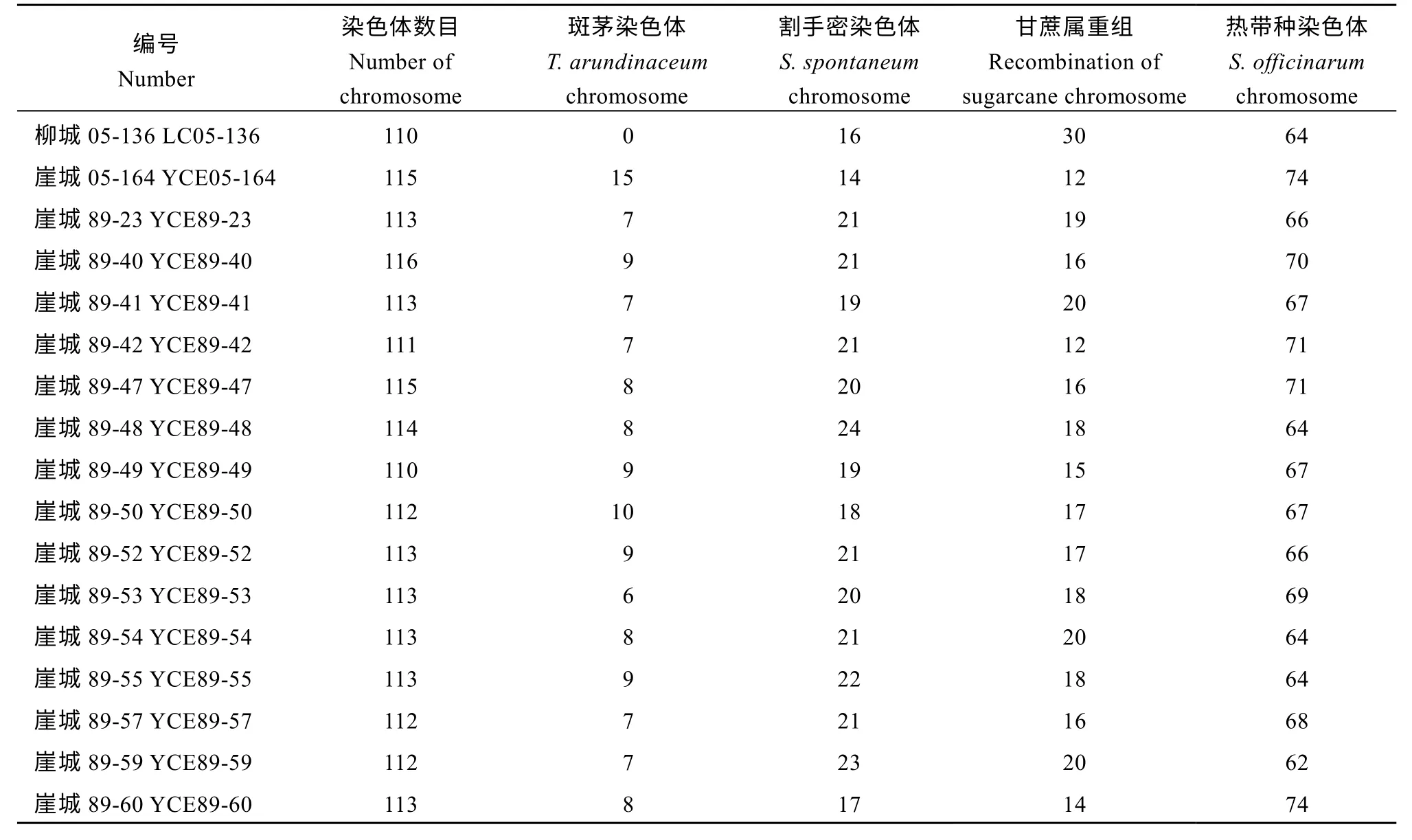
表3 甘蔗与斑茅杂交后代BC4 的染色体组成Table 3 Chromosomal composition of BC4 in the hybrid from sugarcane × T. arundinaceum
3 讨论
近缘属野生种质资源一直是作物遗传改良的重要途经, 如小麦与长穗偃麦草杂交获得的代换系7E2/7D 和7E1/7D 染色体上含有植物中偃麦草属特有的Fhb7基因, 该基因对小麦赤霉病具有广谱抗性[27]。Li 等[28]应用墨西哥黑麦和普通小麦杂交, 成功创制出一个新的小麦衍生系D27, 比普通小麦具有更高的分蘖以及更突出的白粉病、条锈病抗性。早期分子结果表明, 甘蔗和斑茅遗传距离较远[29],因此认为它们很难发生染色体重组现象。斑茅作为甘蔗重要的近缘属野生种质资源, 其杂交育种进程缓慢, 这也可能与血缘间重组率低以及未形成有效重组有关。Piperidis 等[16]对甘蔗斑茅3 个世代材料进行鉴定分析, 也未在其BC1和BC2发现甘蔗与斑茅的染色体交换现象。在本研究中, 我们发现甘蔗与斑茅的BC4群体材料中存在部分斑茅染色体的交换现象, 占后代群体材料的16.67%, 这表明利用含斑茅的亲本与甘蔗栽培种回交获得高世代材料过程中成功渗入了斑茅的血缘, 为后续结合群体重要农艺性状筛选有益斑茅血缘奠定了细胞遗传学基础。
作物杂交育种过程中会存在不同的染色体遗传方式, 而后代的染色体遗传差异最终也会导致表型的多样性。Li 等[15]通过对甘蔗与斑茅杂交后代F1的减数分裂不同时期进行观察, 发现F1代材料中的斑茅染色体在减数分裂过程中出现了大量不正常的现象。在本研究中, 亲本YCE05-164 含有15 条斑茅血缘染色体, 与LC05-136 杂交后代群体中斑茅血缘染色体包含1、6、7、8、9、10 条不同数目类型。这些结果表明甘蔗与斑茅在杂交过程中, 由于它们亲缘关系较远导致了其减数分裂染色体配对异常,产生的配子存在较大的多样性。而基于这些细胞遗传学结果, 提高培育包含斑茅不同染色体数目类型的杂交后代材料, 有助于筛选包含斑茅血缘的优异杂交亲本。
对于属间杂交来说, 结合作物不同遗传背景及其农艺性状表型差异, 鉴定并挖掘优异野生种质资源血缘基因十分重要。Babil 等[30]报道, 斑茅的染色体和某些农艺性状之间存在明显的正相关, 产量相关性状如干物质产量、有效茎重、单茎重和茎直径,斑茅染色体数目与糖和纤维含量无明显关系, 其中约n= 30 斑茅染色体数目的斑茅属间杂种在糖分和纤维数据上表现出良好的变化。因此对于高世代的斑茅杂交后代来说, 选择高糖分和纤维表现更好的材料作为回交亲本是非常必要的。本研究中的YCE05-164 与LC05-136 杂交后代89 组合中斑茅染色体与甘蔗染色体发生了重组且遗传类型丰富。今后可结合重要农艺性状差异进一步挖掘其有益的斑茅基因或染色体片段, 为提高斑茅杂交利用效率奠定基础。
4 结论
本研究以甘蔗与斑茅杂交BC4群体为研究对象,利用FISH 手段揭示了斑茅染色体在后代的遗传特征与后代群体染色体构成。结果表明, 斑茅染色体在后代杂交群体主要以n+n的遗传方式, 占整个群体的60%。在减数分裂过程中, 有40%出现非均等分离且被遗传至子代。在这一过程中, 甘蔗与斑茅发生染色体水平的重组有16.67%, 并且斑茅与不同血缘甘蔗重组的概率趋近一致。斑茅血缘的导入降低了近现代栽培甘蔗中热带种血缘与重组血缘的占比, 并同时提高了割手密血缘的比例。利用分子细胞遗传学的手段对甘蔗与斑茅杂交世代群体的染色体遗传与构成研究, 为进一步提高斑茅在甘蔗远缘杂交的利用奠定了分子细胞遗传学基础。

