干血斑中34种苯二氮卓类物质的实时直接分析-串联质谱快速筛查研究
刘富邦,张 瑛,王继芬*,周沛龙,侯晓龙
(1.中国人民公安大学 侦查学院,北京 100038;2.北京市公安司法鉴定中心,法庭毒物分析公安部重点实验室,北京 100192;3.中国医学科学院 北京协和医学院 药物研究所,北京 100050)
苯二氮卓类物质(Benzodiazepines,BZDs)是一类功能强大的中枢神经系统抑制剂[1],其种类繁多,使用较为普遍,是法医毒物检验中常见的检验目标。该类药物的许多衍生物与代谢物依然具有精神活性,且可能有更强的药效与成瘾性[1-2]。因此,BZDs 在服务于失眠、狂躁等症状的患者时,也具有十分重大的滥用风险。该类物质在自杀、强奸、抢劫等类案件中均有出现,且其中的苯二氮卓类新精神活性物质在欧洲、美国等地区的滥用越来越严重[3-4]。
血液是目前筛查BZDs 摄入的常用检材基质。人体在服用BZDs 后,其原药及代谢物会经血液循环到达身体各处。干血斑(Dried blood spot,DBS)是一种新兴的血液样本采集技术,需将取得的待测血液滴入特制试纸条上封装保存[5-6]。该技术具有采集量少、采集难度低、易于运输和储存等优势,在DNA检验中得到了广泛应用,在毒物毒品检验中也具有强大应用潜力[7]。有研究表明BZDs在全血中降解速度快,而在DBS 中十分稳定,室温下放置30 d 仍可保持初始数值的80%以上[8-9],因此DBS 是BZDs 的极好检材。
目前应用于干血斑中药物检测的方法主要是色谱-质谱联用法[10-13],尤其是液相色谱-质谱联用法。Guo 等[11]采用液相色谱-串联质谱(LC-MS/MS)法对DBS 进行分析,建立了DBS 中425 种药毒物的筛选方法,方法检出限(LOD)为0.1~10 ng/mL,并成功应用于103名疑似药物中毒患者DBS样本的检测[11]。
实时直接分析(DART)技术是一种比较成熟的原位电离技术,通过彭宁电离等作用电离并脱附样品中的物质使其进入质谱[14]。将DART与串联质谱联用的实时直接分析-串联质谱(DART-MS/MS)法具有样品制备简单、分析快速、环境友好、操作简单等优势。Crawford 等[15]使用DART-MS/MS 法直接分析玻片上的血液斑并将该方法用于药代动力学研究。Wang等[16]使用优化的DART-MS/MS方法定量DBS中的L-苯丙氨酸用以筛查新生儿苯丙酮尿症,获得了良好的线性关系并成功用于医学实践。
本文将DART-MS/MS 应用于DBS 中的毒物分析,开发了DBS 中34 种BZDs 的DART-MS/MS 筛查方法,并对该方法进行了考察和实际应用。DBS 易于运输和存储的特点使其有潜力成为案件的最佳留存检材,该研究为DBS中BZDs的快速筛查提供了新选择,也为后续的相关研究提供了参考。
1 实验部分
1.1 主要仪器、试剂与样品
QTRAP 4000 质谱仪与电喷雾电离源(美国AB SCIEX 公司);DART-SVP 电离源(美国Ion Sense 公司);SIGMA 3-30K高速冷冻离心机(德国Sigma公司);旋涡混合器(美国Talboys公司)。
阿地唑仑(Adinazolam)等34 种BZDs 标准品均购自上海原思标物科技有限公司,纯度≥99%,相关信息见表1。
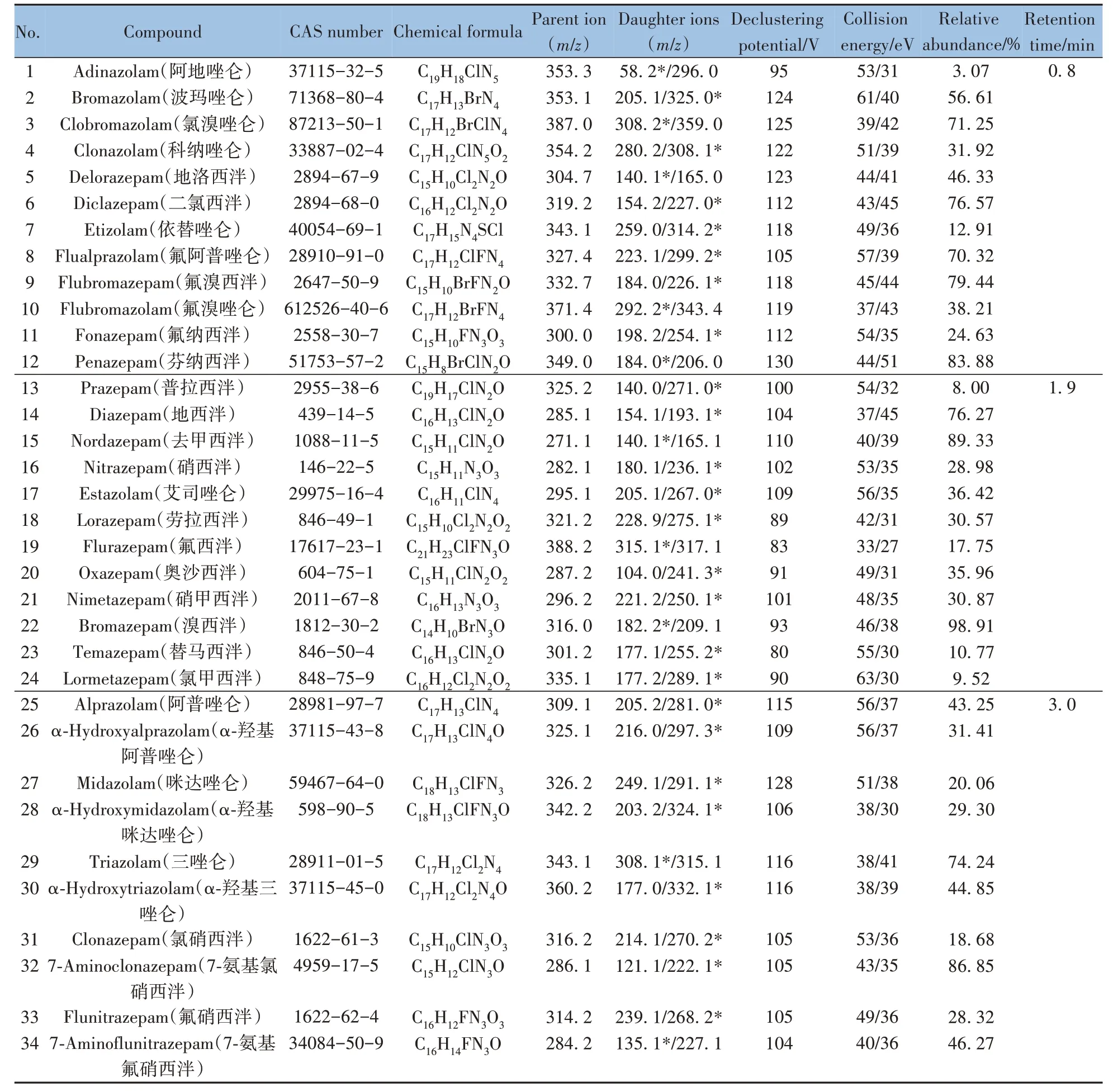
表1 34种苯二氮卓类物质的CAS号、分子式和质谱条件Table 1 CAS number,molecular formula and mass spectrum conditions of 34 benzodiazepines
甲醇、乙腈均为色谱纯,购自赛默飞世尔科技(中国)有限公司;丙酮、乙酸乙酯均为分析纯,购自国药集团化学试剂有限公司;水为去离子水。
空白血液与检材血液由北京市公安司法鉴定中心提供。采血卡购自北京达博创新科技开发有限公司。
1.2 溶液配制
以甲醇为溶剂使用5 mL 容量瓶分别配制34 种BZDs 的1 mg/mL 标准储备液。实验所需浓度的BZDs标准溶液均由甲醇稀释标准储备液配制。
各浓度血液加标样品由空白血液与标准溶液以9∶1的体积比混匀制备而成。
1.3 DART-MS/MS条件
DART 条件:装载DART 12Dip-ItTM进样模块,离子源出口与质谱接口距离为1.6 cm,每个玻璃棒进样量为5 μL,移动速度为0.6 mm/s。在正离子模式下电离,栅极电压为200 V,使用氦气作为载气,载气加热器温度为400 ℃。
质谱条件:正离子扫描模式,电喷雾电压为5 500 V,使用多反应监测(MRM)模式下的Scheduled MRM 功能设置68 个离子对的监测时间,使34 种苯二氮卓类物质分成3 组,每组监测两个玻璃进样棒的进样结果,每组药物的扫描窗口宽度为60 s,每次扫描总时间为1.2 s,在DART 开始进样的同时开启质谱扫描。优化的质谱参数及保留时间(即扫描中心时间)如表1所示。
1.4 样品前处理方法
采血卡上的DBS 由50 μL 血液滴入试纸条上并阴干3~4 h 制成,每张采血卡上可同时采集两个血斑。将制备好的DBS封袋冷冻保存。采血卡上制备好的DBS如图1所示。

图1 采血卡上制备的DBS照片Fig.1 Photograph of DBS prepared on blood collection card
将采血卡上的一个DBS 裁下并剪碎,置于1.5 mL 离心管中,并加入0.25 mL 水和0.75 mL 乙酸乙酯,涡旋振荡1 min,超声处理5 min,以14 000 r/min在4 ℃下冷冻离心5 min,取上层乙酸乙酯溶液进样分析。
2 结果与讨论
2.1 DART-MS/MS条件优化
装载电喷雾离子源后使用100 ng/mL 的各BZDs 标准品进行质谱条件优化。以全扫描模式定位药物母离子并记录质荷比,然后使用二级质谱扫描模式扫描药物碎片离子并记录质荷比,选取响应最高的两种离子对作为定性离子对。最后在MRM 模式下优化两种离子对的去簇电压(DP)和碰撞能量(CE),并计算其丰度比。优化后的质谱参数如表1 所示。在DART 自动进样程序开始的同时开启质谱扫描,为了在同一进样程序内筛查34 种苯二氮卓类物质,使用Schedule MRM 功能,设置单次扫描总时间为1.2 s,每个峰扫描5次以上以确保准确性,在保留时间0.3 ~1.3 min 范围内检测第1组;保留时间1.4 ~2.4 min 范围内检测第2 组;保留时间2.5 ~3.5 min 范围内检测第3 组。由血液制备的DBS 样品(1 μg/mL)的提取溶液中依替唑仑(第1 组)、氟西泮(第2组)、氟硝西泮(第3组)的谱图如图2所示。
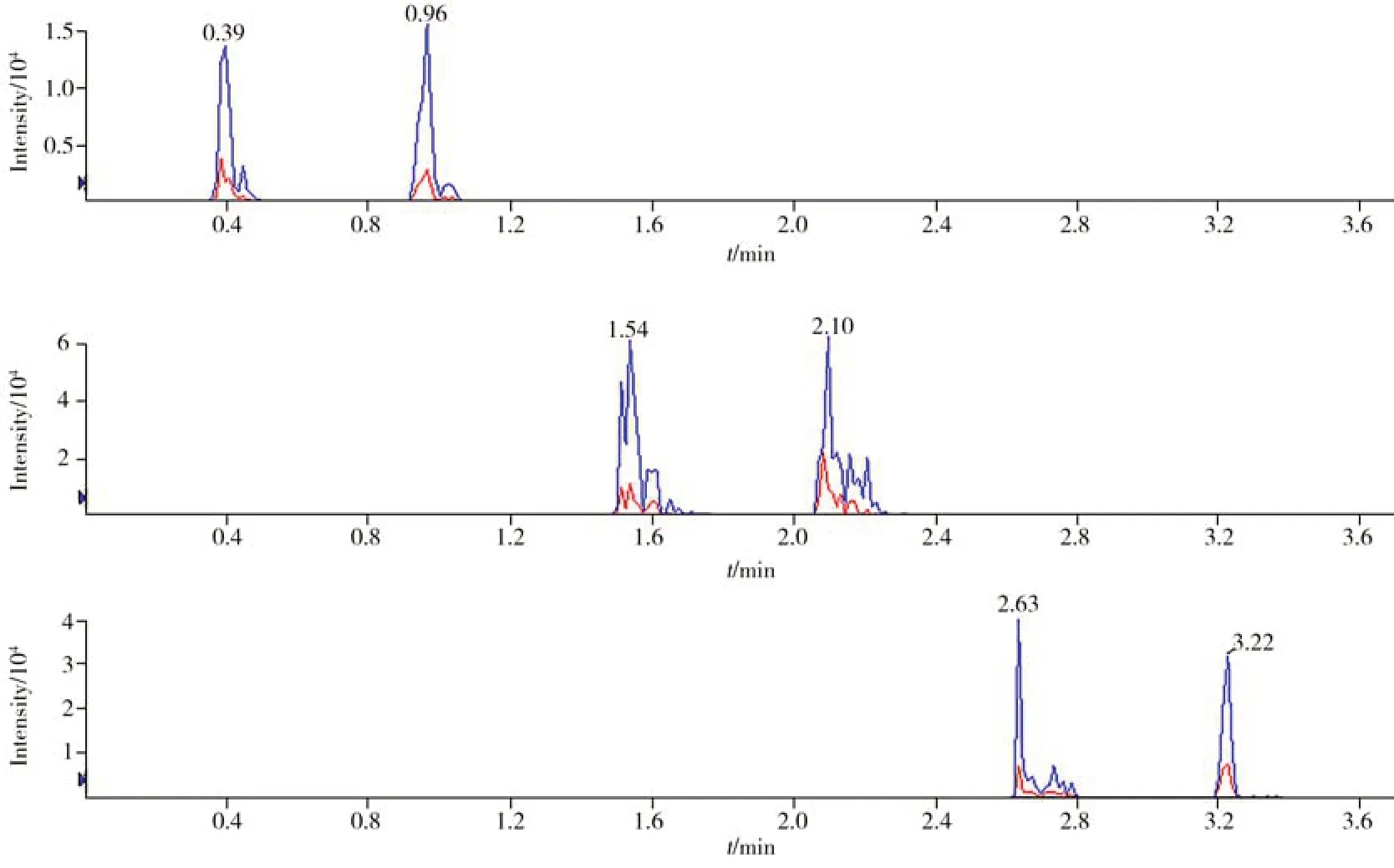
图2 DBS样品提取溶液中依替唑仑(A)、氟西泮(B)、氟硝西泮(C)的谱图Fig.2 Spectra of etizolam(A),flurazepam(B) and flunitrazepam(C) in DBS(1 μg/mL) sample extraction solution
DART 离子源出口与质谱接口的距离以及栅极电压、载气流速等参数使用默认值。DBS 样品在溶液提取后浓度较低,载气须选择电离能力强的氦气。选用相对稳定的DART 12Dip-ItTM液体进样模块,由于玻璃棒进样量越大响应越高,为保持液滴稳定,将进样量维持在5 μL。在不同温度下测定100 ng/mL BZDs 混合标准溶液6 次并取平均值,结果显示多数物质在350 ℃、400 ℃及450 ℃响应达到最大。综合考虑,选用400 ℃作为载气加热器温度。
2.2 前处理方法优化
干血斑试纸上的纤维在与血液结合后经高温载气电离吹扫时易有杂物脱落堵塞进样口,目前尚未开发出有效的应对手段。研究制备的DBS的直径约1.5 cm,其碎片的提取需使用1 mL溶剂。目前提取干血斑中的苯二氮卓类药物多使用甲醇、乙腈及其混合溶剂[10-13,17],此外乙酸乙酯是最常用于血液中苯二氮卓类物质液液萃取的溶剂[18-19]。考察了甲醇、乙腈、甲醇-乙腈(体积比1∶1)混合溶剂、乙酸乙酯-水(体积比3∶1)混合溶剂作为提取溶剂对DBS(1 μg/mL)样品和空白DBS样品的提取效果。
结果显示,甲醇作为提取溶剂时对DBS 样品各离子对的响应强度高,但在空白样品中检出了阿地唑仑、二氯西泮、氟阿普唑仑、α-羟基咪达唑仑离子对的信号,表明使用甲醇提取DBS 样品时基质干扰严重;乙腈作为提取溶剂时,空白样品中未检测到明显的BZDs 信号,但DBS 样品的信号响应较低,灵敏度差;甲醇-乙腈(体积比1∶1)混合溶剂的响应强度中等,但空白样品中仍有阿地唑仑和二氯西泮被检出;乙酸乙酯-水(体积比3∶1)混合溶剂提取液可以将更易溶于水的杂质留在下层水溶液中,乙酸乙酯提取层更加纯净,进样后的信号响应强度相对较高,且空白样品中无明显BZDs信号检出。因此,选用乙酸乙酯-水(体积比3∶1)混合溶剂作为DBS中BZDs的提取溶剂。
2.3 定性方法验证
在分析高浓度(1 μg/mL)样品后紧接着分析空白样品2次以验证方法的选择性与延迟效应。在空白样品中未发现34种BZDs的信号,因此该方法选择性良好,无延迟效应影响。
分别使用3 份不同来源的空白血液稀释制备1 000、500、200、100、50、20、10、5、2、1 ng/mL的DBS 加标样品,采用所建立的方法进行分析。选取出峰位置前后的基线为参照计算各分析物的信噪比(S/N),将满足3 份样品出峰位置谱峰的S/N≥3 且离子丰度比误差在允许范围(表2)内的最低浓度认定为检出限(LOD)。结果表明,氟西泮、奥沙西泮、阿地唑仑、α-羟基三唑仑的检出限分别为5、100、200、500 ng/mL,氯溴唑仑、氟阿普唑仑、替马西泮、阿普唑仑、咪达唑仑、三唑仑、氟硝西泮、α-羟基咪达唑仑检出限为10 ng/mL,氟溴西泮、氟溴唑仑、芬纳西泮、去甲西泮、硝西泮、氯硝西泮、7-氨基氯硝西泮的检出限为50 ng/mL,其他BZDs 的检出限为20 ng/mL。可见所建方法可作为案件留存DBS中大多数BZDs物质的有效快速筛查方法。

表2 特征离子丰度比的最大允许相对偏差范围Table 2 Maximum allowable relative deviation range of relative abundance of characteristic ions
2.4 实际应用
使用所建立的方法对35 个DBS 样本(包括31 个阳性血液检材和4 个空白血液检材)进行快速筛查,并将筛查结果与LC-MS/MS 检验结果进行比较。其中,有3个阳性检材样本因浓度太小未检出;5个阳性检材样本只能认定其中1 种原药或代谢物;其他23 个阳性检材样本和4 个空白血液检材样本均获得与LC-MS/MS一致的结论。阳性检材的检验结果比较如表3所示。
在实际样品检验中,2、7、12、14、29号检材虽然检测出的BZDs种类比LC-MS/MS法少,但能够成功推断出案件中所服用的物质,可在筛查后再使用LC-MS/MS 准确定性和定量。案件检材DBS 的筛查失败率仅为9.7%,均为检材中药物浓度低所致,因此推荐在自杀等服用药物较多的案件中使用DART-MS/MS 法进行快速筛查。为方便保存,可将BZDs 浓度在LOD 以上的血液检材存为DBS 样品以便进行重复检验。
3 结 论
本文建立了一种快速筛查DBS中34种BZDs的DART-MS/MS方法,该方法操作简单快捷、成本低,满足绝大多数BZDs 的筛查需求。研究中使用的DBS 采血卡是DNA 保存与检验的标准载体,能够实现一卡久存多用。该方法在案件检材中的应用效果良好,符合实战需求。
虽然直接吹扫干血斑表面可能会导致出现杂质堵塞进样口等问题,但通过改进干血斑试纸或DART 离子源,本文所建方法仍有潜力在快速分析DBS 的应用中发挥重大作用。但由于灵敏度相对较低、现场取血操作难以保证重复性、血液血细胞比容不同等因素的影响,本方法在定量分析方面尚有一定的挑战性。

