基于核酸适体的电化学生物传感研究
李诗琪,骆怡琳,万建文,胡 琼*,韩冬雪*,牛 利,2
(1.广州大学 化学化工学院,广州大学分析科学技术研究中心&广州市传感材料与器件重点实验室&广东省光电传感材料与器件工程技术研究中心,广东 广州 510006;2.中山大学 化学工程与技术学院,广东 珠海 519082)
作为构成生命的最基本物质,核酸(包括核糖核酸(RNA)和脱氧核糖核酸(DNA))不仅是遗传信息储存和传递的主要载体,而且在基因表达调控、细胞分化调控、细胞周期调控等众多生命活动过程中发挥着重要作用。单链核酸分子不仅可以遵从Watson-Crick 碱基互补配对原则(A-T/U 与G-C)与互补序列以及肽核酸(PNA)、锁核酸(LNA)、吗啉代寡核苷酸(PMO)等核酸类似物片段形成稳定的双螺旋结构,也可同时经由Hoogsteen氢键及反向Hoogsteen氢键与双链DNA结合形成三链DNA结构[1]。此外,单链核酸分子也可通过折叠成特定的三级结构与各种非核酸类物质发生高特异性、高亲和力结合,此类功能核酸被称为核酸适体(Aptamer)[2]。核酸适体是一类由20~100个碱基组成的寡核苷酸片段,通常经由基于指数富集的配体系统进化(SELEX)技术从核酸文库中体外筛选获得(如图1 所示)[3-4],它们可以通过氢键作用、静电作用、疏水效应、范德华力等分子间非共价相互作用与各种小分子化合物[5-6]、蛋白质[7-8]、外泌体[9-10]、循环肿瘤细胞(CTCs)[11-12]、细菌[13-14]以及病毒[15-16]等靶标特异性结合。由于核酸适体不仅具有与抗体相当甚至更高的特异性与亲和力,且具有一经筛选获得即可大批量人工合成,且具有价格低廉、易于修饰、免疫原性低、批间差异小、热稳定性好等优良特性[2],在分析化学[17-18]、疾病治疗[19-20]以及生物医学研究[21]等领域获得了广泛的关注。
在分析化学领域,目前已经探索建立了众多的以核酸适体作为特异性识别元件的生物分析方法,如比色分析[22]、荧光分析[23-24]、共振光散射(RLS)[25]、石英晶体微天平(QCM)[26]、表面等离子体共振(SPR)[27]、纳米孔[28]、悬梁臂[29]、光电化学法(PEC)[30-31]、化学发光法[32]、电化学发光法(ECL)[33-34]、表面增强拉曼散射法(SERS)[35-36]以及电化学生物传感器[37-40]等。其中,电化学适体传感器由于具有抗干扰能力强、设备简单、易于小型化、检测成本低廉、灵敏度高、便携性好等优势[41-42],获得了较多的关注。本文在此结合最新研究进展及本课题组的相关研究工作,对电化学适体传感器在小分子化合物[43-44]、蛋白质[45-46]、外泌体[47-48]、CTCs[49-50]以及病原微生物(如细菌和病毒等)[51-52]等生物靶标检测中进行了系统的归纳与总结,着重介绍了相关电化学适体传感器的检测原理、分析特性以及所应用的信号放大策略,并进一步探讨了电化学适体传感器实际应用所面临的诸多挑战与潜在的发展趋势。
1 基于核酸适体的电化学生物传感研究
1.1 在小分子化合物检测中的应用
氨基酸、腺苷三磷酸(ATP)、多巴胺、肾上腺素、雌激素(如雌二醇等)、抗生素(如青霉素等)、有机杀虫剂(如滴滴涕等)和除草剂(如百草枯等)、三硝基甲苯(TNT)、黄曲霉毒素等小分子化合物的检测,对于临床诊断、生物医学研究、食品/药品/公共安全、环境监测等领域至关重要。由于小分子化合物与固定化核酸适体的结合会阻碍电极表面的电荷转移(核酸适体与靶标结合时会发生折叠,此构象变化加之靶标自身均会使得电极表面的空间位阻增大),研究人员构建了一类免标记的电化学适体传感器,用于小分子化合物的定量分析[53]。例如,Shahdost-Fard 等[54]和Zhong 等[55]以核酸适体作为固定化分子识别元件,分别以芦丁或[Fe(CN)6]3-/4-作为氧化还原探针,通过测量靶标与核酸适体结合前后的阻抗或电流信号的变化,分别实现了对TNT 和黄曲霉毒素B1(AFB1)的高选择性电化学检测,检测下限分别为0.33 fmol/L 和1.82 pg/mL。此类方法尽管操作简便且成本低廉,但电极表面的非特异性吸附易导致产生假阳性结果。为克服上述缺陷,研究人员以远端修饰有二茂铁(Fc)或亚甲基蓝(MB)等电活性探针的核酸适体作为固定化分子识别元件(核酸适体在与靶标结合的过程中会发生显著的构象变化,使得修饰在其远端的电活性探针与电极表面的距离发生变化,进而导致氧化还原电流大小发生改变[56]),实现了对ATP[57]、茶碱[58]、可卡因[59]、苯丙氨酸[60]和万古霉素[61]等小分子化合物的高选择性电化学检测。此类电化学适体传感器尽管操作简便、成本低廉且可多次重复使用,但检测灵敏度仍有待进一步提高。为此,研究人员提出借助于使用纳米材料[62]、酶促反应[63]以及催化发卡组装(CHA)[64]等策略对检测信号进行放大[65]。例如Cui等[66]以核酸适体作为特异性分子识别元件,借助于核酸外切酶I(Exo I)辅助的目标循环信号放大作用,实现对AFB1的高灵敏电化学检测,检测下限为0.032 pg/mL。
1.2 在蛋白质检测中的应用
蛋白质是生命活动的最主要载体,不仅参与细胞骨架形成(如肌动蛋白和微管蛋白等),而且在细胞新陈代谢、细胞黏附、免疫响应、细胞信号传导、物质传输、细胞周期调控等绝大多数生命活动过程中发挥着不可或缺的作用。由于蛋白质表达水平异常与恶性肿瘤、糖尿病、心脑血管疾病、炎症等众多病理过程密切相关,因此其作为生物标志物已被广泛用于疾病的筛查与诊断。
围绕蛋白质的电化学适体传感,研究人员已经开展了大量的工作。例如,Liao 等[67]、Li 等[68]和Sypabekova 等[69]构建了一类阻抗型电化学适体传感器,分别实现对血小板衍生生长因子BB(PDGFBB)、凝血酶和结核分枝杆菌分泌蛋白(MPT64)的高选择性检测,检测下限分别为40 nmol/L、0.03 nmol/L 和81 pmol/L。以末端修饰有Fc 或MB 等电活性探针的核酸适体作为固定化分子识别元件,Xiao等[70]、Lai 等[71]和Lo 等[72]构建了一类伏安型电化学适体传感器,分别实现了对凝血酶、PDGF-BB 和恶性疟原虫富组氨酸蛋白II(PfHRP2)的高选择性检测,检测下限分别为6.4 nmol/L、1.25 ng/mL 和3.73 nmol/L。为进一步提高电化学适体传感器的检测灵敏度,研究人员提出借助于使用辣根过氧化物酶(HRP)等天然酶[73]、金属卟啉等仿生催化剂[74]、金属有机框架(MOFs)材料[75]、CRISPR-Cas 体系[76]、金属纳米粒子[77]以及聚合物材料[78]对检测信号进行放大。例如,Zhao 等[79]以核酸适体作为固定化分子识别元件,待其与凝血酶结合后,进一步利用核酸适体与凝血酶的亲和相互作用将表面负载有大量HRP 分子的金纳米粒子(AuNPs)引入电极表面,借助于HRP 的高效生物催化作用,实现对凝血酶的高灵敏电化学检测,检测下限为30 fmol/L。Kim 等[78]以核酸适体作为固定化分子识别元件,待其与凝血酶结合后,进一步利用核酸适体与凝血酶的亲和相互作用将携带有十余个吩嗪分子的聚合物链引入电极表面,借助于吩嗪对还原型辅酶I(NADH)的电催化活性,实现了对凝血酶的高灵敏电化学检测,检测下限约为50 pmol/L(检测原理如图2A 所示)。上述策略虽然都能显著提高电化学适体传感器的检测灵敏度,但存在操作复杂、成本高昂、稳定性差等不足[80]。
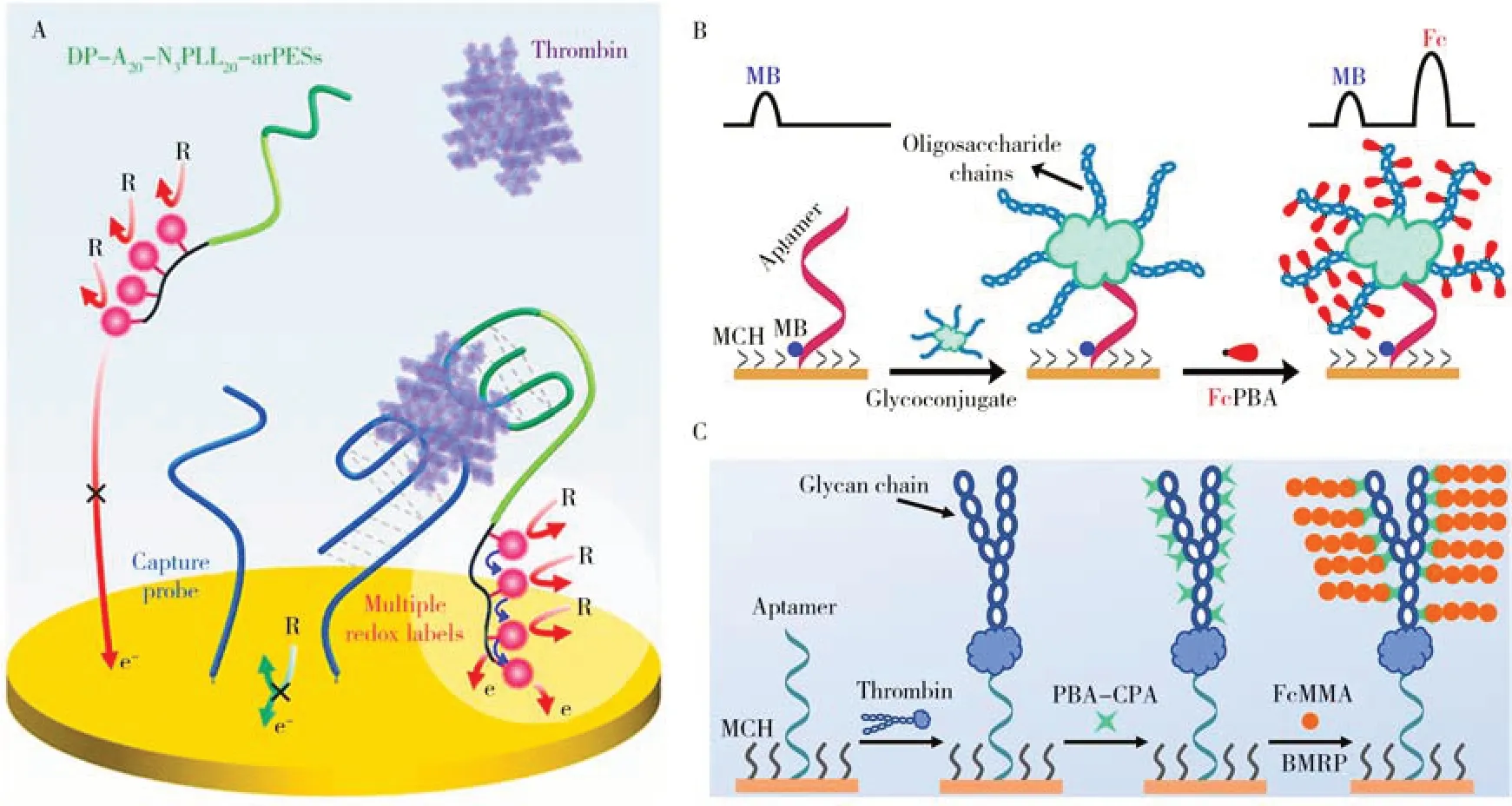
图2 基于多个吩嗪分子电催化信号放大的凝血酶高灵敏电化学适体传感研究[78](A);基于靶标自身聚糖链信号放大的CA15-3高灵敏比率型电化学适体传感研究[84](B);基于靶标自身聚糖链协同BMRP信号放大的凝血酶高灵敏电化学适体传感研究[88](C)Fig.2 Highly sensitive electrochemical aptasensing of thrombin through the electrocatalysis of polyphenazines[78](A); Highly sensitive ratiometric electrochemical aptasensing of CA15-3 via signal amplification of the target’s glycan chains[84](B); Targetsynergized biologically mediated RAFT polymerization(BMRP) for amplified electrochemical aptasensing of thrombin[88](C)
大量研究表明,由于酶促糖基化等翻译后修饰(PTM),生物体内的蛋白质几乎均以糖蛋白的形式存在(即多肽链的特定氨基酸残基上携带有聚糖链),如凝集素、运载蛋白、细胞表面受体蛋白(如G蛋白偶联受体等)、纤/层粘连蛋白、绝大多数血浆蛋白(如免疫球蛋白、补体、促甲状腺素、人绒毛膜促性腺激素(HCG)、蛋白酶类、某些干扰素和生长因子等)、甲胎蛋白(AFP)和癌胚抗原(CEA)等肿瘤标志物、胶原蛋白等。由于聚糖链通常由十余个甚至数十个单糖残基组成且单糖残基上的顺式1,2-和1,3-二醇位点可与(苯)硼酸基团发生共价交联反应[81-82],因此借助于硼酸盐亲和交联反应可在糖蛋白上标记大量的信号探针,使其在未采用额外信号放大策略的情况下仍可实现对相关靶标的高灵敏检测。受此启发,我们以核酸适体作为固定化分子识别元件,通过将大量电活性Fc探针直接位点靶向性地标记到AFP 的聚糖链上(Fc 探针上偶联有苯硼酸(PBA)基团),实现了其高灵敏电化学检测,检测下限为0.037 ng/mL[83]。为提高电化学适体传感器的抗干扰性能与检测结果的可重现性,我们进一步以近端修饰有电活性MB 探针的核酸适体作为固定化分子识别元件,通过将大量Fc 探针标记到相关靶标的聚糖链上,先后实现了对糖类抗原CA15-3(检测原理如图2B 所示)[84]和治疗性单克隆抗体贝伐珠单抗[85]的高灵敏比率型电化学检测,检测下限分别为0.021 U/mL 和6.5 ng/mL。由于无需采用额外的信号放大策略即可实现对靶糖蛋白的高灵敏检测,上述电化学适体传感器具有操作简便、成本低廉、检测时间短等优良特性,非常适用于即时检验(POCT)等领域。为进一步提高电化学适体传感器的检测灵敏度,本课题组进一步借助于电化学调控的原子转移自由基聚合(eATRP)或生物学介导的可逆加成-断裂链转移(RAFT)聚合(BMRP)在相关生物靶标的聚糖链上从头接枝含有大量Fc 探针的聚合物链(以甲基丙烯酸二茂铁基甲酯(FcMMA)作为单体),分别实现了对AFP[86]、CEA[87]和凝血酶(检测原理如图2C 所示)[88]的高灵敏检测,检测下限分别为0.32 pg/mL、0.34 pg/mL和35.3 fmol/L。由于外泌体、CTCs、细菌、病毒等生物靶标上均携带大量的聚糖链,基于靶标自身聚糖链信号放大的电化学适体传感器在相关生物靶标的简便、快速、低成本、高灵敏、高选择性检测方面具有相当广阔的应用前景。
1.3 在外泌体检测中的应用
外泌体是细胞分泌的直径为30~150 nm 的微型囊泡,广泛存在于尿液、唾液、血液、淋巴液、脊髓液、乳汁、精液、腹水、羊水等生物体液中,在细胞间物质交换、抗原提呈、免疫应答、细胞分化/增殖/凋亡、肿瘤侵袭与转移、细胞信号传递等方面发挥着重要作用[89]。由于携带有大量源自母体细胞的蛋白质、脂质和核酸(如mRNAs 和miRNAs)等生物活性组分,外泌体在癌症、心脑血管疾病、神经系统疾病、免疫相关疾病等方面的诊断具有重大应用价值[90-91]。
围绕外泌体的电化学适体传感,现有方法通常是借助于核酸适体对外泌体表面特定蛋白质组分的特异性识别来实现[92-93]。例如,Wang 等[94]构建了一种伏安型电化学适体传感器并实现了对肝癌细胞(HepG2)外泌体的快速定量分析,检测下限为2.09×104个/mL。为实现对外泌体的高灵敏电化学检测,研究人员提出借助于使用酶催化反应或纳米材料对检测信号进行放大[95-96]。例如,Kashefi-Kheyrabadi等[97]借助于核酸适体与外泌体表面的上皮细胞粘附分子(EpCAM)间的特异性识别将外泌体捕获到电极表面,并进一步借助于核酸适体与EpCAM 蛋白间的特异性识别引入银纳米粒子(AgNPs),通过对AgNPs进行溶出分析,实现了外泌体的高灵敏电化学检测,检测下限为17个/μL。类似地,Cheng等[98]构建了一种“夹心型”电化学适体传感器,通过将表面负载有大量电活性MB 探针的AuNPs 引入电极表面,实现对MCF-7细胞外泌体的高灵敏检测,检测下限为158个/μL(检测原理如图3所示)。由于上述方法主要通过单一核酸适体对外泌体表面单一蛋白组分的特异性识别与捕获实现,均存在选择性差、易产生假阳性结果等缺陷。具体来说,当某些蛋白质分子(如CD9 和CD63 等跨膜蛋白、EpCAM 蛋白等)同时存在于多种外泌体表面时,电化学适体传感器则无法有效区分是何种外泌体;此外,当样品中仅存在所识别的蛋白质分子时,也会导致产生相应的电化学检测信号(如EpCAM 蛋白和表面携带有EpCAM 蛋白的外泌体与核酸适体的结合均会引起阻抗信号发生变化)。为克服上述缺陷,可通过同时使用多种核酸适体的策略对外泌体进行检测[99]。例如,以某种核酸适体作为固定化分子识别元件对外泌体表面的某种蛋白质分子进行识别与捕获,然后通过第二种核酸适体对外泌体表面另一种蛋白质分子的特异性识别将电活性探针引入电极表面,即可显著提升对外泌体检测的选择性。
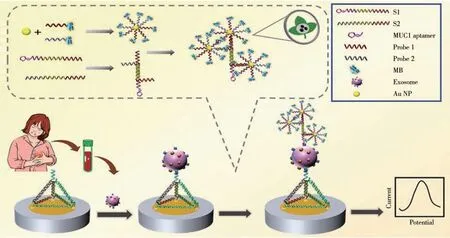
图3 基于AuNPs信号放大的外泌体高灵敏电化学适体传感研究[98]Fig.3 Highly sensitive electrochemical aptasensing of exosomes based on clover-like gold nanoclusters[98]
1.4 在循环肿瘤细胞检测中的应用
循环肿瘤细胞(CTCs)是指存在于外周血中的各类肿瘤细胞,在肿瘤的早期筛查与诊断、个体化治疗、预后判断以及疗效评估等方面具有重要价值[100-101]。类似于外泌体,CTCs 表面也存在大量的蛋白质分子(如各种跨膜蛋白);因此,可借助于核酸适体对CTCs表面特定蛋白质分子的特异性识别,对靶CTCs进行电化学检测[102-105]。例如,Shen等[106]构建了一种阻抗型电化学适体传感器,其对CTCs的检测下限为10 个/mL;在该方法中,研究人员将EpCAM 蛋白的核酸适体通过DNA 杂交反应固定在电极表面,待其与靶CTCs结合后,借助于电化学阻抗谱(EIS)对靶CTCs的浓度进行定量分析。类似地,Yang等[107]以EpCAM核酸适体作为固定化分子识别元件,待其与靶CTCs结合后,借助于EpCAM蛋白与其抗体的特异性识别作用将表面负载有大量HRP分子的AuNPs引入电极表面,借助于HRP的高效生物催化作用,实现了CTCs 的高灵敏电化学检测,检测下限为25 个/mL(检测原理如图4 所示)。此外,Hashkavayi 等[108]利用胆固醇分子与磷脂双分子层间的疏水相互作用将一段寡核苷酸片段标记到被EpCAM 核酸适体捕获的CTCs 上,然后通过滚环扩增(RCA)反应产生含有多个G-四链体结构的串联重复序列,借助于G-四链体与血红素(Hemin)结合形成的复合物的类HRP 催化活性,实现对CTCs 的高灵敏电化学检测,检测下限为1个/mL。然而,类似于外泌体的电化学适体传感,由于针对单一蛋白分子的识别方式无法实现其特异性识别与捕获,CTCs的高选择性检测需要同时使用多种核酸适体对其表面不同蛋白质分子进行协同识别。
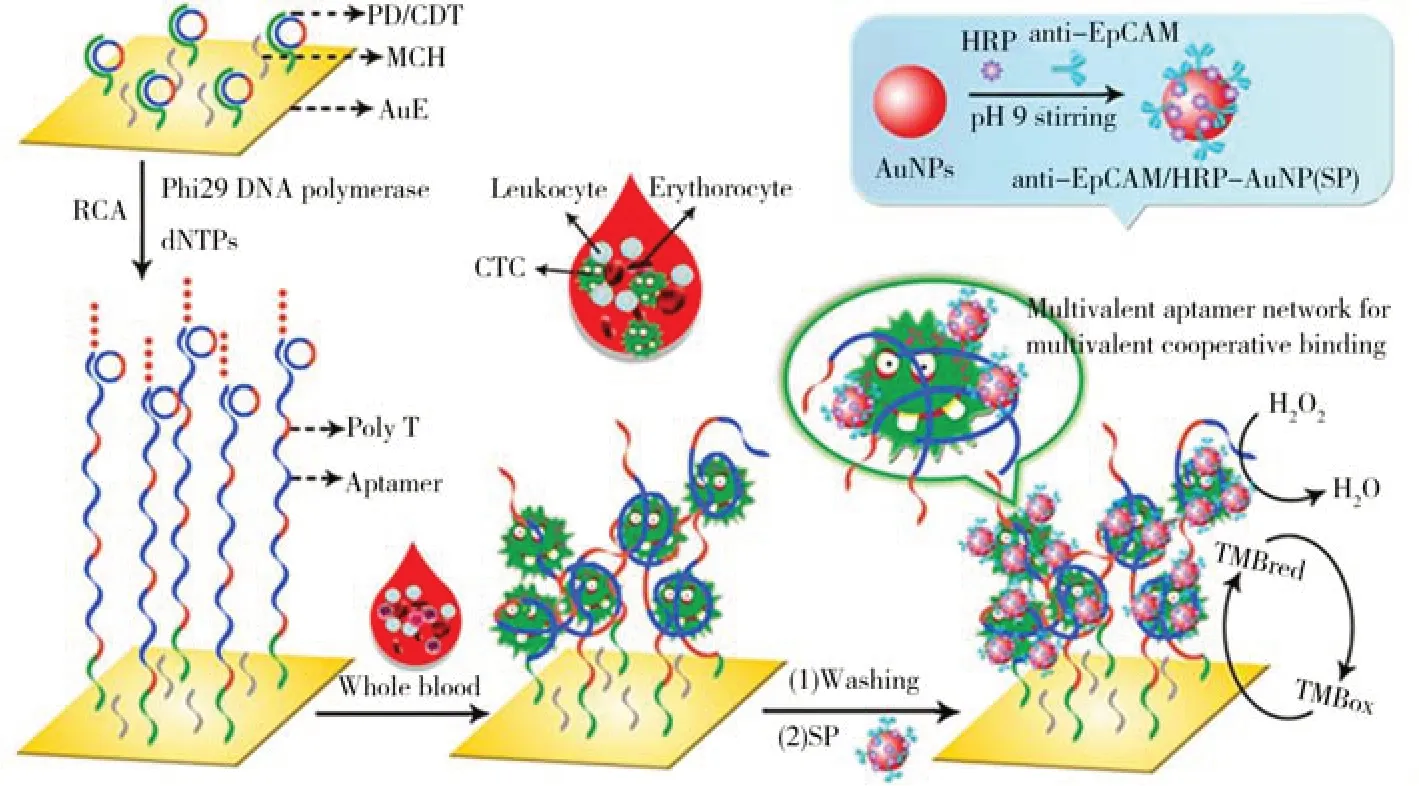
图4 基于HRP生物催化信号放大的CTCs高灵敏电化学适体传感研究[107]Fig.4 HRP-amplified electrochemical aptasensing of CTCs[107]
1.5 在病原微生物检测中的应用
病原微生物(也称病原体)是指可侵犯人体并引起感染乃至传染病的微生物,包括细菌、病毒、朊毒体、真菌、螺旋体、支原体、衣原体、立克次体等。病原微生物(如霍乱弧菌、天花病毒、埃博拉病毒、新型冠状病毒、HIV病毒等)严重威胁着人类的生命健康,它们的大规模爆发会对社会和经济生活造成严重的影响。例如,新型冠状病毒(SARS-CoV-2)自2019年底爆发至今,已造成全球1 400多万人死亡;衣原体感染可引起人类和动物的尿道感染、胃肠炎、子宫感染、早产、流产、肺炎、脑脊髓炎、支气管炎、关节炎和结膜炎等多种疾病。显然,病原微生物的检测对于疾病筛查/防控、食品/药品/饮水安全、环境监测等领域意义重大[109-110]。
由于核酸适体相较于抗体具有成本低廉、批间差异小、稳定性好、可人工合成且易于修饰等优势,在病原微生物的高选择性检测中获得了广泛关注[111-114]。例如,Zelada-Guilln 等[115]和Ding等[116]借助于病原微生物与固定化核酸适体结合所引起的电位变化,构建了一类电位型电化学适体传感器,分别实现了对伤寒沙门氏菌和李斯特菌的快速检测,检测下限分别为0.2 CFU/mL 和10 CFU/mL。Labib 等[117]、Bai等[118]和Zhang等[119]构建了一类阻抗型电化学适体传感器,分别实现了对鼠伤寒沙门氏菌、H1N1 病毒和SARS-CoV-2 病毒(检测原理如图5 所示)的快速检测,检测下限分别为600 CFU/mL、0.9 pg/μL 和1 000 个/mL。为实现对病原微生物的高灵敏电化学检测,Abbaspour等提出以核酸适体作为固定化分子识别元件,待其与靶标结合后进一步借助于核酸适体与靶标的特异性识别将AgNPs 引入电极表面,通过对AgNPs 进行溶出分析,实现对金黄色葡萄球菌的高灵敏电化学检测,检测下限为1.0 CFU/mL[120]。类似地,Nguyen等[121]通过核酸适体对靶标的特异性识别将HRP分子标记到被核酸适体捕获的金黄色葡萄球菌上,借助于HRP的高效生物催化作用,实现了对金黄色葡萄球菌的高灵敏电化学检测,检测下限为39 CFU/mL。
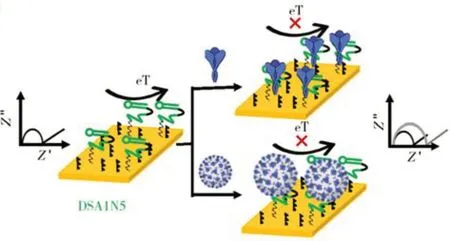
图5 SARS-CoV-2病毒的阻抗型电化学适体传感研究[119]Fig.5 Impedance-based electrochemical aptasensing of SARSCoV-2 virus[119]
2 总结与展望
本文系统归纳总结了电化学适体传感器在小分子化合物、蛋白质、外泌体、CTCs以及病原微生物等生物靶标检测中的研究进展。由于电化学适体传感器相较于酶联免疫吸附分析(ELISA)等传统检测方法具有操作简便、成本低廉、稳定性好等优势,在临床诊断、生物医学研究、食品/药品/公共安全、环境监测等领域展现出巨大的应用前景。
然而,电化学适体传感器的相关研究目前尚处于实验室初步概念验证阶段,其商业化应用仍面临着长期的巨大挑战。在血清等实际样品中,特定生物靶标的含量可能处于极低的水平,且样品中通常存在大量干扰性组分。这些特点必然要求相关检测方法能同时具有灵敏度高、选择性好、可靠性高等特性;此外,POCT等实际应用场景还要求检测方法能同时具有便携性好、操作简便、成本低廉、稳定性好、重现性好等优良特性。然而,想让电化学适体传感器同时满足这些性能指标无疑是一个极大的挑战。此外,由于核酸适体在分子量上相较于抗体小很多,其结构稳定性通常不理想,使得核酸适体与靶标的结合对环境因素变化相当敏感。尽管阻抗型和电位型电化学适体传感器具有操作简便、成本低廉、选择性好等优良特性,但其检测灵敏度通常不理想,且电极表面的非特异性吸附会产生假阳性结果;此外,虽然使用纳米材料(如MOFs 等孔状材料、金属纳米粒子、石墨烯等碳纳米材料等)和催化反应(如使用HRP等天然酶、金属卟啉等模拟酶、含过渡金属元素的电催化剂等)等策略均能显著提高电化学适体传感器的检测灵敏度,但也存在操作复杂、稳定性差、检测成本高昂等不足。由于糖蛋白、内毒素、外泌体、CTCs、细菌、病毒等生物靶标上均携带一定数量的聚糖链且聚糖链上通常存在着大量的诸如邻位羟基等功能基团的活性位点,如果能充分利用靶标自身所携带的聚糖链进行信号放大,将显著提升电化学适体传感器的简便性并大幅降低检测成本[122]。然而,与其他种类生物传感器一样,电化学适体传感器的实际应用面临的最大挑战是稳定性和重现性通常都不理想,无法给出准确可靠的检测结果。因此,显著提升传感界面的稳定性和检测结果的重现性是实现电化学适体传感器商业化应用亟待解决的难题。由于检测样本来源复杂(如既有肉类、蛋类、土壤、奶粉等硬样本,也有体液、牛奶、矿泉水、饮料、注射液、污水等液体样本),微流控等样品前处理技术的结合将能显著提升电化学适体传感器的实用性。
未来,随着与移动电子设备、物联网(IoT)、无线通信技术(如蓝牙、WI-FI、星闪等)、大数据、人工智能等的深度融合,电化学适体传感器将持续朝微型化、自动化、数字化、高通量、可植入式等方向发展。当然,这些都迫切需要化学、物理学、生物学、医学、材料科学、电气工程等诸多领域的跨学科研究人员共同创新,切实推动电化学适体传感器从实验室向商业应用过渡。

