基于UHPLC-Q-Exactive Orbitrap HRMS 技术结合化学计量学方法的不同干燥处理杜仲叶成分分析
李淑芳,王会锋,郝学飞,胡永建,李圆圆,马风莲,冯书惠,杨亚琴,于永杰
(1.河南省农业科学院农产品质量安全研究所,河南 郑州 450002;2.宁夏医科大学 药学院,宁夏 银川 750004)
杜仲叶(Eucommiae Folium)为杜仲科植物杜仲(Eucommia ulmoides Oliv.)的干燥叶,由《中华人民共和国药典》(2005 年版)首次收载并以绿原酸的含量为其质量控制指标[1]。与杜仲皮类似,杜仲叶富含环烯醚萜类、有机酸类、黄酮类、木质素类等活性成分,具有降压、降脂、降糖、保肝、消炎杀菌、抗氧化、抗疲劳、抗骨质疏松等多种药理作用和保健价值[2-7]。杜仲叶的再生能力强,易于采集,可作为杜仲皮的替代资源,具有广阔的应用前景。杜仲叶作为传统“既是食品又是中药材”的物质,已开发出杜仲茶、复合饮料、保健食品、饲料添加剂等多种功能性产品[2-4]。新鲜杜仲叶不便长时间保存,采收后需进行干燥处理。目前,杜仲叶常用的干燥处理方式主要有阴干、晒干、低温烘干、炒制等传统方法,以及热风干燥、远红外干燥、微波干燥和冷冻干燥等现代干燥方法[8-12]。干燥处理是影响杜仲叶化学成分含量,决定其药用品质及经济价值的关键因素之一。开展不同干燥处理杜仲叶中的化学成分差异研究对于杜仲叶的深度开发和质量控制具有重要意义。
现有针对不同干燥方法影响杜仲叶质量的研究工作[8-12]通常以绿原酸、京尼平苷酸、京尼平苷、总黄酮等功能成分的含量作为评价依据。如陈书明等[8]采用晒干、阴干、热风干燥、超声与热风结合干燥、远红外及微波干燥6 种方法对杜仲叶进行干燥,以绿原酸、总黄酮、总多酚、总多糖的含量为指标比较6种方法的效果。严瑞娟等[12]采用5种初加工方式(蒸制、烫制、炒制、烘制、微波制)对杜仲叶处理后再进行阴干,通过指纹图谱、绿原酸及京尼平苷酸的含量比较分析不同初加工方式对杜仲叶品质的影响。杜仲叶成分复杂,仅采用少量成分或利用指纹图谱进行质量评价存在局限性,亟待建立基于杜仲叶化学成分物质基础的分析手段及评价模式。
代谢组学表征生物体整体功能状态的特点与中药多组分协同作用的整体性特点相吻合,已广泛应用于药用植物质量控制及其物质基础分析等研究领域。超高效液相色谱-高分辨质谱分析技术(UHPLC-HRMS)为海量代谢物信息提供了高精度分析工具平台,在非靶向代谢组学研究中扮演着重要角色。目前,已有文献[13-16]基于UHPLC-HRMS的非靶向代谢组学技术对杜仲产品中的化学成分开展研究。如Liu 等[13]采用基于超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF MS)平台的非靶向代谢组学与基于超高效液相色谱串联四极杆质谱(UPLC/QDa)平台的选择性检测相结合的策略对杜仲(皮、叶、花、籽)相关原料及产品进行差异分析与鉴别,多元统计分析结果揭示25 种差异性成分可用于不同部位的判别,并选出8 种成分用于UPLC/QDa 系统定量分析。Chen 等[14]采用基于UHPLC-Q-TOF MS的非靶向代谢组学技术与多元统计分析相结合揭示杜仲不同组织(叶、皮、籽)的代谢物差异与相关性。结果表明,杜仲叶代谢物组成与树皮相似,但不同组织间存在显著差异。严颖等[15]利用液相色谱-串联三重四极杆飞行时间高分辨质谱法(LC-Triple TOF MS/MS)结合多元统计分析开展了杜仲、杜仲叶与杜仲雄花的成分差异及变化研究。申梦园等[16]通过超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(UPLC-Q-Orbitrap HRMS)与化学模式识别技术结合对乔林与叶林2种栽培方式的杜仲叶进行次生代谢产物差异分析。基于UHPLC-HRMS 的非靶向代谢组学技术显示出强大的成分分析潜力,然而在进行复杂植物样本分析时,仍面临着如何实现高效率、高通量、智能化地提取与识别化合物信息等难题[17]。AntDAS[18-19]为近期发表的非靶向代谢组学数据自动化分析处理软件,具有准确提取与解析提取离子色谱图(EIC)、化合物鉴定、多样本批处理及化学计量学分析等功能,为复杂植物样本UHPLC-HRMS 数据提供了新的分析工具。本研究以杜仲初生嫩叶为研究对象,通过基于液质联用的非靶向代谢组学技术结合化学计量学自动化分析软件AntDAS-LCHRMS 对不同干燥处理获得的杜仲叶中的差异性化合物进行分析。使用层次聚类分析(HCA)、主成分分析(PCA)、热图分析等方法对不同干燥处理的杜仲叶样本进行判别分析,评价了不同干燥处理杜仲叶的化学物质基础差异,以期为杜仲叶产品综合开发和资源利用提供科学依据。
1 实验部分
1.1 仪器与试剂
Ultimate 3000 超高效液相色谱-Q Exactive-Orbitrap 静电场轨道阱高分辨质谱联用仪(美国赛默飞世尔科技公司);Eppendorf 5810 R 型台式高速大容量冷冻离心机(德国艾本德公司);KQ-500DE 型台式数控超声波清洗器(江苏昆山市超声仪器有限公司);久品JP-300C型高速多功能粉碎机(浙江永康市久品工贸有限公司);Sartorius BS224S 电子天平(赛多利斯科学仪器(北京)有限公司);Axygen 2 mL 离心管(爱思进生物技术(杭州)有限公司);Aibensen MixOne 数显漩涡振荡器(合肥艾本森科学仪器有限公司);Milli-Q Synthesis超纯水系统(德国默克公司)。
甲醇(质谱纯)、乙腈(色谱纯)及甲酸(98%~100%,质谱纯)购自德国Merck 公司。实验用水为超纯水(经Milli-Q Synthesis 超纯水系统获得)。赖氨酸、谷氨酸、精氨酸、苯丙氨酸、色氨酸等标准品(纯度均为99%)均购于Sigma-Aldrich公司。腺苷(≥99.9%)、鸟苷(≥93.2%)、蔗糖(≥99.8%)、腺苷酸(≥98%)购自CATO Research Chemicals Inc.。维生素B5(≥99.5%)、儿茶素(≥98.56%)购自Stanford Analytical Chemicals Inc.。阿魏酸(≥99%)及维生素B2(≥98.2%)购自中国食品药品检定研究院。表儿茶素(≥98.01%)、原花青素B1(≥95.86%)及原花青素B2(≥97.06%)等标准品购自四川省维克奇生物科技有限公司。秦皮乙素(≥98%)、对香豆酸(≥99.9%)、丁香脂素二葡萄糖苷(≥98%)、苹果酸(≥98.2%)、柠檬酸(98.9%)、原儿茶酸(≥98%)、绿原酸(≥99.39%)、异绿原酸A(≥98%)、咖啡酸(≥99.7%)、桃叶珊瑚苷(≥98%)、京尼平苷酸(≥98%)、京尼平苷(≥98%)、车叶草苷酸(≥99.6%)、车叶草苷(≥98%)、芦丁(≥98%)、山奈酚(≥98%)、金丝桃苷(≥99.8%)、异槲皮苷(≥98%)、烟花苷(≥98%)、紫云英苷(≥98%)、槲皮苷(≥98.63%)、圣草酚(≥98%)、槲皮素(≥98%)、柚皮素(≥98%)等标准品购自上海源叶生物科技有限公司。
1.2 样本采集与制备
杜仲叶新鲜样本为初生嫩叶,取自河南省郑州市新密地区(北纬34°35'35",东经113°10'1")20 年树龄的杜仲树植株,取样日期为2022 年4 月1 日。将杜仲叶新鲜样本平均分成4 份,分别以冻干(G1:将样本置于SCIENTZ-18N/C型冷冻干燥机(宁波新芝生物科技股份有限公司),-50 ℃冻干)、热泵烘干(G2:将样本置于天赫伟业WKD430N 型热泵干燥箱(河南天赫伟业能源科技有限公司),50 ℃烘干)、电热烘干(G3:将样本置于DHG-9030A型电热恒温鼓风干燥箱(上海一恒科学仪器有限公司),50 ℃烘干)以及晒干(G4:将样本置于托盘放在阳光直射处晾干)4种干燥处理方式制成干燥叶,每种干燥处理设8 个重复,共32 个样本。将不同干燥处理获得的杜仲叶样本研磨成粉,并于-80 ℃避光保存。从32份杜仲叶粉末样本各取出0.5 g,混合均匀制备成质量控制样本(QC)。图1为不同干燥处理获得杜仲叶样本的分析流程。
1.3 样本分析
通过比较不同前处理及仪器条件下得到的峰数量、峰面积及一级、二级质谱数信息,优化得到样本前处理、液相色谱条件及质谱条件。
1.3.1 样本前处理称取20.0 mg杜仲叶样本于2 mL离心管,加入1.5 mL 80%甲醇-水提取溶剂,充分涡旋2 min 后于室温下超声提取30 min,以12 000 r/min 离心10 min。上清液转移至色谱瓶中用于高分辨质谱分析。
1.3.2 UHPLC-HRMS 仪器分析条件液相色谱条件:进样量:2 μL;Agilent ZORBAX SB-C18色谱柱(2.1 mm×100 mm,1.8 μm,美国安捷伦科技有限公司);柱温:40 ℃;流速:0.2 mL/min;流动相:A相为水(含0.1%甲酸),B相为乙腈(含0.1%甲酸);梯度洗脱程序:0~1 min,5%~8% B;1~7 min,8%~12% B;7~13 min,12%~20% B;13~20 min,20%~35% B;20~24 min,35%~55% B;24~25 min,55%~97% B;25~30 min,97%~100% B;30~35 min,100% B;35~35.5 min,100%~5% B。后运行4.5 min。
质谱条件:离子传输毛细管温度为320 ℃。电喷雾离子源(ESI源),分别在正离子(ESI+)、负离子(ESI-)扫描模式运行。喷雾电压为3 500 V(ESI+)、3 000 V(ESI-)。鞘气和辅助气均为氮气,流速分别为30 arb、10 arb(ESI+);35 arb、16 arb(ESI-)。采用FULL MS/DD-MS²(TOP4)模式进行数据采集。一级质谱扫描范围为120~1 000 Da。一级、二级质谱分辨率分别为35 000 FWHM、17 500 FWHM。两级质谱的自动增益控制(AGC)均为5e6。一级、二级质谱的最大注入时间分别为100 ms、25 ms。二级碎裂方式选择高能碰撞诱导裂解(HCD)模式,碰撞能量为20 eV,隔离窗口为0.4 Da,动态排除时间为4.5 s。
1.4 数据处理
采用Xcalibar(美国赛默飞世尔科技公司)完成UHPLC-HRMS 原始数据的采集。将数据文件导入AntDAS-LCHRMS 分析软件,自动实现EIC 峰构建、峰提取、峰对齐、峰注释、化合物注册等,最终获得EIC 峰面积×化合物样本的化合物信息列表。借助于方差分析(ANOVA)、层次聚类分析(HCA)和主成分分析(PCA)等化学计量学分析方法对上述化合物信息进行数据处理,得到具有差异性的化合物质谱谱图。将其与第三方公开的数据库(http://prime.psc.riken.jp/compms/msdial/main.html)进行比对实现化合物的鉴别。其中,部分化合物使用对照品进一步得到验证。此外,对差异性化合物进行热图分析以评价不同干燥处理杜仲叶中的化学成分变化。
2 结果与讨论
图2 为4 种不同干燥处理杜仲叶样本的总离子流色谱(TIC)图。由图可见,在正、负离子模式下均能够采集到杜仲叶样本中丰富的化学物质信息,在整个流出范围内TIC 峰的分离效果良好。然而,仅从TIC 色谱图上看,不同干燥处理下的杜仲叶无显著差异。因此,借助于代谢组学数据解析工具对获得的高通量数据进一步挖掘非常必要。将仪器采集的UHPLC-HRMS 原始数据直接导入AntDASLCHRMS 进行色谱峰的自动化提取。以正离子模式下的QC 样本为例,图3 给出了AntDAS-LCHRMS 软件平台的数据分析过程。
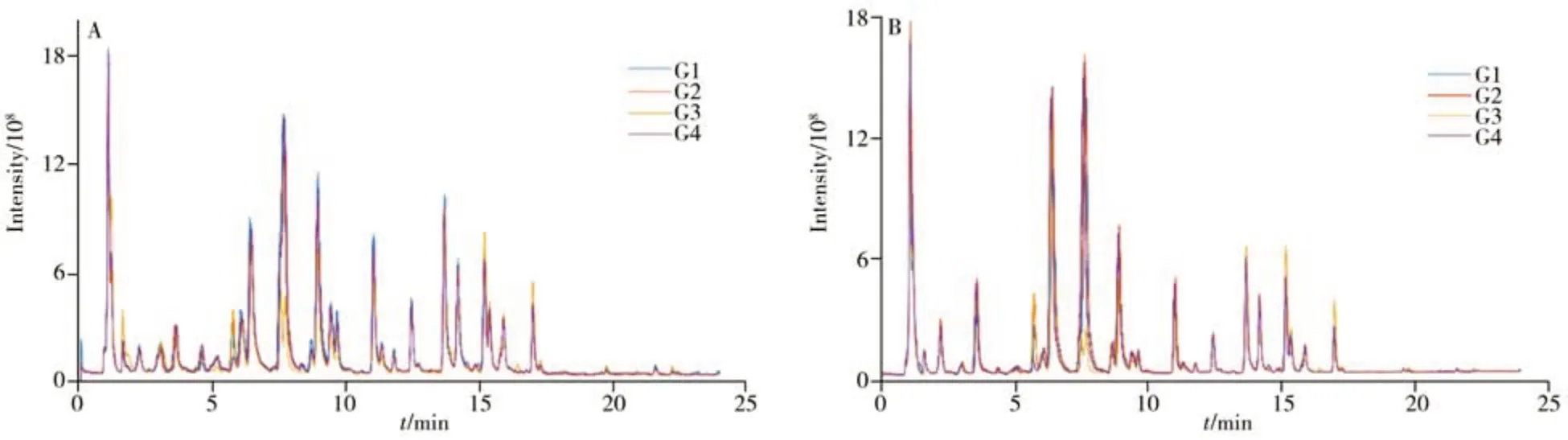
图2 不同干燥处理杜仲叶样本在正离子模式(A)与负离子模式(B)的总离子流色谱图Fig.2 TIC chromatograms of E. ulmoides Oliv. leaves in various drying treatments under the positive mode(A) and negative mode(B)
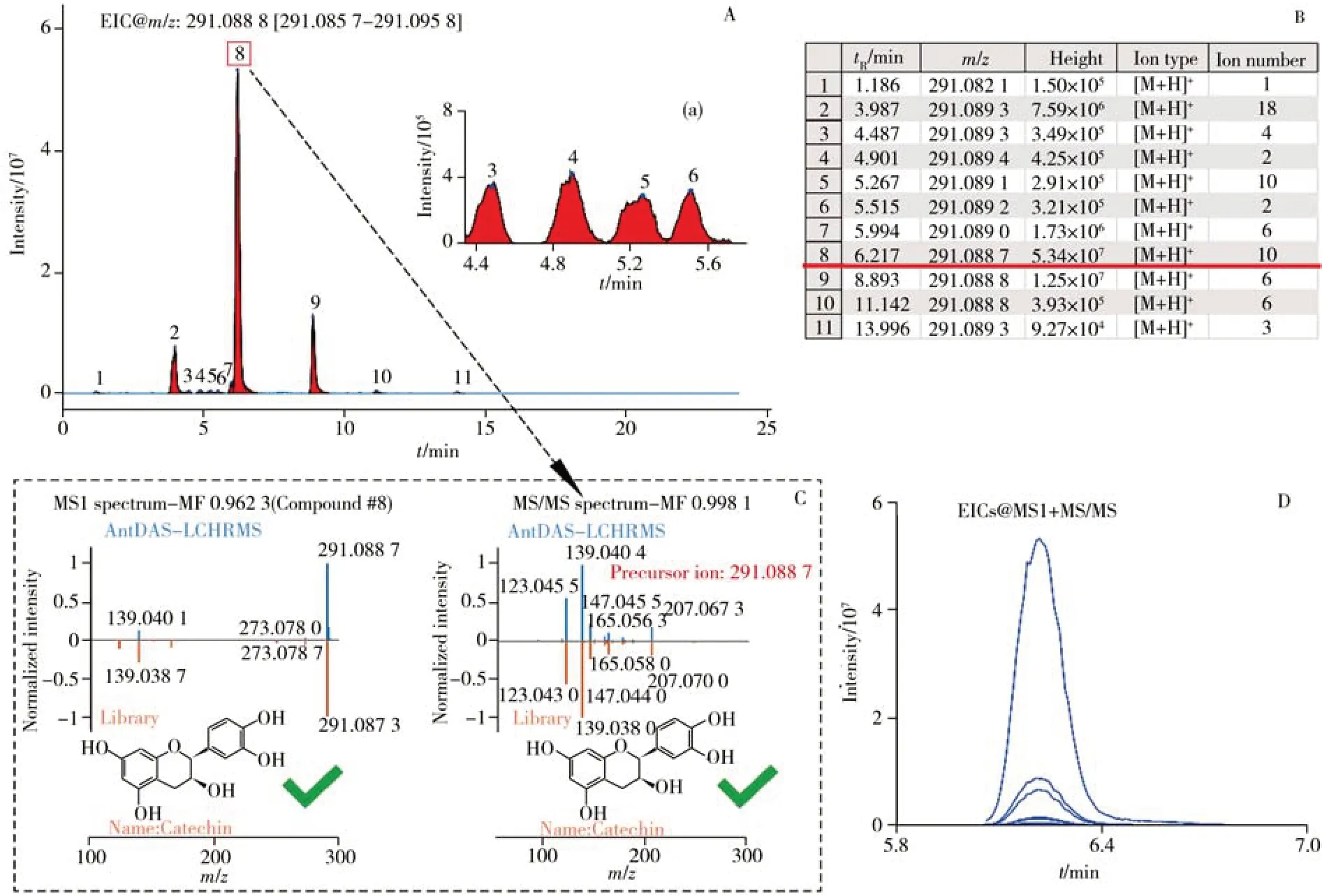
图3 利用AntDAS-LCHRMS进行UHPLC-HRMS数据分析示例Fig.3 Illustration of UHPLC-HRMS data analysis by AntDAS-LCHRMS
2.1 AntDAS-LCHRMS平台中化合物色谱峰的自动化提取
AntDAS-LCHRMS 可以完成所有EIC 峰提取及其m/z值的精确注释,进而识别[M+H]+、[M-H]-、[M+Na]+、[M-H2O+H]+、[M+FA-H]-等。利用AntDAS-LCHRMS 提取其中一个EIC(m/z291.088 8 Da)下所有色谱峰的示例见图3A。经解析提取1 个信号强度高的色谱峰(8 号)、2 个信号较高的色谱峰(2号、9号)和8个强度较低的色谱峰,共11个色谱峰。图3A(a)为4个强度较低的色谱峰(3~6号)的局部放大图,展示了AntDAS-LCHRMS 能够有效识别化合物信息,实现EIC 中色谱峰的高质量提取。提取EIC 对应的化合物注册表信息见图3B。利用AntDAS-HRMS 分别对不同干燥处理的杜仲叶样本在正、负离子模式下的数据进行分析,可获得两个大小分别为16 980 × 37(ESI+)和8 823× 37(ESI-)的化合物信息列表。信息表示EIC 峰数量分别为16 980 和8 823,样本数量为37(即不同干燥处理的杜仲叶样本32个和QC样本5个)。
AntDAS-LCHRMS 的数据分析性能通过QC 样本进行了统计研究。通过计算各EIC 峰面积的相对标准偏差(RSD),在正、负离子模式下分别对5 个QC 样本进行评估,结果如图4 所示。由图可见,正离子模式下,RSD 小于等于20%和30%的色谱峰数量分别为7 852 个和8 889 个,分别占总峰数量的46.2%和52.3%。负离子模式下,RSD小于等于20%和30%的色谱峰数量分别为4 632个和5 025个,分别占总峰数量的52.5%和57.0%。即使在RSD 低于10%的水平下,正、负离子模式下的峰数量分别达到总峰数量的22.9%和31.9%,表明该方法稳定可靠。负离子模式尽管在总峰数量上略低,但从RSD来看数据质量略优于正离子模式。
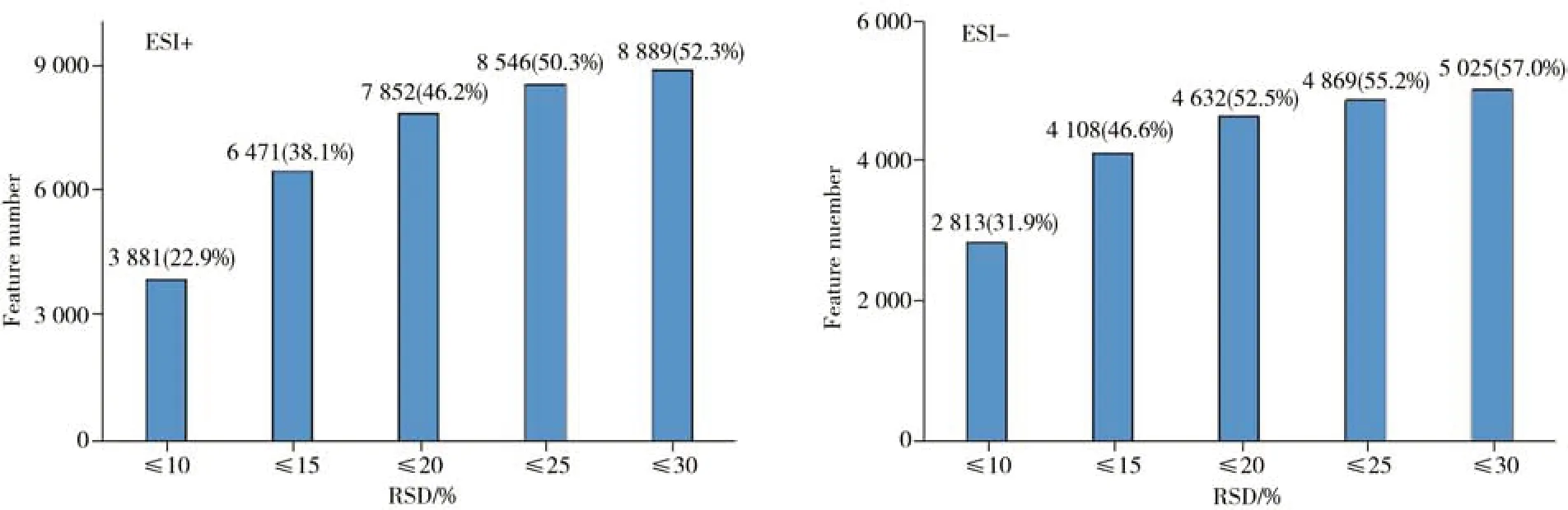
图4 基于质控样本的色谱峰面积相对标准偏差Fig.4 The relative standard deviations of chromatographic peak area based on QC samples
2.2 化合物鉴定
当同时分析多个样本时,AntDAS-LCHRMS 能够识别属于同一个化合物的源内碎片离子,并实现多样本信息的整合,给出化合物的一级(MS1)、二级(MS/MS)质谱谱图,与标准谱图比对可实现化合物鉴定。图3C 以儿茶素为例展示了基于AntDAS-LCHRMS 的化合物鉴别过程。通过AntDAS-LCHRMS解析对应图3A 中正离子模式下m/z291.088 7 Da 的注册化合物(#8),获得的EIC 峰有m/z123.045 5、139.040 4、147.045 5、165.056 3、207.067 3、273.078 0、291.088 7 等。AntDAS-LCHRMS 能够通过EIC 峰形(图3D)相似度计算来判别这些碎片离子是否来自同一成分,并完成化合物的质谱谱图构建(图3C)。由图可知,母离子为m/z291.088 7([M+H]+),该离子断裂后主要形成m/z139.040 4、123.045 5、147.045 5、207.067 3等碎片离子。将MS1、MS/MS谱图与第三方标准谱库中的谱图进行比对,化合物鉴定结果为儿茶素,其MS1、MS/MS的匹配度分别为0.962 3、0.998 1。
2.3 不同干燥处理杜仲叶样本的HCA和PCA分析
在AntDAS-LCHRMS平台中分别完成正、负离子模式下采集的UHPLC-HRMS原始数据分析后,对所获得的色谱峰注册表进行ANOVA 分析,得到不同干燥处理的杜仲叶样本中具有显著性差异的色谱峰,正离子模式下有6 253 个,负离子模式下有3 878 个。基于筛选出的所有差异性色谱峰,分别在两种模式下对不同干燥处理的杜仲叶样本进行HCA 和PCA 分析,如图5 所示。HCA 分析结果(图5A1、B1)显示,4 种干燥处理的杜仲叶样本聚类效果明显,各成一类。其中,冻干、热泵烘干、晒干3 种方式更为相似。PCA 分析结果(图5A2、B2)中前两个主成分代表了样本中约70%的信息。样本分布表明不同干燥处理的杜仲叶样本分别聚成一类,各类之间的分布距离存在明显不同,其中冻干、热泵烘干、晒干3种干燥处理的杜仲叶样本距离较为接近,电热烘干与其它处理距离较远。图5表明,不同干燥处理的杜仲叶样本在正、负离子模式下的HCA和PCA 分析结果一致,冻干、热泵烘干、晒干整体上更为接近,与电热烘干存在较大差异。
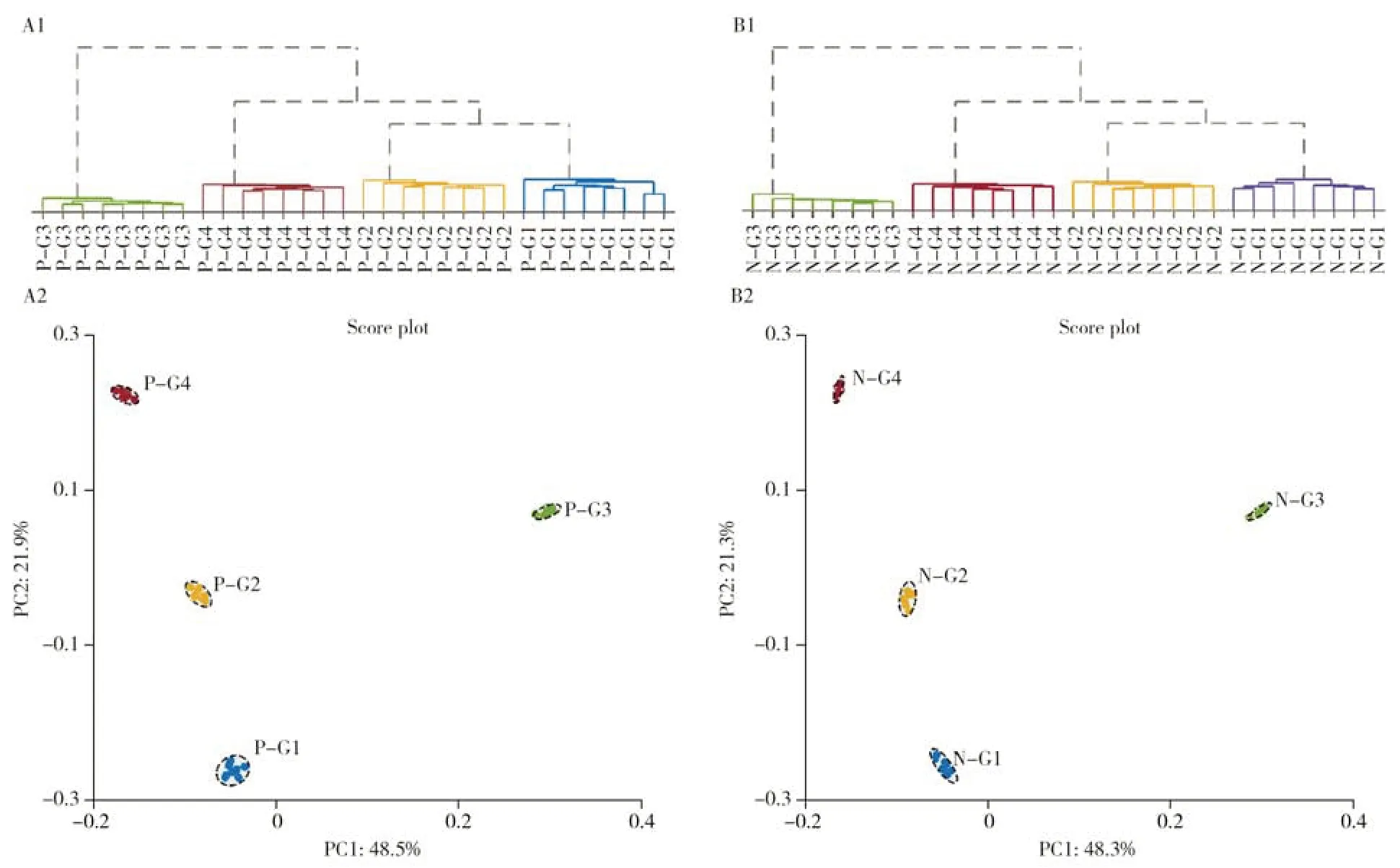
图5 不同干燥处理杜仲叶样本的HCA(A1、B1)和PCA(A2、B2)分析结果Fig.5 HCA(A1,B1) and PCA(A2,B2) analysis results of E. ulmoides Oliv. leaves in various drying treatments
2.4 不同干燥处理的杜仲叶样本中差异性化合物及其含量变化
基于“2.2”所述化合物鉴定流程,本研究融合正、负离子模式的识别结果共鉴定出71 种差异性化合物(见表1),进一步通过标准品验证可确定40 种化合物。其中,正离子模式下识别出59 种化合物,经验证的化合物为34 种,负离子模式下识别出56 种化合物,经验证的化合物为29 种。正、负离子模式均识别出的化合物有44种,其中有25种经过标准品验证。识别的化合物类别包括有机酸、环烯醚萜、黄酮、氨基酸、核苷、维生素、糖、木质素及香豆素类等,各类别化合物数量如图6 所示。识别的黄酮类物质数量在正离子模式下多于负离子模式,识别的有机酸类物质数量在负离子模式下多于正离子模式。正、负离子模式下的化合物鉴定可以同时利用两种模式下各自的优势,将碎片离子融合交叉验证避免错误匹配,有效提高了化合物识别能力,增加了匹配结果的可信度。

表1 AntDAS-LCHRMS鉴定的不同干燥处理杜仲叶中的差异性化合物Table 1 The significant differential compounds in E. ulmoides Oliv. leaves from various drying treatments identified by AntDAS-LCHRMS

图6 利用AntDAS-LCHRMS鉴定差异性化合物的数量Fig.6 The numbers of identified significant differential compounds by AntDAS-LCHRMS
根据识别的差异化合物的相对丰度,分别在正、负离子模式下进行热图分析(见图7)。结果表明,不同干燥处理杜仲叶样本中的化合物含量差异明显,整体上两种模式下的化合物均聚为两大组别。正离子模式下,图7A 中前33 种物质聚为一组,整体趋势为电热烘干含量较高,冻干、热泵烘干次之,晒干处理下含量最低;其余26种物质聚为一组,整体趋势为冻干含量较高,热泵烘干、晒干次之,电热烘干处理下含量最低。负离子模式下,图7B 中前25 种物质聚为一组,整体趋势为电热烘干含量较高,冻干、热泵烘干及晒干含量较低;其余31种物质聚为一组,冻干、热泵烘干及晒干含量较高,电热烘干含量较低。上述趋势与HCA 和PCA 分析结果一致。其中,维生素B5、谷氨酸、阿魏酸、绿原酸、异绿原酸、咖啡酸以及车叶草苷、京尼平苷酸、原花青素B2、芦丁、金丝桃苷、柚皮素等化合物在冻干下含量较高。车叶草苷酸、桃叶珊瑚苷、异槲皮苷、烟花苷、紫云英苷、槲皮苷、圣草酚、山奈酚、鸟苷、腺苷等化合物在电热烘干下含量最高。蔗糖、甲硫腺苷、原花青素B1、樱桃苷、木犀草素-4'-O-葡萄糖苷等在热泵烘干下含量最高。赖氨酸、精氨酸、苯丙氨酸、色氨酸、异绿原酸A、京尼平苷等化合物在晒干下含量最高。化合物含量变化与样本在干燥过程的暴露时间、干燥温度及干燥速度有关,冻干及晒干对温度敏感的有机酸、维生素、氨基酸等成分的影响较小。研究表明,植物中黄酮类化合物在植物体内的生物合成和代谢受多个酶的控制,如苯丙氨酸解氨酶(PAL)及查耳酮合成酶(CHS)的调控,较高的温度可使酶失活,从而减少黄酮类成分的降解[20]。推测可能是电热烘干温度高且干燥速度较快,易使杜仲叶中的酶失活,所以在黄酮类物质的积累上有较好保留。而晒干与其他干燥处理相比,温度条件对酶活性更为友好,黄酮类成分更易分解,含量相对略低。
正、负离子模式下均准确识别并经过标准品验证的25 种化合物,按类别包括糖类1 种、氨基酸类2 种、核苷类2 种、维生素类1 种、有机酸类2 种、环烯醚萜类5 种、黄酮类12 种。图8 为经标准品验证的差异性化合物在不同干燥处理杜仲叶中各类别物质的含量分布情况。该图清晰地展示了各类化合物在正、负离子模式下的响应以及不同干燥处理中的变化。从不同离子模式看,正离子模式下响应较高的物质为糖类、氨基酸类、核苷类、维生素类化合物;负离子模式下响应较高的物质包括有机酸类、环烯醚萜类、黄酮类化合物。该结果可为靶向分析时选择合适的离子模式提供指导。从不同干燥处理的样本变化看,各干燥处理样本在正、负离子模式下的含量变化趋势一致。维生素类物质在冻干样本中含量最高,在热泵烘干样本中含量最低。氨基酸类物质在晒干样本中含量最高,在电热烘干样本中含量最低。环烯醚萜类、有机酸类、糖类等物质在热泵烘干时含量最高,冻干与热泵烘干含量比较接近,电热烘干下含量最低。核苷类、黄酮类物质在电热烘干处理下含量最高。黄酮类物质在冻干、热泵烘干及晒干中差异较小,略低于电热烘干。
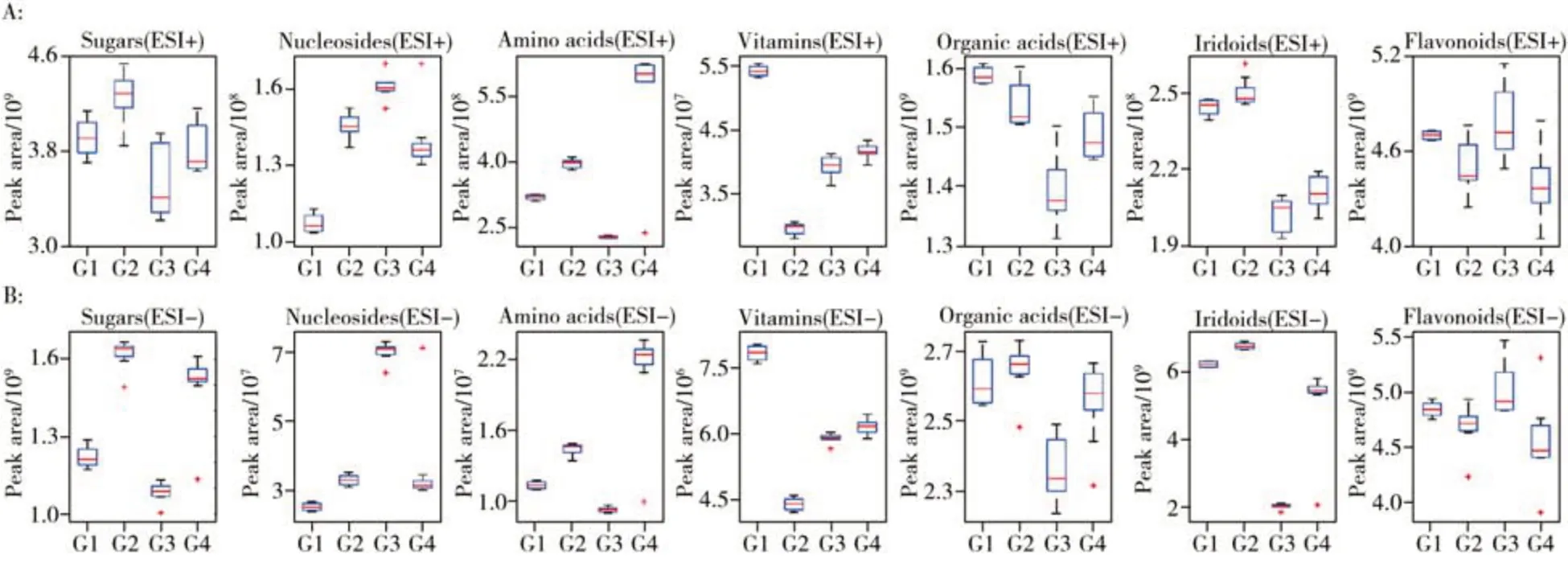
图8 验证的差异性化合物在不同干燥处理杜仲叶中的峰面积分布Fig.8 Peak areas distribution of the confirmed significant differential compounds in E. ulmoides Oliv. leaves from various drying treatments
通过化学计量学数据分析软件AntDAS-LCHRMS 结合液质联用技术对不同干燥处理的杜仲叶进行非靶向代谢组学分析,能够准确识别杜仲叶样本中的化合物,有效区分不同干燥处理下的杜仲叶样本。综合利用正、负离子模式下的数据信息,提高了化合物识别能力和准确度,为杜仲叶的成分分析提供了新的研究思路。
3 结 论
本文提出基于UHPLC-Q-Exactive Orbitrap HRMS 的非靶向代谢组学技术结合数据自动解析软件AntDAS-LCHRMS用于4种不同干燥处理杜仲叶样本中的化合物分析,评价了不同干燥处理对杜仲叶中化学物质基础及特定活性成分保留的影响。借助该策略最终鉴别出不同干燥处理下具有显著性差异的71种化合物,其中40种化合物经过标准品验证。综合正、负离子模式结果,氨基酸类物质在晒干处理下含量高,环烯醚萜类、有机酸类、糖类等物质在冻干及热泵烘干处理下含量较高,核苷类、黄酮类物质在电热烘干处理下含量较高,黄酮类物质在冻干、热泵烘干及晒干中差异较小。本研究不仅为不同干燥处理的杜仲叶化学成分分析及其精深加工提供科学依据,同时表明AntDAS-LCHRMS 可为其他药用植物干燥加工品质的评价提供新的手段。

