胃癌中lncRNA HOXA-AS2的表达及其对胃癌细胞生物学行为的影响
吴 航 费哲为
胃癌是最常见的消化系统恶性肿瘤之一,世界范围内其发生率和病死率分别居于所有恶性肿瘤的第5位和第4位[1]。目前胃癌在我国仍是发生率居于首位的消化系统恶性肿瘤,严重威胁我国国民健康[2]。尽管近年来胃癌的诊疗取得了很大的进步,以手术治疗、化疗、放疗和免疫治疗为主的综合治疗显著改善了胃癌患者的生活质量和生存期限[3]。但由于胃癌早期往往没有典型症状,导致部分患者被诊断时已丧失手术机会,晚期胃癌患者的生活质量和预后仍不能令人满意[4]。因此,迫切需要探究胃癌发生和发展的详细分子机制,以获得更有效的治疗策略。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200个核苷酸的RNA分子,其中一些lncRNA具有编码功能性微肽的能力[5]。越来越多的研究表明,lncRNA在肿瘤发生和发展的过程中起到重要作用。近年来,多种与胃癌相关的lncRNA分子被发现,例如H19、MALAT1、HOTAIR等可通过调控胃癌细胞的增殖、迁移和侵袭能力继而影响胃癌的恶性生物学行为[6~8]。lncRNA HOXA-AS2是位于HOXA3基因和HOXA4基因之间的长度为1048个碱基的RNA分子,多项研究表明lncRNA HOXA-AS2在乳腺癌、前列腺癌、胰腺癌等多种癌症中异常表达且发挥癌基因的功能[9~11]。然而,关于lncRNA HOXA-AS2在胃癌中所发挥的作用仍不清楚,因此本研究的主要目的是探究lncRNA HOXA-AS2在胃癌组织中的表达情况及其对胃癌细胞恶性生物学的影响。
资料与方法
1.临床样本和资料:回顾性分析2020年2~12月笔者医院收治的45例胃癌患者的临床及病理资料。纳入标准:①患者在手术前未接受过放疗及化疗;②术后病理明确诊断为胃癌;③患者未合并其他原发恶性肿瘤。术中取胃癌组织及距离胃癌5cm以上的癌旁组织迅速放入液氮快速冷冻,后期统一于-80℃冰箱保存。所有入组胃癌患者均签署书面知情同意书,本研究通过笔者医院医学伦理学委员会批准(伦理学审批号:CMEC-2021-KT-02)。
2.细胞系和主要试剂:人正常胃黏膜上皮细胞GES和人胃癌细胞系BGC-823、HGC-27、SGC-7901、MGC803及MKN-45购自中国科学院细胞库(上海);DMEM、RMPI-1640培养基、胰酶和胎牛血清购自美国Gibco公司;LipofectamineTM2000购自美国Invitrogen公司;Trizol试剂购自上海碧云天生物技术公司;CCK-8试剂盒购自日本同仁化学科技公司;反转录试剂盒和荧光定量PCR试剂盒购自南京诺唯赞生物科技公司;Transwell小室购自美国Corning公司;lncRNA HOXA-AS2、GAPDH引物使用primer5软件设计,由生工生物工程(上海)股份有限公司合成,lncRNA HOXA-AS2 siRNA由上海吉满生物科技公司设计合成。
3.lncRNA HOXA-AS2相对表达水平的检测:使用Trizol提取组织和细胞中的总RNA,根据反转录和荧光定量PCR试剂盒说明书进行反转录和荧光定量PCR反应。lncRNA HOXA-AS2引物序列为:上游引物:5′-CACGCTTTTCCCGTAGGAAG-3′,下游引物:5′-CTGCTCCAAAACTCTTCGCC-3′;内参GAPDH引物序列为:上游引物:5′-CAACAGCCTCAAGATCATCAGC-3′,下游引物:5′-TTCTAGACGGCAGGTCAGGTC-3′。按照制造商的说明进行荧光定量PCR的实验,所有实验重复3次,用2-ΔΔCt方法计算相对基因表达水平。
4.生物信息分析:利用生物信息分析在线网站Kaplan-Meier Plotter分析lncRNA HOXA-AS2对胃癌患者预后的影响。
5.细胞分组和转染:人胃癌细胞系HGC-27和MKN-45在补充有10%胎牛血清和抗生素的培养基中培养。在细胞处于对数生长期时将其接种在6孔板中并分为对照(NC)组,Si1组和Si2组进行转染。所有操作严格按照LipofectamineTM2000说明书进行,转染24h后,提取细胞总RNA,按照诺唯赞反转录试剂盒说明书反转录为cDNA,以cDNA为模板进行实时荧光定量PCR(RT-qPCR)反应,以2-ΔΔCt计算目的基因的相对表达水平,验证siRNA的敲减效果。
6.细胞增殖能力检测:采用CCK-8法。将转染后的SiNC、Si1和Si2 3组细胞分别制成单细胞悬液,在96孔板中分别接种转染后的HGC-27和MKN-45细胞,每孔3000个细胞,每组设置6个复孔,分别在培养后0、24、48和72h 4个时间点避光加入含10μl CCK-8的培养基(100μl)检测HGC-27和MKN-45细胞的增殖情况,并在37℃下避光孵育2h,然后使用酶标仪记录每个孔在450nm处的吸光度(A)值。
7.克隆形成实验:将转染后的胃癌细胞以每孔500个细胞的密度接种至6孔板中,每3天换液1次,连续培养2周。在预定的时间点加入4%多聚甲醛固定15min。并在常温下加入浓度为0.5%的结晶紫溶液染色15min,洗净培养板,进行拍照和统计分析。
8.划痕实验:将转染后的细胞接种到6孔板中,每孔约5×105个细胞,确保过夜后细胞长满,第2天利用枪头进行划痕,每孔等间隔划4条直线,加入PBS洗去未贴壁细胞,加入不含血清的培养基,在37℃恒温培养箱中培养24h,使用倒置相差显微镜进行拍照并进行统计分析。
9.Transwell侵袭实验:取处于对数生长期的转染后的细胞,使用0.25%的胰蛋白酶消化,用培养基制备成单细胞悬液,接种到含Matrigel基质胶的Transwell小室的上室(100μl),下室添加600μl含10%胎牛血清的完全培养基,培养24h后,使用4%多聚甲醛固定10min后使用0.5%的结晶紫染色10min。显微镜下拍照并统计迁移细胞数量。

结 果
1.lncRNA HOXA-AS2在胃癌组织和细胞中的表达:荧光定量PCR结果表明,与癌旁组织比较,lncRNA HOXA-AS2在胃癌组织中的表达水平显著上升,差异有统计学意义(P<0.01,图1A);lncRNA HOXA-AS2 在所有检测胃癌细胞系中的表达水平均高于人正常胃黏膜细胞系GES,差异有统计学意义(P<0.01,图1B),其中以HGC-27和MKN-45细胞的表达水平最高(P<0.001,图1B),因此选取这两株细胞系进行后续细胞功能实验。
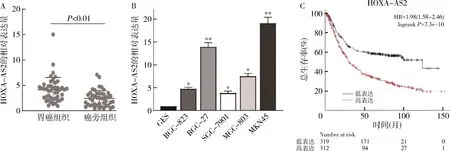
图1 lncRNA HOXA-AS2的表达与生存分析
2.lncRNA HOXA-AS2与胃癌患者生存分析:通过生物信息分析在线网站Kaplan-Meier Plotter分析lncRNA HOXA-AS2对胃癌患者预后的影响,公共数据库结果表明,lncRNA HOXA-AS2高表达组的总生存期为30.2个月低于lncRNA HOXA-AS2低表达组的123.8个月,差异有统计学意义(P<0.05,图1C)。
3.lncRNA HOXA-AS2 与胃癌患者临床病理特征的关系:为探讨胃癌组织中lncRNA HOXA-AS2表达水平的临床意义,根据胃癌组织中lncRNA HOXA-AS2的表达情况,将患者分为高表达组(n=25)和低表达组(n=20)。统计分析结果表明,lncRNA HOXA-AS2的高表达水平与与胃癌分期,淋巴结转移和分化程度相关(P<0.05),但lncRNA HOXA-AS2的表达水平与患者的年龄、性别、肿瘤直径无关(P>0.05,表1)。

表1 45例胃癌组织中lncRNA HOXA-AS2表达与临床病理特征关系(n)
4.siRNA转染效果:细胞转染24h后,通过荧光定量PCR检测lncRNA HOXA-AS2的表达水平探究siRNA的转染效果,结果表明,Si1和Si2均能成功干扰HGC-27和MKN-45细胞系中lncRNA HOXA-AS2的表达水平(P<0.05,图2)。
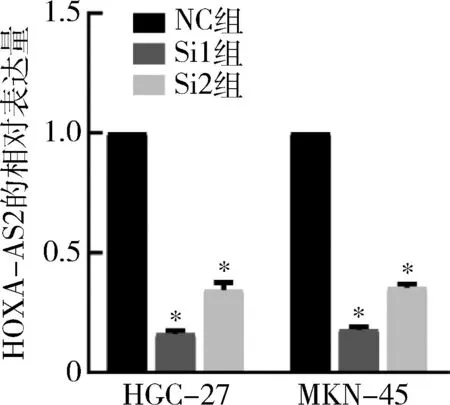
图2 siRNA转染后HGC-27和MKN-45细胞中lncRNA HOXA-AS2的表达
5.敲减lncRNA HOXA-AS2对HGC-27和MKN-45细胞增殖能力的影响:敲低lncRNA HOXA-AS2后利用CCK-8法检测HGC-27和MKN-45细胞的增殖能力,与SiNC组比较,Si1组和Si2组HGC-27、MKN-45的细胞增殖能力显著下降(P<0.05,图3)。
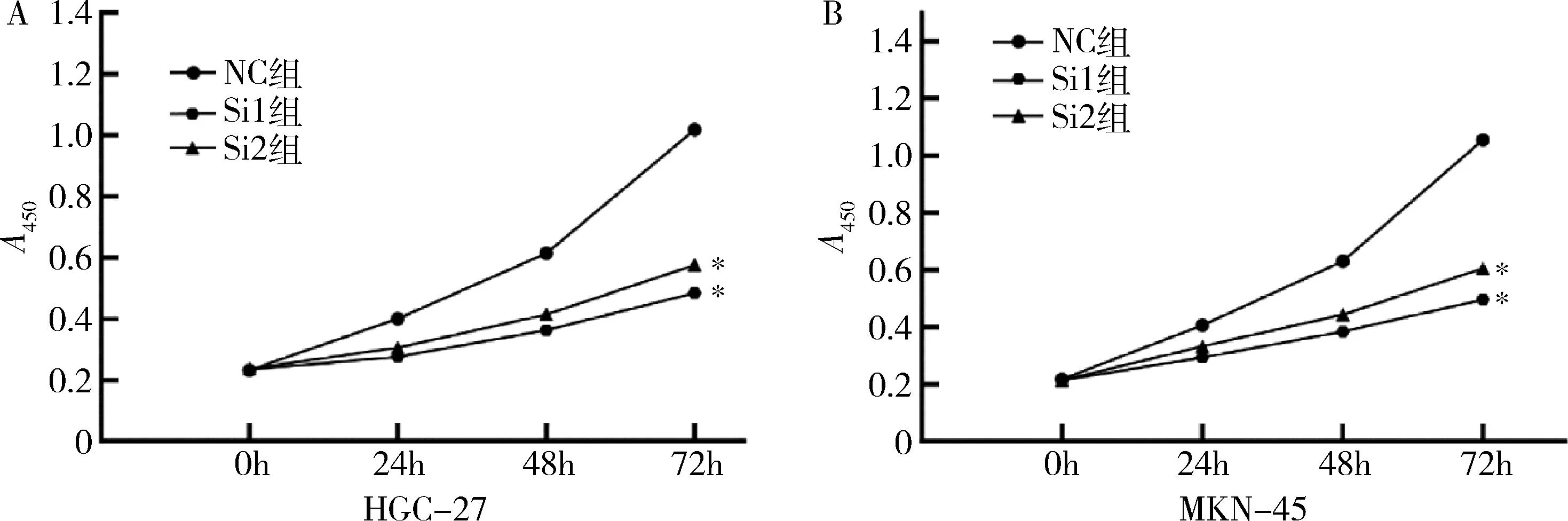
图3 敲减lncRNA HOXA-AS2后对HGC-27(A)和MKN-45(B)细胞增殖能力的影响
6.敲减lncRNA HOXA-AS2对HGC-27和MKN-45细胞克隆形成能力的影响:NC组、Si1组和Si2组HGC-27细胞的克隆数目分别为321.00±32.15、70.00±3.30、135.00±9.26;NC组、Si1组和Si2组MKN-45细胞的克隆数目分别为395.00±23.90、106.50±11.52、190.00±18.38。与NC组比较,敲减lncRNA HOXA-AS2可显著减少HGC-27和MKN-45细胞的克隆集落数目(P<0.05,图4)。

图4 沉默lncRNA HOXA-AS2对HGC-27和MKN-45细胞克隆能力的影响
7.敲减lncRNA HOXA-AS2对HGC-27和MKN-45细胞迁移能力的影响:如划痕实验结果所示(图5),NC组HGC-27和MKN-45细胞的迁移愈合率分别为69.12%±6.23%和57.38%±4.34%;HGC-27细胞Si1组和Si2组的细胞迁移愈合率分别为17.37%±2.18%和29.72%±3.36%;MKN-45细胞Si 1组和Si 2组的细胞迁移愈合率分别为13.55%±1.20%和24.89%±2.06%。与NC组比较,敲减lncRNA HOXA-AS2可显著降低HGC-27和MKN-45细胞的迁移(P<0.05)。

图5 沉默 lncRNA HOXA-AS2后对HGC-27和MKN-45细胞迁移能力的影响
8.敲减lncRNA HOXA-AS2对HGC-27和MKN-45细胞侵袭能力的影响:NC组HGC-27和MKN-45细胞侵袭数分别为424.00±32.89和381.00±35.03;Si1组HGC-27和MKN-45细胞侵袭数分别为68.00±5.70和97.00±8.58;Si2组HGC-27和MKN-45细胞侵袭数分别为122.00±7.82和198.00±10.70。与NC组比较,敲减lncRNA HOXA-AS2可显著降低HGC-27和MKN-45细胞的侵袭能力(P<0.05,图6)。
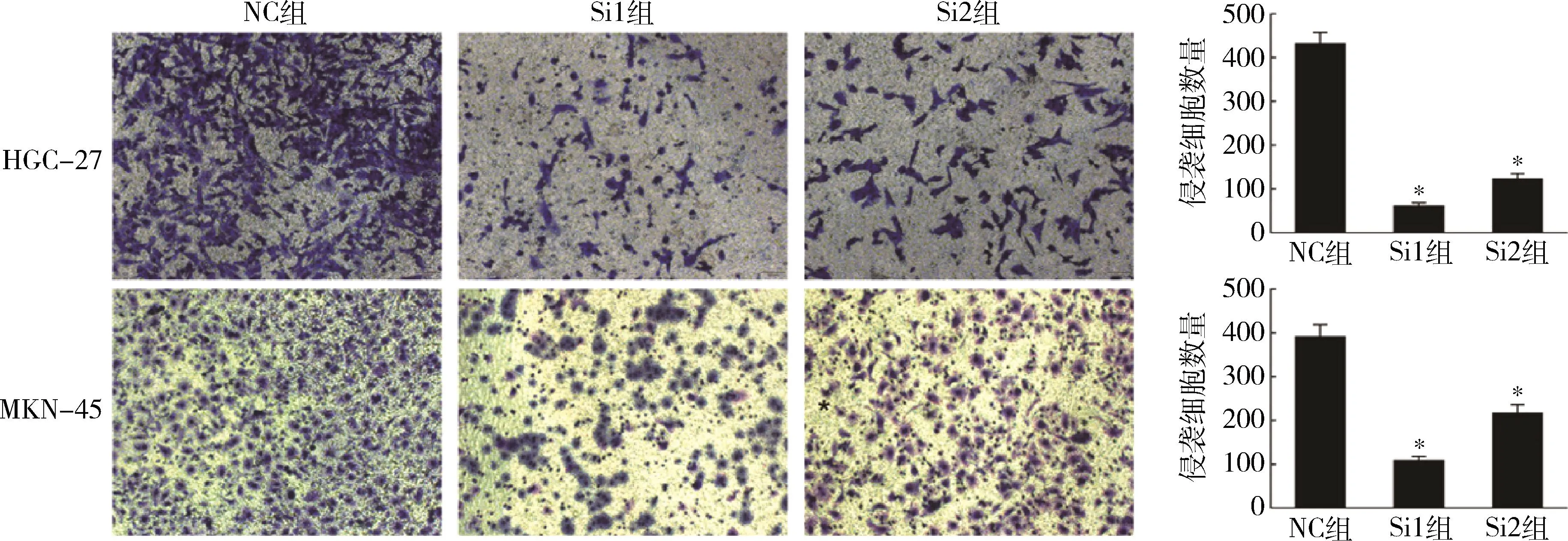
图6 沉默lncRNA HOXA-AS2对HGC-27和MKN-45细胞侵袭能力的影响
讨 论
近年来,胃癌的诊疗取得了很大的进步,特别是以手术治疗、化疗、放疗和新辅助化疗为主的综合治疗的实施,早期胃癌患者的5年生存率已达到95%[12]。但由于胃癌早期缺乏典型的症状,大部分患者被诊断时已错过手术治疗的最佳时期,伴有局部和远处转移的晚期胃癌患者的5年生存率还不足20%[13]。当前,针对晚期胃癌患者的治疗主要以化疗和靶向疗法为主,然而药物的毒性不良反应以及耐药性的产生往往导致晚期胃癌患者较差的预后和生活质量的降低[14]。因此,阐明胃癌发生和转移的分子机制,为胃癌患者寻求新的治疗策略是极其必要的。
测序技术的进步使得人们能够更深入的进行基因组学和转录组学分析。研究发现,人类基因组只有不到2%的转录本可以翻译成蛋白质,其余98%的转录本被称为非编码RNA(non-coding RNA,ncRNA)[15]。ncRNA虽然不编码蛋白质,但其在细胞生物学活动中发挥着重要作用,长度超过200个核苷酸的ncRNA被称为lncRNA[16]。越来越多的研究表明,lncRNA直接或者间接参与肿瘤的发生和发展的分子机制,调节不同的细胞信号通路,并表现出致癌或抑癌作用[15]。Hu等[17]研究发现胆囊癌中lncRNA HGBC的表达水平显著上调,高表达的lncRNA HGBC与患者的不良预后相关,进一步探究相关机制发现,lncRNA HGBC可通过海绵化miR-502-3p继而激活Akt信号转导通路促进胆囊癌的进展。Dong等[18]利用微阵列对曲妥珠单抗耐药细胞及亲代细胞进行测序分析,结果表明lncRNA TINCR的表达水平在曲妥珠耐药细胞系中显著上调,进一步研究发现lncRNA TINCR不仅可以通过上调HER-2的表达来诱导乳腺癌细胞曲妥珠单抗耐药性的产生,其还可以靶向Snail-1诱导上皮间充质转化进一步加强乳腺癌细胞对曲妥珠单抗的耐药性。诸多报道证实,lncRNA HOXA-AS2在多种癌症中失调,其失调可促进多种癌症的发生、发展,但lncRNA HOXA-AS2在胃癌中的表达水平及所发挥的作用目前仍不清楚。
本研究表明,与癌旁组织比较, lncRNA HOXA-AS2在胃癌组织中的表达水平显著升高,提示其在胃癌中可能发挥致癌基因的作用,进一步验证lncRNA HOXA-AS2在人正常胃黏膜细胞和人胃癌细胞系中的表达水平发现,lncRNA HOXA-AS2在人胃癌细胞系中的表达显著上调。通过在线生信网站分析了lncRNA HOXA-AS2的表达水平与胃癌患者预后之间的关系,结果表明lncRNA HOXA-AS2低表达组的胃癌患者的总生存期要远长于lncRNA HOXA-AS2高表达组胃癌患者的生存期,提示lncRNA HOXA-AS2的表达水平还与胃癌患者的预后密切相关。接下来分析了lncRNA HOXA-AS2的表达水平与患者临床病理特征之间的关系,统计分析结果表明,lncRNA HOXA-AS2的表达水平与与肿瘤分期,淋巴结转移和分化程度相关,而与患者的年龄、性别、肿瘤大小无关。进一步探究了lncRNA HOXA-AS2的表达水平对胃癌细胞恶性生物学的影响,并成功利用siRNA下调了胃癌细胞株中lncRNA HOXA-AS2的表达。体外实验结果表明,敲减lncRNA HOXA-AS2的表达水平后,胃癌细胞的增殖、迁移和侵袭能力均被抑制,表明lncRNA HOXA-AS2在胃癌细胞中充当促癌基因。
综上所述,本研究初步证实lncRNA HOXA-AS2在胃癌中发挥促癌分子作用。lncRNA HOXA-AS2在胃癌组织和细胞中的表达显著上调。lncRNA HOXA-AS2的高表达与胃癌分期、淋巴结转移、组织分化程度、预后呈正相关。敲低lncRNA HOXA-AS2的表达后显著抑制了胃癌细胞增殖、迁移和侵袭能力,结果提示 lncRNA HOXA-AS2可能在胃癌中发挥促癌基因的作用,但lncRNA HOXA2促进胃癌发生、发展的相关机制还需开展进一步研究予以证实。

