2型糖尿病合并代谢相关脂肪性肝病患者血清同型半胱氨酸与肝纤维化的相关性
李卓奇,王嘉欣,唐晚晴,姜 雪,张 川
(吉林大学第二医院 内分泌科,吉林 长春130041)
非酒精性脂肪性肝病(NAFLD)是最常见的肝脏疾病之一。根据2020年国际专家共识,NAFLD最近被重新命名为代谢相关脂肪性肝病(MAFLD)[1]。据估计,全球的MAFLD患病人口在10亿左右,而MAFLD又常常与过度肥胖、2型糖尿病(T2DM)及血脂异常等代谢性疾病相关。全世界约有50%至75%的T2DM患者存在MAFLD,同样在MAFLD患者中,T2DM或空腹血糖受损的患病率为18%至33%[2]。胰岛素抵抗影响肝细胞脂肪酸的代谢,增加了肝脏内的游离脂肪酸和甘油三酯合成,这一过程加重了肝脏脂肪变性的程度。同时脂毒性会使肝细胞发生碎片状坏死,虽然肝脏具有强大的再生愈合能力,但在部分MAFLD患者中,肝脏愈合的速度小于肝细胞坏死的速度,随着肝脏愈合反应增强,肝细胞损伤变为进展性,坏死的肝细胞逐渐累积增多。大量坏死的肝细胞积聚和参与损伤愈合反应的免疫细胞、肌成纤维细胞、活化内皮细胞、肝祖细胞群扩张会导致肝脏炎症、肝纤维化、血管重塑和肿瘤。所以T2DM合并MAFLD的患者更容易发生进展性肝病如肝纤维化、肝硬化和肝细胞癌及心血管疾病。而肝移植、肝脏相关事件及心血管死亡都被认为与肝纤维化独立相关[3-4]。同型半胱氨酸(HCY)是一种含硫氨基酸,主要在肝中代谢与合成,并参与甲硫氨酸循环,其生成的甲硫氨酸为体内的甲基化反应提供原料。血清中的HCY被认为是动脉粥样硬化性发生血栓性血管病变的独立危险因素,此外HCY还可以促进肝脏脂肪累积。然而既往的研究表明HCY与MAFLD之间的关系仍然存在争议[5-7]。近年来,瞬时弹性成像作为诊断肝纤维化的无创性最新技术,在临床中的应用越来越广泛。本研究通过肝脏超声影像和瞬时弹性成像测定肝硬度值(LSM) 及受控脂肪衰减参数(CAP)对脂肪性肝病进行分期,为探讨2型糖尿病合并代谢相关脂肪性肝病患者血清中同型半胱氨酸与肝纤维化程度的相关性提供依据。
1 资料与方法
1.1 一般资料收集于2020年10月—2021年9月之间就诊的T2DM合并MAFLD患者。纳入标准:(1)年龄18岁~70岁;(2)根据WHO1999年诊断标准符合2型糖尿病;(3)根据2020年国际专家共识符合MAFLD的诊断标准。排除标准:(1)有病毒性肝炎或其他慢性肝病病史;(2)重度的肾功能不全;(3)合并急性心肌梗死,心功能不全(NYHA III级、IV级)及脑血管疾病等;(4)妊娠及哺乳期妇女;(5)近期补充过维生素B及叶酸。共纳入患者214例,在本研究中,将显著脂肪变性的临界值设定为大于或等于260 dB/m,LSM<8.0 kPa则不考虑有明显肝纤维化,将纳入的患者分为两组:CAP≥260 dB/m、LSM<8.0 kPa的患者,考虑只有晚期脂肪变性,无明显纤维化;CAP评分≥260 dB/m、LSM评分≥8.0 kPa的患者,考虑为晚期脂肪变性,并伴有进展期肝纤维化[8-9]。本研究已获得伦理委员会批准。
1.2 方法采集患者的基本资料,包括年龄、性别。采用标准的临床实验室技术,收集受试者的实验室指标[空腹血糖(FPG)、糖化血红蛋白(HbAlc)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(γ-GT)、尿酸(UA)及HCY]。测量受试者禁食8 h后赤脚、穿便衣时的身高和体重。用体重与身高的平方的比值计算BMI,用稳态模型计算胰岛素抵抗指数(HOMA-IR):空腹血糖(mmol/l)×胰岛素(mU/l)/22.5;采用瞬时弹性成像法(FibroScan)测得LSM及CAP:由一名接受过良好培训并能严格遵循操作规范,操作经验>500次的专业技术人员对受试者进行检测,指导受试者在空腹的情况下呈仰卧位,右手枕于头下,将耦合剂涂抹于检测处,将探头放置于右侧腋前线至腋中线的第7、8、9肋间,始终保持探头与皮肤紧贴并垂直,BMI≤28 kg/m2时采用M型探头,BMI≥28 kg/m2时采用XL型探头,胸围<75 cm的肋间隙狭窄者采用S型探头,同一检测点至少成功检测10次,检测值的四分位间距与中位数的比值小于0.3为有效。
1.3 统计学处理采取IBM SPSS25.0对数据进行分析,计量资料用平均值±标准差表示,组间比较使用独立样本t检验或Mann-Whitney 检验;计数资料的组间相比采取χ2检验;用Spearman对非正态分布的连续变量与肝纤维化进行相关性统计分析;Kolmogorov-Smirnov查验变量是否服从正态分布;同时将单因素分析中有统计学意义的变量纳入多因素回归中,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料及血液化验指标对比相较于非肝纤维化组,肝纤维化组的HOMA-IR、BMI、ALT、AST、γ-GT、UA、CAP、HCY更高,差异有统计学意义(P<0.05),两组年龄、性别、FPG、HbA1c、TG、TC、LDL-C、HDL-C无明显差异(P>0.05),见表1。
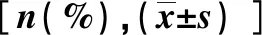
表1 两组一般资料及血液化验指标
2.2 LSM与不同变量的相关性Spearman相关分析:BMI、HOMA-IR、ALT、AST、γ-GT、UA、CAP、HCY与LSM呈正相关(P<0.05),见表2。

表2 Spearman相关系数分析LSM与变量之间的相关性
2.3 影响LSM因素的线性回归分析单因素线性回归分析:LSM与BMI、HOMA-IR、ALT、AST、γ-GT、UA、CAP、HCY存在关联(P<0.05)。多因素线性回归分析:BMI、HOMA-IR、AST、γ-GT、HCY与肝纤维化程度独立相关(P<0.05),见表3。

表3 肝纤维化程度与多因素线性回归分析(因变量:LSM,R2:0.312,调整后R2:0.285)
3 讨论
近年来,随着T2DM及过度肥胖人数的不断增加,MAFLD的发病率也随之逐步上升。多数初期肝纤维化患者没有特异性症状、体征及异常的血液生化指标,所以有必要及早对肝纤维化发生的危险因素进行干预。肝脏穿刺活检因其有创性和相关并发症的发生使之无法进行大范围的应用。而近年来FibroScan作为一种安全、无创、快捷、简便的定量检测肝纤维化的有效方式,已广泛应用于临床中,但仍有其局限性。如能根据血清标志物反应肝纤维化的严重程度,将更有利于临床早期诊断和精准防治。我们的研究显示,肝纤维化组患者BMI,HOMA-IR、TG、TC、ALT、AST、UA、CAP、HCY显著升高,肝纤维化程度与BMI、HOMA-IR、TC、ALT、AST、γ-GT、UA、CAP、HCY呈正相关,在调整了混杂因素后BMI、HOMA-IR、AST、γ-GT 、HCY仍然是所有T2DM合并MAFLD患者肝纤维化的危险预测因子。
目前已经确定体重增加和胰岛素抵抗是导致MAFLD进展最重要的因素。一项包含接受了肝活检的261名患者的前瞻性队列研究发现[10],全部体重减轻超过10%的患者MAFLD活动评分均降低,90%的相关脂肪性肝炎(MASH)患者得以缓解。同时体重降低大于10%可以使肝纤维化程度得到逆转,体重降低大于5%可以使肝纤维化程度趋于稳定。内脏脂肪的堆积会导致炎性因子和脂肪因子增加、内皮功能障碍,这一过程在肝脏损伤中发挥关键作用。肠道菌群异常会使宿主发生肥胖、肝脏脂肪变性、MASH、肝纤维化的概率增高。而肥胖、饮食结构、进食频率也会反过来影响肠道菌群,使肠道通透性发生改变,宿主从而更容易受到细菌脂多糖等肠源性有害因子的影响。同样一项包含了3841名参与者的队列研究也表明[11],MAFLD的患病率与BMI呈正相关,同时在肥胖群体中,与非糖尿病人群相比,合并糖尿病的患者中度和高度肝纤维化风险的比例分别增加了1.8倍和2.5倍,上述研究与本研究结论一致。其机制大概如下:处于胰岛素抵抗的状态时,脂肪细胞生成了更多的游离脂肪酸到肝中,而肝脏在吸收游离脂肪酸的同时,游离脂肪酸又直接影响了肝细胞中甘油三酯及极低密度脂蛋白的合成及储存。随着这些能量底物摄取的增多,超过了肝脏的代偿能力,就会导致肝细胞发生损伤,表现为内质网应激、纤维化甚至坏死。另外糖尿病促进肝纤维化发展的机制可能是肝毒性炎性细胞因子的上调及高浓度的葡萄糖和胰岛素刺激了结缔组织生长因子的表达[12]。
AST主要存在于线粒体及细胞质中,ALT主要存在于细胞质中,由于转氨酶从循环中清除的速率不同,所以它们可能以不同的机制从循环中清除,线粒体中的AST相较于循环中的AST有更长的半衰期。循环中的AST较高,可能是肝纤维化使线粒体结构损伤导致AST外漏到血中或者肝窦细胞清除AST能力减弱。AST和γ-GT水平较高患者的肝脏中可能有更多的炎症反应、更多与氧化应激相关的脂肪堆积及更严重的肝细胞损伤。谷胱甘肽作为一种细胞内抗氧化剂及氧化应激标志物,升高的γ-GT可能使谷胱甘肽的消耗增加,这也进一步反映了肝脏内氧化应激水平的增高[13]。本研究中还发现,AST和γ-GT与肝纤维化程度独立相关。同样Poustchi,H等人[14]通过纳入100名T2DM患者和100名非糖尿病患者,使用瞬时弹性成像技术得出AST是发生肝纤维化的主要独立因素的结论。而LAI等[15]的一项包括557个样本的横断面研究表明血清中较高的ALT和γ-GT是晚期肝纤维化的独立危险因素。这可能是因为在慢性肝损伤中,相比较于AST,通常血清中ALT升高更为明显;然而随着肝细胞损伤逐渐加重,导致了ALT 活性下降,所以在肝纤维化晚期,血中的AST水平可能会高于ALT。
肝脏在HCY的合成和代谢中起到核心作用,HCY是甲硫氨酸在肝脏中代谢的中间产物,它可以在转硫途径中分解为半胱氨酸(Cys)。当肝细胞损伤时,HCY的水平可能发生改变,同时升高的HCY也会进一步促进肝损伤的发展。PASTORE等[16]对64名经活检证实患有MAFLD的儿童与同等数量的对照组进行了分析,发现HCY和Cys的水平往往随着肝纤维化严重程度增加,与本研究结果相符。HCY会使肝星状细胞中α1(I)前胶原和金属蛋白酶组织抑制因子-1的表达增加,促进细胞外基质重塑及内膜纤维化。同时HCY可以使活性氧短暂升高,参与NAD(P)H氧化酶的激活增加,其产生的活性氧激活PI3K/Akt通路,并促进了肝星状细胞增殖。现已证实缺乏维生素B与叶酸可能会影响血清中HCY的代谢。MAHAMID等[17]的横断面研究表明,通过纳入83名MASH患者,发现低水平的叶酸和维生素B12可以作为MASH严重程度的独立预测因子,这或许能从另一个角度阐明血清中同型半胱氨酸水平升高导致肝纤维化进展的机制。然而POLYZOS等[18]的研究通过30例经活检证实的MAFLD患者与对照组对比,认为HCY与MAFLD患病率无相关性,但较小的样本量可能影响了他们的结论。采用Spearman和多因素线性回归分析T2DM合并MAFLD患者LSM与HCY的相关性,结果表明,HCY水平越高,越有可能导致肝纤维化。所以降低HCY很可能是预防MAFLD 进一步发展为肝纤维化的有效靶点。

