SNHG3靶向miR-532逆转上皮间质转化对宫颈癌细胞侵袭、迁移及DPP耐药的研究*
曾卉 蒲腾达 苏炳凤 张程圆 樊俐俐
(海南省肿瘤医院妇科,海南 海口 570312)
宫颈癌是女性临床常见恶性肿瘤,具有高发病率及高死亡率的特点[1]。导致宫颈癌患者死亡的主要原因除了治疗失败外,就是转移和复发,而癌细胞的侵袭及迁移是肿瘤发生转移的核心步骤,因此探讨细胞侵袭及迁移机制,抑制其发生、发展一直是临床工作的重点及难点[2]。癌细胞的上皮间质转化可使癌细胞失去上皮细胞典型形态,并使细胞的基因表达谱发生变化,从而为细胞侵袭及转移提供有利条件,进而使癌细胞易于定植、增殖,并具有自我更新、耐受放疗及抗化疗药的能力,最终引起肿瘤发生远处转移,因此如何逆上皮间质转化是目前医学领域关注的焦点之一[3]。目前临床对于宫颈癌的治疗主要采取放化疗治疗,而顺铂(DPP)是同步放化疗的首选药物,但随着其不断使用,DPP的耐药性逐渐显露,已经成为化疗失败及预后不良的主要原因,因此阐明宫颈癌DPP耐药机制就显得尤为重要,这将有利于开发新颖的治疗策略,提高治疗效果[4]。随着测序技术的进步以及人类基因组计划的顺利完成,越来越多的研究证实,非编码RNA在包括宫颈癌在内的多种癌症中发挥重要作用,如长链非编码RNA(Long non-coding RNAs,Lnc RNA)可参与调控亚细胞结构、基因表达、蛋白复合物的稳定等多种生物进程,从而影响肿瘤的发生、发展、侵袭、迁移、耐药等过程;微小RNA(mirco RNAs,miR)可起到转录因子、基因及蛋白水平的分子调控作用,从而影响细胞的增殖、侵袭、迁移、上皮间质转化等过程;此外,Lnc RNA还可作为竞争性内源性RNA靶向结合miR,从而调控其靶基因的表达,进而共同影响肿瘤的发生、发展[5-6]。SNHG3和miR-532是近年来发现的与宫颈癌密切相关的非编码RNA,其均在宫颈癌的发生、发展中发挥着重要作用[7-8]。且starBase 数据库预测显示,SNHG3 和miR-532之间存在结合位点,因此本文就SNHG3靶向miR-532逆转上皮间质转化对宫颈癌细胞侵袭、迁移及DPP耐药进行研究探讨,以期为临床治疗宫颈癌提供新的靶点及依据。
1 材料与方法
1.1 实验材料 HUCEC正常宫颈上皮细胞(货号:XY1481,上海烜雅有限公司);HeLa宫颈癌细胞(货号:HT-X1651,深圳豪地华拓有限公司);AV3宫颈癌细胞(货号:CL-318h,武汉赛奥斯有限公司);MS751宫颈癌细胞(货号:MS751,上海赛百慷股份有限公司);WISH宫颈癌细胞(货号:SY4813,上海酶研有限公司);荧光实时定量PCR仪(型号:CFX96,上海土森视觉有限公司);PowerPacTM基础电泳仪(型号:164-5051,美国 Bio-Rad公司);紫外分光光度计(型号:NP80,无锡莱弗思有限公司);实时Real-Time PCR 试剂盒(货号:7000,美国 ABI 公司);Trizol试剂(货号:Invitrogen,上海文韧有限公司);逆转录试剂盒(货号:RT3,上海海方有限公司);SDS-PAGE凝胶电泳试剂盒(货号:KGP113,江苏凯基有限公司);质粒大量提取试剂盒(货号:D1130,北京索莱宝有限公司);脂质体2000(货号:AL7800-0.75 mL,上海吉至有限公司);E-cadherin抗体(货号:10204-T52,北京义翘神州有限公司);Vimentin抗体(货号:100254-T08,北京义翘神州有限公司);GAPDH抗体(货号:FNab03343,武汉菲恩生物科技有限公司);ECL检测试剂盒(货号:CDLG-4911,武汉纯度生物科技有限公司);结晶紫(货号:G1061-500,北京索莱宝有限公司);CCK-8试剂(货号:SH-1558,北京凯诗源有限公司);二甲基亚砜(货号:D2650,上海睿安有限公司)。
1.2 细胞培养 正常宫颈上皮细胞及宫颈癌细胞,在5% CO2、 37 ℃的条件,置于含有10%胎牛血清的DMEM完全培养箱培养,培养至细胞贴壁到达80%时进行传代培养,培养2~3代,收集细胞进行后续实验。
1.3 Real-time PCR法检测mRNA相对表达 严格按照实时Real-Time PCR试剂盒步骤检测HUCEC正常宫颈上皮细胞和4种宫颈癌细胞系中的SNHG3及miR-532 mRNA表达,分别取待检测细胞,消化、离心后,将其以密度1×106/mL接种于6孔板中,PBS洗涤3次,于冰上加入1 mL裂解液,摇匀后,用Trizol 试剂提取总RNA,提取完成后用紫外分光光度计检测RNA浓度和纯度,用电泳仪检测其完整性,用逆转录试剂盒进行逆转录,转录完成后将cDNA、荧光染料、引物合无酶水按照说明书比例混合,然后利用荧光实时定量PCR仪进行 PCR扩增,在95 ℃条件下预变性10 min,变性15 s,70 ℃延伸1 min,60 ℃退火60 s,此循环进行40次,收集SNHG3及miR-532荧光信号,反应结束后进行数据分析,以同一样本中的U6的Ct值作为内参,采用 2-ΔΔCt计算其基因相对表达量。引物序列,见表1。
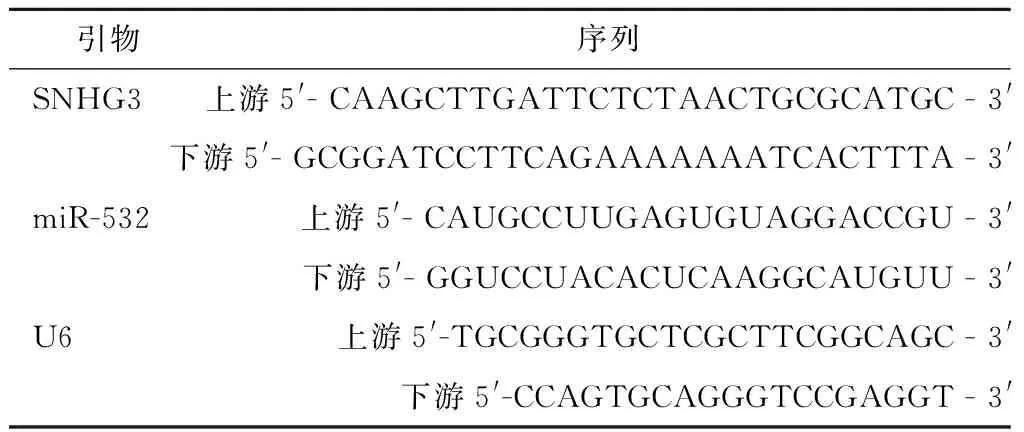
表1 SNHG3及miR-532引物序列Table 1 Primer sequences of SNHG3 and miR-532
1.4 实验分组 取HeLa细胞将其分为宫颈癌细胞(CC)组、宫颈癌细胞+SNHG3-NC(SN)组、宫颈癌细胞+SNHG3激动剂(SM)组、宫颈癌细胞+SNHG3抑制剂(SI)组、宫颈癌细胞+miR-532-NC(MN)组、宫颈癌细胞+miR-532抑制剂(MI)组、宫颈癌细胞+miR-532激动剂(MM)组、宫颈癌细胞+SNHG3抑制剂+miR-532激动剂(IM)组。
1.5 细胞转染 取各组生长状态良好且密度为40%~60%的细胞,消化、离心后接种于6孔板中,取不含血清的DMEM培养基,将按照质粒大量提取试剂盒说明书提取的相关分组目的基因质粒DNA与脂质体分别加入其中,冰上静置5 min,再分别取等量目的基因加入脂质体中配置成转染液,室温静置5 min,将转染液按分组依次加入孔板,每孔加0.3 mL,并加入含10%胎牛血清的培养基使总体积到达1 mL,轻轻混匀后置于孵箱,6 h后换全培养基,然后转染48 h后,收集各组细胞用于后续实验。
1.6 免疫印迹法检测上皮间质转化相关蛋白表达 取转染后各组细胞,进行消化、离心,弃掉上清液后重悬细胞,以密度为1×106个/mL接种于6孔板中,培养24 h,PBS洗涤3次,RIPA裂解液提取总蛋白,BCA法测定蛋白浓度,以8%分离胶,5%浓缩胶的条件进行SDS-PAGE 电泳分离,电泳完成后,取浸泡在无水甲醇中激活的PVDF 膜进行转膜1.5 h,5%的脱脂奶粉封闭2 h,加入稀释的E-cadherin、Vimentin一抗(1∶1000),4 ℃摇床振荡孵育过夜后洗膜;加入辣根过氧化氢酶标记的二抗(1∶5000),37 ℃轻摇室温孵育 2 h;洗膜后,用ECL荧光试剂盒发光,Gene Sys 软件自动曝光后,计算与GAPDH比值求得E-cadherin、Vimentin蛋白的相对表达含量。
1.7 小室法检测细胞侵袭及迁移 取各组转染后的细胞,以无血清培养液将细胞饥饿12 h,进行消化、离心,弃掉上清液后重悬细胞,调整密度为8×104个/mL,进行侵袭实验,首先将每个小室水化并加入35 μL基质胶进行铺胶,37 ℃孵育1 h,上层加入200 μL单细胞悬液,下层加入600 μL含20%血清的培养液,常规培养48 h,PBS洗涤2次后,4%多聚甲醛15 min,PBS洗涤2次,向每孔加入0.1%的结晶紫染色15 min,棉签拭去未穿透至对侧的细胞,显微镜下拍照并计算细胞数,调整密度为4×104个/mL,进行迁移实验,步骤与侵袭实验相同,只是不做铺胶处理。
1.8 CCK-8法检测DPP耐药 取转染后的各组细胞进行消化、离心,弃掉上清液后重悬细胞,以密度为5×103个/mL接种于96孔板中,常规培养24 h,待细胞贴壁后,向每孔加入5 μmol /L的DPP,同时设置无细胞的空白对照组、加入二甲基亚砜的溶剂对照组,培养48 h时,向每孔加入10 μL 8%的CCK-8,避光孵育2 h,用酶标仪在450 nm处测量每孔吸光度(A),根据[1-(加药组A-空白组A)/(溶剂对照组A-空白组A)]×100%,计算DPP抑制率。
1.9 双荧光素酶报告基因检测 利用点突变技术扩增出含有Hind Ⅲ和 SpeⅠ酶切位点的miR-532突变位点3′ UTR后,分别将野生型和突变型miR-532 3′UTR插LipofectamineTM2000载体,然后取宫颈癌细胞将其接种于6孔板中,参照转染试剂说明书将构建好的miR-532 -3′-UTR-WT和miR-532 -3′-UTR-MUT质粒分别与SNHG3-NC和SNHG3共转染至细胞,转染48 h后,严格按照双荧光素酶报告基因检测试剂盒检测操作步骤检测各组细胞荧光素酶活性。
2 结果
2.1 HUCEC和4种宫颈癌细胞系中SNHG3及miR-532 mRNA的表达 宫颈癌细胞系中的SNHG3 mRNA表达量显著高于正常宫颈癌上皮细胞系HUCEC(P<0.05),miR-532 mRNA表达量显著低于正常宫颈癌上皮细胞系HUCEC(P<0.05),其中HeLa的SNHG3、miR-532 mRNA值变化最大(P<0.05),因此选取其作为此次实验细胞,见图1。
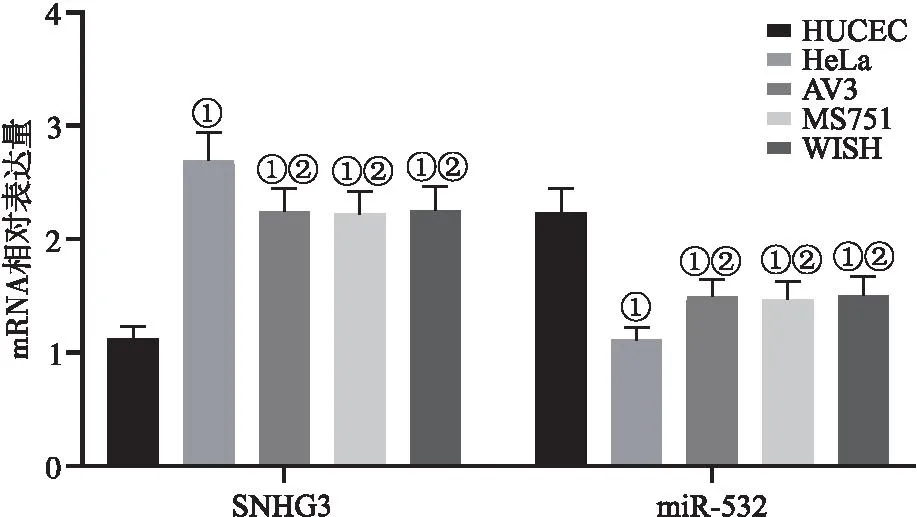
图1 HUCEC和4种宫颈癌细胞系中SNHG3及miR-532 mRNA的表达Figure 1 mRNA expression of SNHG3 and miR-532 in HUCEC and four cervical cancer cell lines注:与HUCEC相比,①P<0.05;与HeLa相比,②P<0.05。
2.2 SNHG3对宫颈癌癌细胞上皮间质转化、侵袭、迁移、DPP耐药的作用 CC组与SN组相比,细胞E-cadherin、Vimentin蛋白表达、侵袭及迁移数量、DPP抑制率差异无统计学意义(P>0.05);与SN组相比,SM组E-cadherin蛋白表达、DPP抑制率明显降低,Vimentin蛋白表达、侵袭及迁移数量明显升高(均P<0.05);与SM组相比,SI组E-cadherin蛋白表达、DPP抑制率明显升高,Vimentin蛋白表达、侵袭及迁移数量明显降低(均P<0.05)。见表2、图 2、图3。
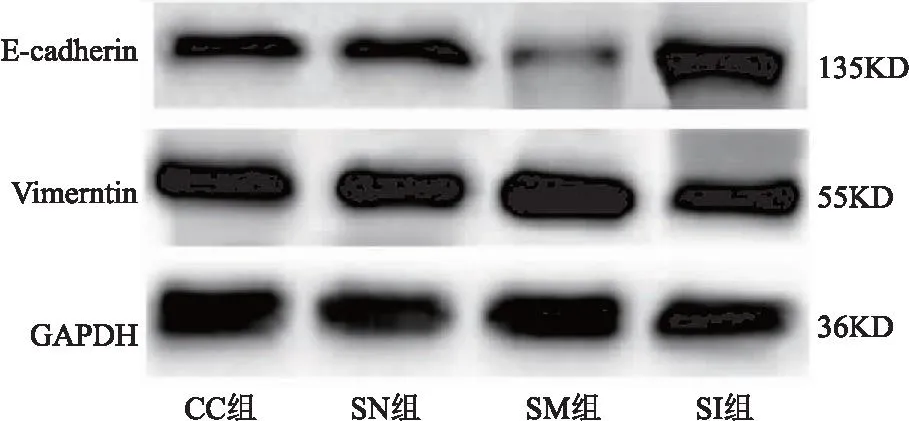
图2 各组细胞E-cadherin、Vimentin蛋白表达电泳图Figure 2 Electrophoretic diagram of E-cadherin and Vimentin protein expression in each group
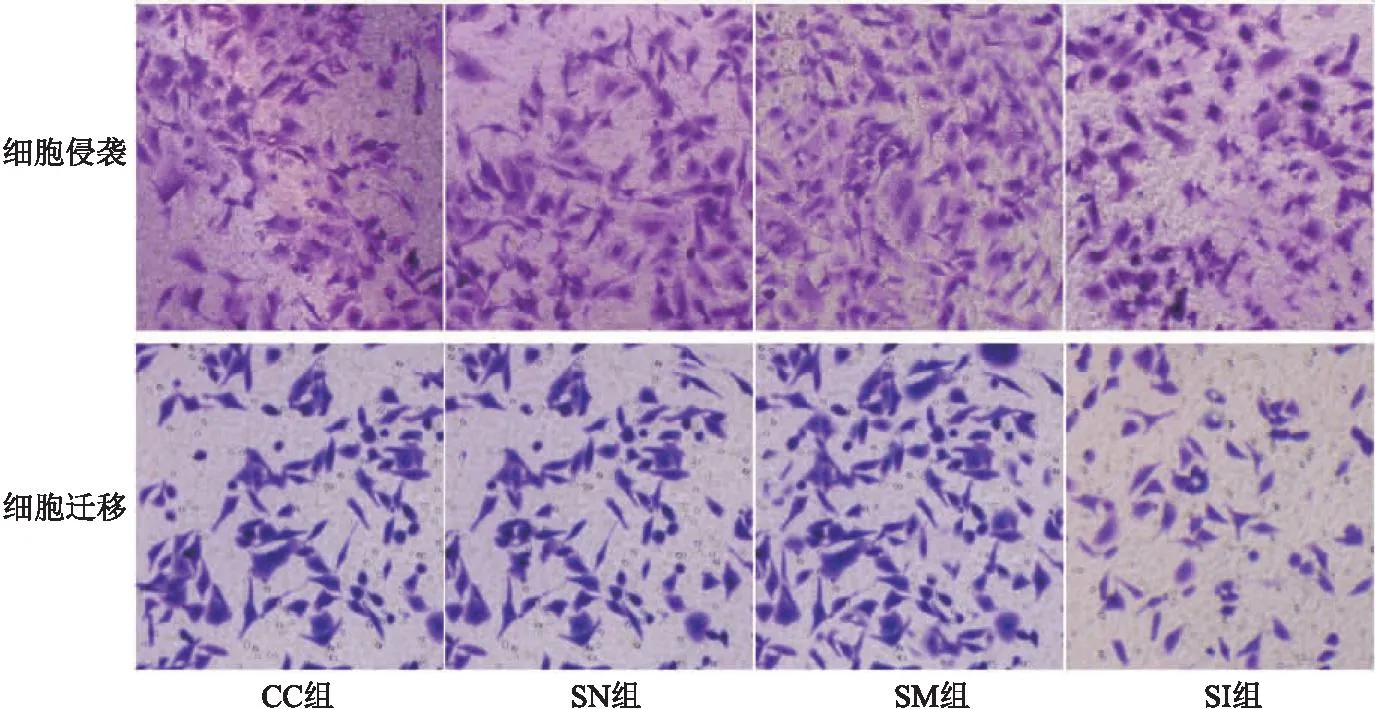
图3 各组细胞侵袭及迁移图(结晶紫,200×)Figure 3 Cell invasion and migration in each group

表2 4组宫颈癌细胞上皮间质转化、侵袭、迁移、DPP耐药结果比较Table 2 Comparison of the results of epithelial-mesenchymal transition, invasion, migration and DPP resistance of cervical cancer cells in the four groups
2.3 miR-532对宫颈癌癌细胞上皮间质转化、侵袭、迁移、DPP耐药的作用 CC组与MN组相比,细胞E-cadherin、Vimentin蛋白表达、侵袭及迁移数量、DPP抑制率差异无统计学意义(P>0.05);与MN组相比,MI组E-cadherin蛋白表达、DPP抑制率明显降低,Vimentin蛋白表达、侵袭及迁移数量明显升高(均P<0.05);与MI组相比,MM组E-cadherin蛋白表达、DPP抑制率明显升高,Vimentin蛋白表达、侵袭及迁移数量明显降低(均P<0.05)。见表3、图4、图5。
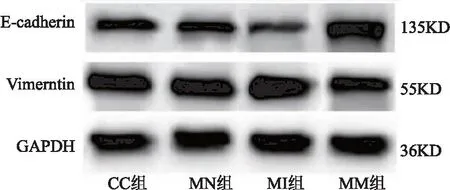
图4 各组细胞E-cadherin、Vimentin蛋白表达电泳图Figure 4 Electrophoretic diagram of E-cadherin and Vimentin protein expression in each group

图5 各组细胞侵袭及迁移图(结晶紫,200×)Figure 5 Cell invasion and migration in each group

表3 4组宫颈癌细胞上皮间质转化、侵袭、迁移及DPP耐药结果比较Table 3 Comparison of epithelial mesenchymal transition, invasion, migration and DPP resistance of cervical cancer cells among the four groups
2.4 SNHG3联合miR-532对宫颈癌癌细胞上皮间质转化、侵袭、迁移、DPP耐药的作用 SI组与MM组相比,细胞E-cadherin、Vimentin蛋白表达、侵袭及迁移数量、DPP抑制率差异无统计学意义(P>0.05);与MM组相比,IM组E-cadherin蛋白表达、DPP抑制率明显升高,Vimentin蛋白表达、侵袭及迁移数量明显降低(均P<0.05)。见表4、图6、图7。
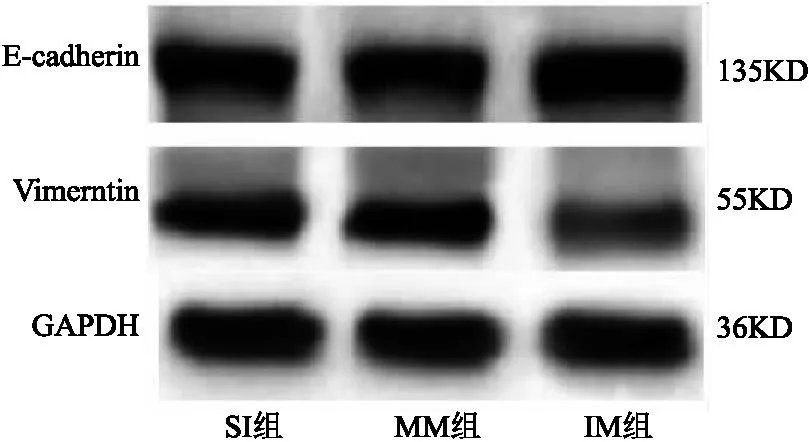
图6 各组细胞E-cadherin、Vimentin蛋白表达电泳图Figure 6 Electrophoretic diagram of E-cadherin and Vimentin protein expression in each group
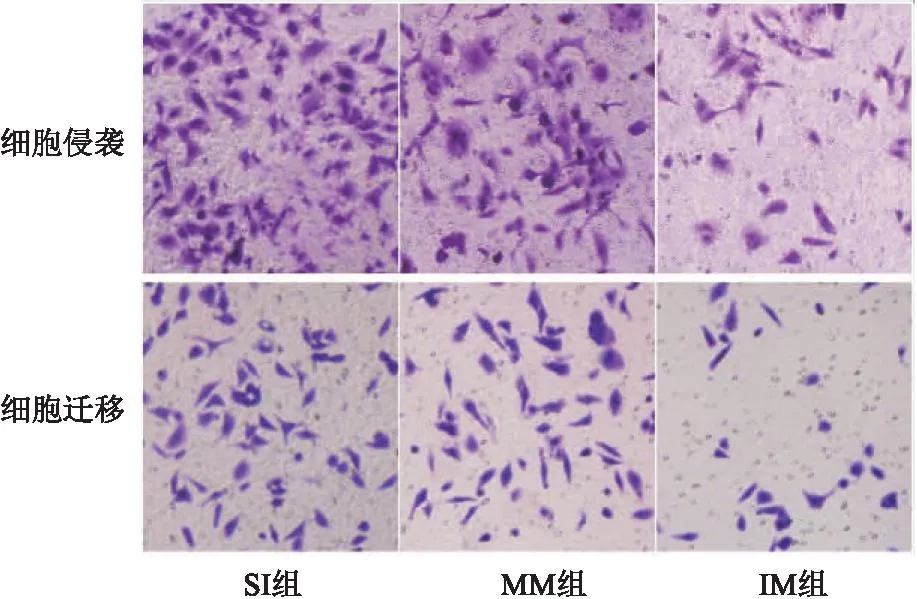
图7 各组细胞侵袭及迁移图(结晶紫,200×)Figure 7 Cell invasion and migration in each group

表4 3组宫颈癌细胞上皮间质转化、侵袭、迁移、DPP耐药结果比较Table 4 Comparison of epithelial mesenchymal transition, invasion, migration and DPP resistance of cervical cancer cells among the three groups
2.5 双荧光素酶报告检测结果 双荧光素酶报告结果显示,转染SNHG3后可显著降低miR-532-3′-UTR-WT的荧光素酶活性(P<0.05),但对突变基因无显著影响(P>0.05),且SNHG3与miR-532呈现负相关,见表5、图8、图9。

图8 SNHG3与miR-532靶向结合位点图Figure 8 Target binding sites of SNHG3 and miR-532
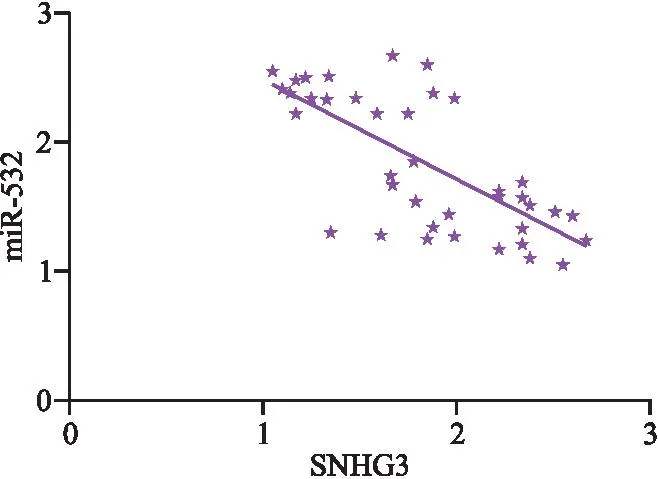
图9 SNHG3与miR-532相关性图Figure 9 Correlation between SNHG3 and miR-532

表5 双荧光素酶报告Table 5 Dual luciferase report
3 讨论
近年来,随着宫颈癌疫苗的出现及人们健康意识的提高,宫颈癌的发病也有所降低。但宫颈癌的死亡率仍然较高,是严重影响女性健康的一大杀手,因此,继续深入研究宫颈癌发病及进展分子机制,寻找新的生物治疗靶点是目前临床治疗亟待解决的重大课题[9]。本研究结果显示,宫颈癌细胞系中的SNHG3 mRNA表达量显著高于正常宫颈癌上皮细胞,miR-532 mRNA表达量显著低于正常宫颈癌上皮细胞,这表明SNHG3、miR-532可能参与癌症进程。目前已被证实,如LcnRNA、miRNA 等非编码RNA在人类的生理乃至疾病和癌症的发生、发展中发挥重要作用,可通过多种途径调控靶基因,从而对机体生长、发育、分化等过程起重要调控作用,对机体各种生理及病理过程造成影响[10]。SNHG3是近年来研究最多的一种LcnRNAs,其可通过RNA剪接、tRNA处理、信号转导等,参与细胞转录、凋亡、粘附等方面的调控;miR-532则是miRNAs的一种,其可通过碱基配对结合靶基因信使RNA,来抑制靶基因翻译或引起其降解,从而对细胞的增殖、凋亡、转移等生命进程起重要作用,最终影响肿瘤的发生、发展[11-12]。而对于SNHG3高表达,miR-532低表达,可能是由于宫颈癌中其基化区域出现异常,从而导致其上游靶基因转录异常,进而导致SNHG3大量转录,miR-532过度降解,最终在机体内SNHG3呈高表达,miR-532呈低表达。Zhu等[13]表明,SNHG3在宫颈癌中表达显著增加,且SNHG3表达上调与转移相关,这说明SNHG3可以作为预后的生物标志物和宫颈癌的治疗靶点,这与本文结果类似。
本文结果提示,抑制SNHG3可显著抑制细胞侵袭及迁移,并改善上皮间质转化和DPP耐药,这说明SNHG3可成为治疗宫颈癌的有效靶点。宫颈癌癌细胞的侵袭和转移是导致包括宫颈癌在内的所有肿瘤患者死亡的主要原因,因此探寻其侵袭和转移的分子机制就显得尤为重要[14]。而近年来研究[15-16]发现,上皮源性肿瘤的侵袭、转移与细胞间质转化密切相关,为了获得运动和侵袭能力,肿瘤细胞必须发生间质转化,因为间质转化可使原发肿瘤发生许多表型的改变,从而有利于癌细胞离开肿瘤原发部位,播散至远处组织、器官,最终形成新的肿瘤,E-cadherin 、Vimentin是间质转化过程的关键分子,E-cadherin下调或缺失、 Vimentin 表达增加被视为癌细胞发生间质转化的最重要标志,因此检测其水平的变化可有效反映宫颈癌细胞上皮间质转化逆转情况。DPP是宫颈癌化学治疗的重要药物,不仅潜力最佳,应用也最为广泛,也正是因为这一特性,DPP耐药成为了限制其临床疗效以及部分患者治疗进展的关键原因,因此如何改善宫颈癌DPP耐药一直是临床关注的焦点之一[17]。而对于宫颈癌细胞,抑制SNHG3主要通过调控相关信号通路的表达,来改善肿瘤微环境,从而调控肿瘤间质转化相关蛋白,抑制上皮间质转化的发生,进而抑制细胞侵袭及迁移,促进细胞凋亡,增加细胞间黏附性和极性等,最终有效改善DPP耐药,提高治疗效果。有发现,下调SNHG3可显著抑制宫颈癌细胞增殖、迁移及侵袭能力,其机制可能与抑制上皮间质转化通路有关,这与本文结果类似[18]。
双荧光素酶报告结果显示,转染SNHG3后可显著抑制miR-532-3′-UTR-WT的荧光素酶活性,但对突变基因无显著影响,且SNHG3与miR-532呈现负相关,这说明miR-532可能是SNHG3的靶基因。近年来研究[18]发现,LncRNA可竞争结合 miRNAs,从而影响miRNAs的功能与活性,而miR与上皮间质转化,上皮间质转化与细胞恶性行为和化疗耐药之间的关系也早有研究证实,这说明LncRNA可通过靶向 miRNAs对癌细胞皮间质转化造成影响,从而调控恶性行为及耐药。故可推测SNHG3可抑制宫颈癌细胞侵袭及迁移,并改善DPP耐药,可能是通过吸附miR-532的竞争内源性 RNA,来参与表观遗传学调控,从而调节邻近蛋白质编码基因的表达,调控相关信号通路的表达,改善肿瘤微环境,进而抑制癌细胞发生间质转化,抑制其获得间质细胞特征,最终达到抑制宫颈癌细胞侵袭及迁移,并改善DPP耐药的目的。郑志远等[19]表明,SNHG3具有致癌作用,可显著促进细胞增殖、侵袭以及上皮间质转化,这与本文结果类似。
本文为治疗宫颈癌的科学研究提供了新的思路及实验经验,有望成为宫颈癌治疗的新靶点。但本文实验仍存在一定不足,实验室尚未建立SNHG3慢病毒对大鼠的干预,在今后的实验中会进一步添加SNHG3对宫颈癌的参考依据。
4 结论
抑制SNHG3可有效逆转宫颈癌细胞上皮间质转化,抑制细胞侵袭及迁移,并提高DPP耐药,其作用机制可能与靶向激活miR-532有关。

