血液高RDW和高N-MID OC/β-CTX比值在老年女性椎体骨折中的诊断价值*
邹明 池继敏 唐敏 桑阳 陈永丽 邓顺 岳建彪
(四川省骨科医院,四川 成都 610041)
骨质疏松 (Osteoporosis,OP)是一种进行性的低骨量和骨组织微结构退化致骨脆性和骨折易感性增加的全身骨骼疾病[1-2],据估计影响全球2亿女性[3]。我国女性患病率高于大多数欧美国家[4],50岁以上人群可达32.1%[5]。而骨质疏松症的临床意义在于出现的骨折,大约有二分之一的成年女性在其一生中会遭受一处或多处脆性骨折[1],由于人口老龄化,骨质疏松性骨折(Osteoporotic fracture,OPF)的发生呈逐年增加的趋势,导致老年人死亡风险也持续性增加[6],造成社会和家庭的沉重负担[7]。而我国60岁以上总人口大于2.6亿,女性占48.76%[8],OPF其常见部位是椎体、髋部和前臂远端等[6],而椎体骨折(Osteoporotic vertebral fracture,OPVF)最常见,患病率亦随增龄而渐增[7],女性50岁后发生的终生概率可达15.1%[2]。大多数OPVF目前未得到诊断及医疗护理,故应重视脆性骨折患者的潜在原因,改进风险评估,以减轻骨折造成的巨大的健康和经济负担。慢性炎症被认为骨质疏松症的发病因素[9]及OPVF的危险因素[10]。红细胞分布宽度(Red blood cell distribution width,RDW)近年来也被认为是慢性炎症的标志物[11],与冠心病、心衰、肿瘤等多种疾病有关[12],与髋部、椎体骨折的不良转归相关已有报道[11,13],其升高可能与老年人中普遍存在的OPVF有关[10]。尽管OPVF是可预测的未来骨折[10],也已经确定了大量的危险因素,但为了改进风险评估,需纳入更多超过骨密度或年龄等对骨折有显著影响危险因素。本研究通过了解老年女性OPVF患者RDW与骨代谢平衡间的相关性,评估二者能否纳入OPVF风险评估,为在老年女性中了解OPVF病因及作为未来骨折的预测因子提供新的基础。
1 资料与方法
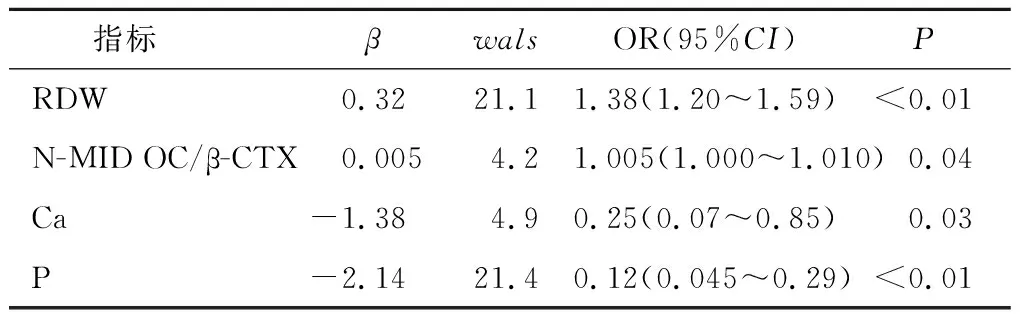
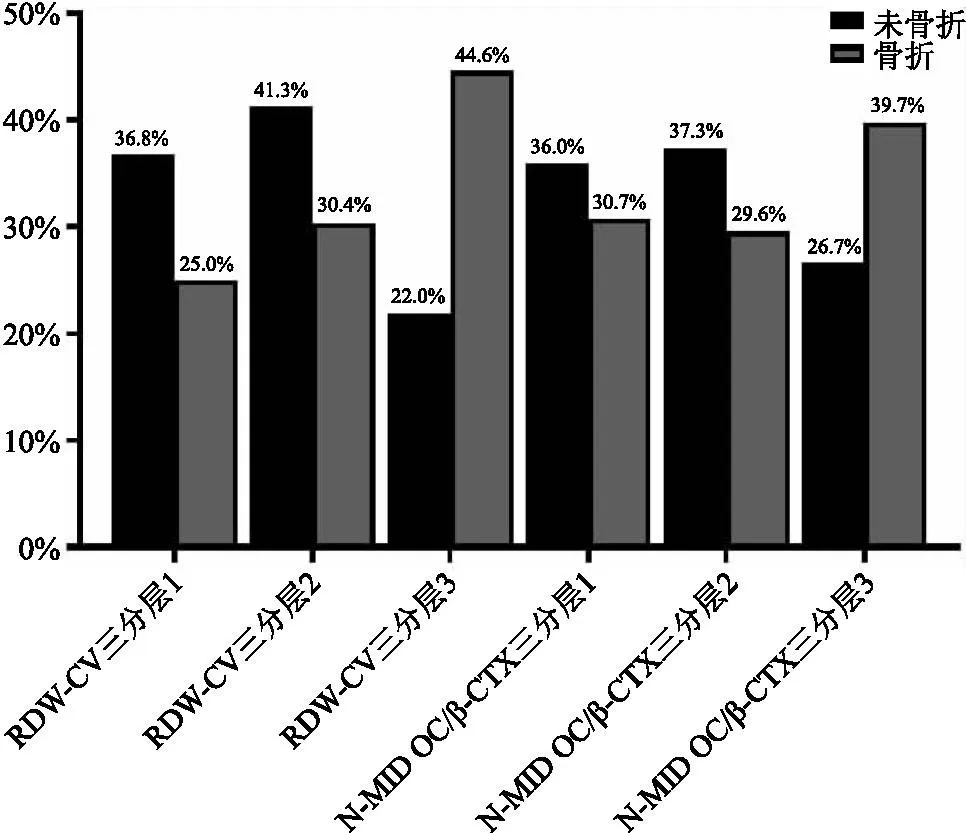
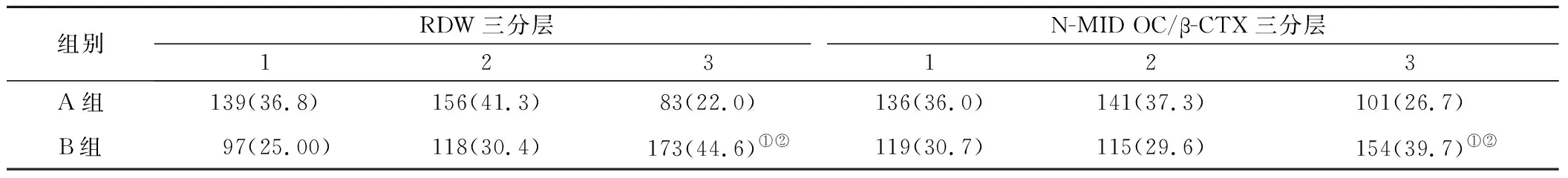
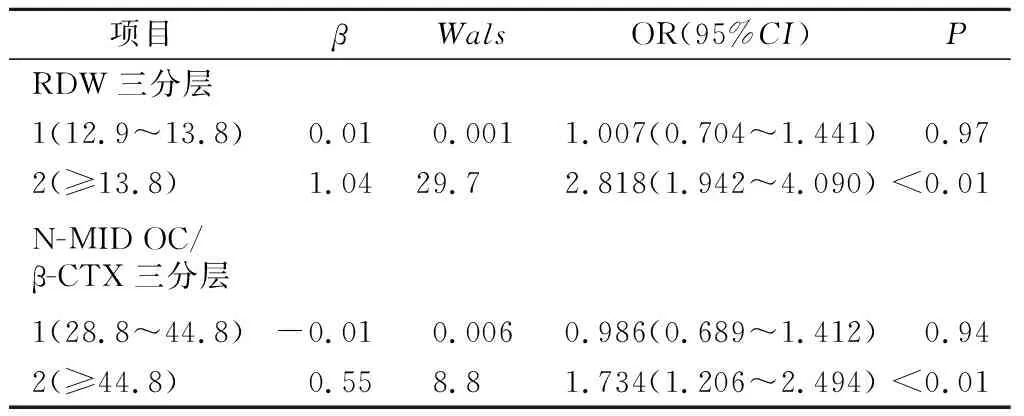
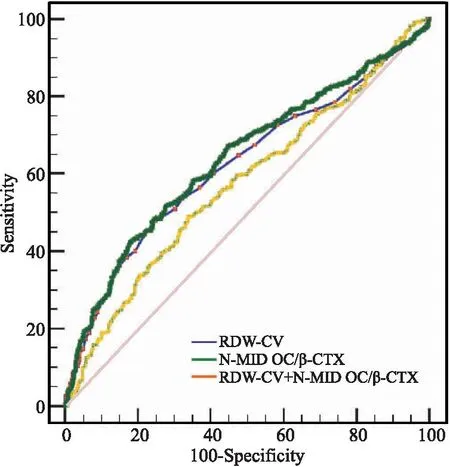
1.1 一般资料 纳入2021年1月—2021年12月我院≥60岁女性骨质疏松住院患者786例,分为无骨折组(A组,378例)和OPVF组(B组,388例)。纳入标准:①年龄≥60岁女性。②骨质疏松诊断符合原发性骨质疏松症诊疗指南(2017)[7]的诊断标准之一:椎体脆性骨折;DXA测量骨密度的T值≤-2.5;骨密度T值(-2.5 1.2 方法 纳入患者入院次日晨采集空腹血。在罗氏e601仪器上完成N-MID OC、β-CTX测定,日立7600生化仪测定Ca、P和Mg[14]及SysmexXN血细胞计数仪测定RBC、Hb、HCT、RDW-CV、MCV、MCH、MCHC。研究期间检测指标室内质控累积变异系数(CV%)[14]:N-MID OC为4.02、β-CTX为3.33、RBC为1.64、Hb为0.78、MCV为0.9、MCHC为1.24、MCH为0.86、RDW为0.5、Ca为1.98、P为2.01、Mg为2.59。GE双能X射线骨密度仪测量骨密度及岛津COLLIMATOR TYPE R-300 DR进行X线摄片进行骨质疏松的诊断。 1.3 统计学分析 使用SPSS19.0、MedCalc19进行统计学处理。组间计量资料采用Mann-Whitney U检验,以中位数(四分位间距)[M(P25,P75)]表示;计数资料使用卡方检验;Spearman相关分析各指标相关性;二元Logistic回归行危险因数分析;ROC曲线观察指标的诊断性能,曲线下面积(AUC)比较采用Delong检验[14]。以P<0.05为差异有统计学意义。 2.1 两组患者一般资料比较 B组Ca、P、Hb、HCT、MCV、MCH、MCHC含量较A组降低,RDW-CV、N-MID OC/β-CTX较A组增加,差异有统计学意义(均P<0.05)。两组患者年龄、N-MID OC及β-CTX差异无统计学意义(均P>0.05)。见表1。 表1 两组患者一般资料比较[M(P25,P75)]Table 1 Comparison of laboratory tests between fracture and non fracture groups 2.2 OPVF、RDW与各指标相关性 双变量相关性分析显示老年女性OPVF与β-CTX、Ca、P呈显著负相关(均P<0.05),与RDW、N-MID OC/β-CTX呈显著正相关(均P<0.05)。老年女性OPVF患者RDW与N-MID OC、β-CTX、Ca、P、Mg呈显著负相关(均P<0.05)。见表2。 表2 OPVF、RDW与各指标相关性Table 2 The OPVF and RDW were correlated with each indicator 2.3 OPVF与各指标的风险因素 纳入组间比较P值<0.1及与OPVF有明显相关性指标行Logistic向前逐步回归分析,显示RDW、N-MID OC/β-CTX、Ca、P为老年女性OPVF的风险因素(均P<0.05),见表3。 表3 骨折二元Logistic回归分析Table 3 Binary logistic regression analysis of fracture 2.4 RDW、N-MID OC/β-CTX比值分层与OPVF风险 RDW三分层(第1层:<12.9;第2层:12.9~13.8;第3层:≥13.8)显示OPVF发生率在第3层较第1、2层明显增加(χ2值分别为34.76、32.12)(均P<0.01)。N-MID OC/β-CTX比值三分层(第1层:<28.8;第2层:28.8~44.8;第3层:≥44.8)显示OPVF发生率在第3层较第1、2层明显增加(χ2值分别为9.86、12.26,均P<0.01)(见表4、图1)。二者均以最低层为参考层进行Logistic回归分析,表明值越高,老年女性OPVF风险越高,最高层是最低层的分别约3倍和2倍,OR分别为2.818(95%CI:1.942,4.090),1.734(95%CI:1.206,2.494)。见表5。 图1 三分层与OPVF发生率Figure 1 Triple layer and the incidence of OPVF 表4 RDW-CV、N-MID OC/β-CTX分层与骨折率[n(×10-2)]Table 4 RDW-CV and N-MID OC/β-CTX stratification and fracture rate 表5 RDW、N-MID OC/β-CTX分层与骨折风险Table 5 RDW-CV and N-MID OC/β-CTX stratification and fracture risk 2.5 RDW-CV、N-MID OC/β-CTX比值在OPVF的诊断价值 二者联合检测较单独检测在对老年女性OPVF的诊断时可明显提高诊断性能,其AUC最大为0.641,其敏感性、特异性、阳性预示值、阴性预示值分别为42.78%、82.01%、70.9%、58.3%,见表6、图2。 图2 RDW-CV、N-MID OC/β-CTX比值联合诊断ROC曲线Figure 2 ROC curve of combined diagnosis of RDW-CV and NMID-OC/β-CTX ratio 表6 RDW、N-MID OC/β-CTX比值对老年女性OPVF的诊断价值Table 6 The diagnostic value of RDW-CV and N-MID OC/β-CTX ratio in elderly women with OPVF 骨质疏松通常被认为是无声的疾病,因为没有骨丢失的症状,而骨折是最重要的临床表现,多种危险因素会导致骨丢失增加。当产生最佳质量和强度的骨重建过程不平衡而致骨骼发生故障时,易发生骨折[15]。骨丢失被认为是由于骨重建率的增加及骨形成和吸收之间的负不平衡引起的[16],会发展为骨质疏松。而骨骼是一种代谢活跃的组织,骨转换标志物(Bone turnover markers,BTMs)是反映骨吸收与骨形成过程中产生的蛋白质或蛋白质衍生物,被认为有助于识别骨折风险增加的患者。近年来,人们迫切希望使用BTMs来预测骨质疏松和骨折风险。骨钙素(Osteocalcin,OC)是骨基质中最重要的非胶原蛋白,是一种依赖于维生素k的钙特异性结合蛋白,由成骨细胞产生的一种BTMs[14]。OC分子在循环中具有相当的异质性,有不同的羧化状态和不同的片段,而N-MID OC则是由完整OC裂解产生的稳定N段中分子片段,是骨形成的特异性标记物,与骨转换率有关,是骨形成和吸收间的重要偶联物。OC在OPF中的变化与风险预测报道不一,Morris等[17-18]报道OPF患者风险随OC增高而增高,Qu等[19-20]却发现OPF患者含量低于非骨折组,但与骨折的发生风险无关。本研究发现,在老年女性OPVF组中N-MID OC含量并未有明显变化,与前述研究不一,但在OPVF中发生风险与Qu等[19-20]结果一致,也并不相关。可能与骨钙素反映了骨代谢的总体水平,在骨吸收时也释放[21],当骨重建过程解偶联,骨形成和吸收之间不平衡,释放入血液循环中OC有不同程度的羧化有关。CTX是I型胶原在骨吸收过程中被破骨细胞降解时释放到循环中的I型胶原交联羧基末端肽片段,其组成的α天冬氨酸异构化为β形式(β-CTX),是骨吸收的特异性标记物,可用于评估骨吸收。在骨吸收增加的状态下,血清中的胶原降解碎片(β-CTX)水平增加。崔宝甲等[20]发现在OPVF患者中β-CTX虽然明显升高,但与椎体骨折的发生风险并无相关性。而Kanis[2]、Ivaska[22]、Qu[19]在老年女性中发现β-CTX较高,更易发生骨折,并较骨形成标志物与骨折风险的相关性更一致,可预测未来骨折风险。本研究发现在老年女性OPVF患者中β-CTX并未明显升高,与其呈负相关,但非OPVF的风险因子,与崔宝甲等[20]研究一致。老年女性OPVF患者中β-CTX、NMID-OC含量未升高,可能与老年女性骨代谢一般处于低转换状态有关[14]。已有研究多注重单独测定BTMs来研究其骨转换状态,而忽略了骨重建过程的不平衡。尽管有T值计算法来估计骨形成和吸收之间的平衡,但由于计算过于复杂,不易于临床实践采纳[16]。本研究通过构建易于获得的NMID-OC/β-CTX比值来表示骨形成和吸收之间平衡[14],研究其与OPVF之间相关性来更好地理解OPVF的潜在机制。结果发现,NMID-OC/β-CTX比值与老年女性OPVF患者存在显著正相关,是其风险因子。三分层显示比值越高,骨折风险、发生率越高,最高层是最低层的2倍,ROC分析可用于老年女性OPVF的诊断。表明NMID-OC/β-CTX比值更好地反应了骨形成与骨吸收之间的解偶联及不平衡[14]。比值增加,表明骨形成大于骨吸收,骨重建周期变长而导致更多的骨去除而不是替换,故有更多的骨丢失而致骨脆性增加。钙、磷、镁是骨基质的主要矿物质,骨骼是维持血液适宜钙、磷、镁浓度及比例的调节库,在老年女性OPVF患者中Ca、P含量明显降低,呈负相关,表明在OPVF患者中骨质流失,矿物质含量负不平衡,为老年女性骨折的风险因素,这可能与老年女性矿物质摄入、肾的排泄及多种调节激素有关。 RDW 是全血细胞计数(CBC)报告中的一个常规参数。它是反应红细胞大小和形状变化的一个指标,其值随红细胞异质性增加而增加,以表明最终的红细胞大小不等增多,常用RDW-CV来表示。在其常规临床应用被认为是血液病的有用诊断工具,特别是贫血诊断的合适参数。近年来,由于RDW与不同的非血液学临床条件之间的炎症病理生理学特征的关联,尤其与老年人的死亡率和发病率增加相关,RDW引起了人们的兴趣。然而其与OPVF的发生,骨代谢平衡的关系尚未充分研究。本研究发现老年女性OPVF患者中Hb、HCT、MCV、MCH、MCHC等红系指标降低,可能与老年女性OPVF患者营养缺乏有关,但这些指标并非OPVF风险因素。而RDW明显升高,这可能与在老年人中较高的RDW值被视为与年龄老化同时发生的虚弱增加有关[23],而虚弱可致跌倒等骨折风险增加,且在OPVF患者中独立于Hb等营养、贫血指标[10]。其与N-MID OC、β-CTX、Ca、P、Mg等骨代谢指标呈负相关,这与Zarzeczny等[24]研究一致。三分层分析老年女性OPVF患者中RDW-CV含量越高,OPVF的发生率明显增加,是其危险因素,与Hong等[10]认为RDW升高与椎体骨折几率增加一致,且最高层是最低层的约三倍。老年女性OPVF患者中RDW-CV的升高,可能与老年女性基体处于潜在慢性炎症有关,这种炎症系增龄性衰老所致[10-11、25],会导致红细胞变形性和红细胞体积的异质性[11],RDW不但是衰老的有效标志物,还反映了全身炎症[11、25]。炎症、衰老均是是骨质疏松及骨折的发病因素[9-11],炎症通过改变骨矿化和骨吸收之间的平衡来影响骨转换[15],而RDW可被认为是慢性全身性炎症与OPVF之间关联的潜在中介物,可作为未来OPVF的强大预测因子,在老年女性OPVF的诊断中具有一定的诊断价值,而在联合N-MID OC/β-CTX检测时,对老年女性OPVF患者的诊断可进一步提高诊断能力。 本研究测定指标从血液里较易获得,N-MID OC/β-CTX比值来表示骨形成和吸收之间平衡来研究与OPVF间的相关性,较Gossiel[16]等的方法更为简单,易于临床推广应用,也更好减小不同单一标志物测定异质性问题。联合检测提高诊断性能。但本研究仅研究了RDW在老年女性OPVF中的诊断价值,未纳入其他骨折类型;没有测定参与者的铁、维生素等影响红细胞代谢指标的水平,不能完全排除这些变量的影响;没有测定反应机体炎症的指标与RDW升高的相关性。还需进一步深入研究。 本研究结果提示,血液高RDW与N-MID OC/β-CTX比值在老年女性OPVF患者中存在相关性,其水平升高,OPVF发生率及风险越高,二者联合检测可提高对OPVF的诊断能力,且这些指标检测快速和无创,可在临床实验室中常规检测并纳入临床实践以帮助临床医生早期识别老年女性OPVF高风险者,早预防、早干预和治疗。但需纳入更多样本验证,获得更理想的cut-off值及更高的诊断敏感性和特异性。2 结果



3 讨论
4 结论

