HER-2低表达与HER-2阴性早期乳腺癌临床与病理特征及NACT效果对比*
段帅 地力木拉提·艾斯木吐拉 郭晨明 李慧芳
(新疆医科大学第一附属医院乳腺外科,新疆 乌鲁木齐 830054)
乳腺癌(Breast cancer,BC)已经占据女性新发癌症的首位,死亡率也升至第四位,相较于发达国家5年生存率为90.9%,我国仅为82%[1],如何在当前分子亚型分类基础上,不断探索亚型间差异性,细化分子分型或寻找新突破,以致实施更为精准的治疗及提高生存率是需要不断探索的问题。目前人表皮生长因子受体-2(Human epidermal growth factor receptor-2,HER-2)表达的判定采用二分法,即HER-2阴性或阳性,但当前的免疫组织化学(Immunohistochemistry,IHC)方法已然可以将IHC0与IHC1+、IHC2+且FISH/ISH阴性区分开来,然而两者的区别在临床上没有体现,而且在实际应用中通常被合并,其治疗依然局限在Luminal型和三阴型的诊疗范畴,且尚不清楚目前IHC方法检测到的HER-2低表达肿瘤是否具有明确的肿瘤生物学特性及代表了新的BC亚型。因此,HER-2低表达与HER-2阴性是否在临床与病理特征及对新辅助化疗(Neoadjuvant chemotherapy,NACT)反应等方面存在差异性是一个值得深入研究的问题,这将对临床治疗产生积极影响。本研究将HER-2低表达与HER-2阴性早期BC的病历资料予以回顾性分析,从而评价两种HER-2表达状态的早期BC在临床与病理特征及对NACT反应的差异性,以期为后续HER-2低表达的准确定义及针对性治疗提供一定参考。
1 资料与方法
1.1 一般资料 收集2018年1月—2022年7月就诊于新疆医科大学第一附属医院乳腺外科行NACT及手术治疗的137例早期BC患者的临床与病理资料行回顾性分析,根据化疗前HER-2状态分为HER-2低表达组(94例)和HER-2阴性组(43例),并进一步根据激素受体状态(HR+/-)划分为HR+/HER2-low组(74例)和HR+/HER2-zero组(28例)以及HR-/HER2-low组(20例)和HR-/HER2-zero组(15例)四个亚组。
1.2 纳入与排除标准 纳入标准:①年龄≥18岁。②经空心针或麦默通穿刺组织学证实为乳腺浸润性导管癌。③除禁忌症外均行细针涂片或空心针穿刺明确腋窝淋巴结状态。④临床I-III期,接受NACT后进行手术治疗,且手术方式以乳腺癌诊疗指南为严格指导。⑤临床与病理资料完整者。排除标准:①HER-2阳性(IHC +3或IHC +2 FISH/ISH扩增)或IHC +2 FISH/ISH不明确者。②肿瘤病理特征或临床资料不足者。③有同步或不同步乳腺癌史、或合并其他同步浸润性癌者。
1.3 HER-2阴性、低表达和ER、PR阳性阈值的评定标准 HER-2检测参考《乳腺癌HER-2检测指南(2019版)》[2]和《人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识2021版》[3]。HER-2阴性[4]为:IHC0,<1%细胞核着色;HER-2低表达为:IHC1+或IHC2+且FISH阴性,1%~10%细胞核着色。ER、PR免疫组织化学检测的阳性阈值[5]为≥1%。
1.4 NACT后肿瘤靶病灶的疗效评价、手术后病理评估与pCR的判定 NACT后靶病灶的疗效评价以RECIST1.1为指导,常规于每两个化疗周期后行乳腺超声、CT或MRI复查,并依据病情需要适当增加复查频次。完全缓解(Complete response,CR)为所有靶病灶消失、无新病灶出现;部分缓解(Partial response,PR)为靶病灶最大径之和减少≥30%;疾病进展(Progressive disease,PD)为靶病灶最大径之和至少增加≥20%或出现新病灶;疾病稳定(Stable disease,SD)为介于PR和PD之间;客观缓解率(Objective response rate,ORR)等于CR与PR之和。另外,如NACT过程中评估化疗效果欠佳,经乳腺肿瘤多学科讨论后改行手术或调整方案续行化疗。手术后病理评估以Miller&Payne(M&P)评分系统为参考,并将M&P5级且淋巴结阴性定义为pCR[6]。
1.5 观察指标 主要包括:两组患者一般资料,如年龄、BMI、月经状态、化疗方案和周期、手术方式。组间及亚组间NACT前临床与病理特征,如TNM分期、组织学分级、雌孕激素受体和Ki-67状态、分子亚型;NACT后病理特征及疗效评价,如靶病灶客观缓解率及腋窝淋巴结缩小比例、雌孕激素受体与Ki-67及术后腋窝淋巴结病理状态、病理M&P分级、组间及亚组间pCR率等相关指标。
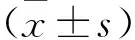
2 结果
2.1 两组患者患病率及亚组占比情况 HER2-low组患病率显著高于HER2-zero组(P<0.05),见表1。
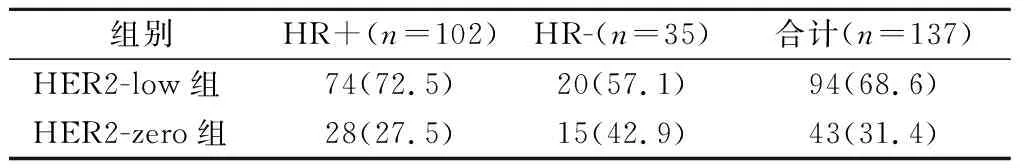
表1 两组患者患病率及各亚组占比情况[n(×10-2)]Table 1 Prevalence of patients in the two groups and proportion of each subgroup
2.2 两组患者一般资料比较 两组患者年龄、BMI、月经状态、化疗方案和周期、手术方式差异均无统计学意义(P>0.05),见表2。
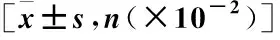
表2 两组患者一般资料对比Table 2 Comparison of general data of the two groups of patients
2.3 对两组患者NACT前的临床和病理指标比较 HER2-low组有较高的ER阳性率,且Ki-67<35%的比例显著低于HER2-zero组,差异均有统计学意义(P<0.05);但两组在cT(%)、 cN(%)、临床分期、组织学分级PR状态及分子亚型等方面差异均无统计学意义(P>0.05)。见表3。
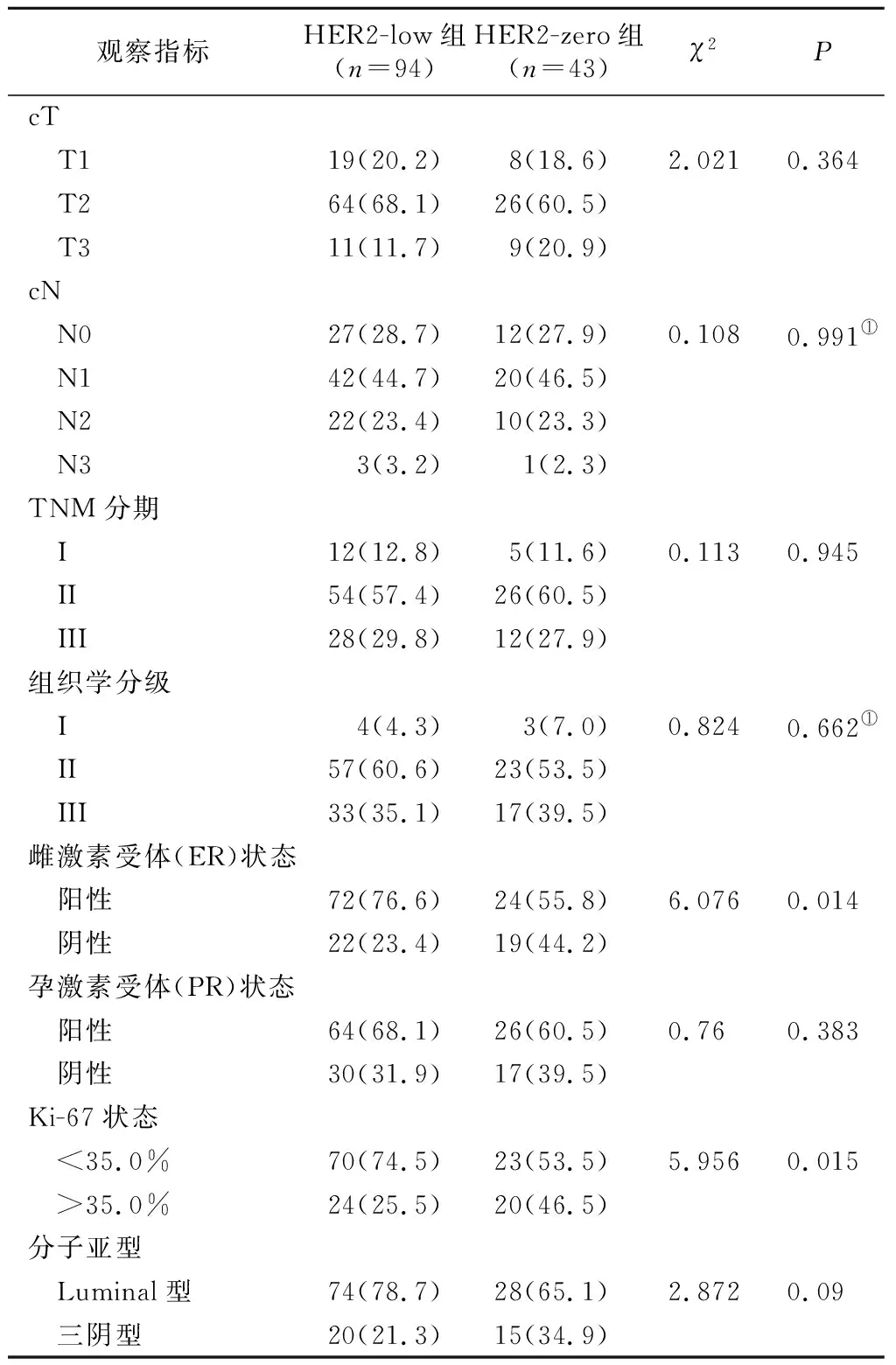
表3 两组患者NACT前临床与病理指标对比[n(×10-2)]Table 3 Comparison of pre-NACT clinical and pathological indexes in the two groups
2.4 两组患者NACT后行疗效评价及临床与病理指标比较 HER2-low组雌激素受体(ER)阳性率及Ki-67<35%的比例均较HER2-zero组高, HER2-low组ORR显著低于HER2-zero组,差异均有统计学意义(均P<0.05);但两组在腋窝淋巴结缩小比例、术后腋窝淋巴结病理状态、手术后M&P分级及组间pCR率等预后指标方面差异均无统计学意义(P>0.05)。见表4。
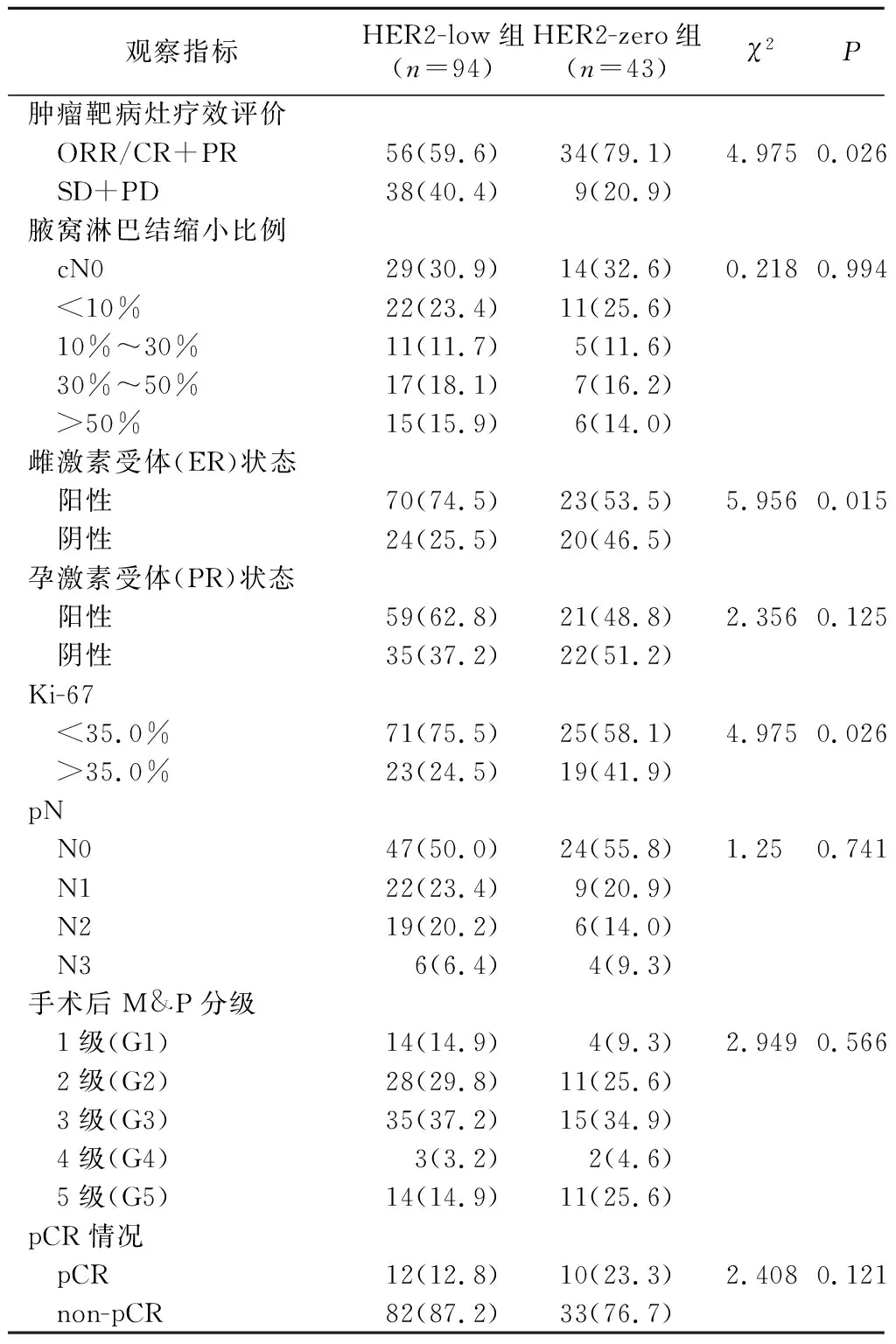
表4 两组患者NACT后临床与病理指标对比及疗效评价[n(×10-2)]Table 4 Comparison of clinical and pathological indexes and efficacy of NACT in the two groups
2.5 两组患者 HR-亚组间的pCR率比较 HR-亚组中HR+/HER2-low组的pCR率显著低于HR-/HER2-zero组(P<0.05),见表5。
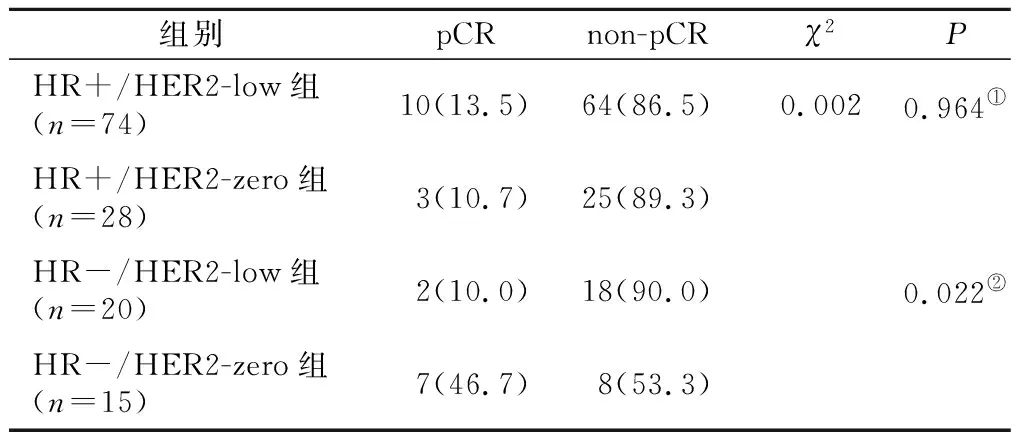
表5 亚组间pCR率对比[n(×10-2)]Table 5 Comparison of pCR rates between subgroups
2.6 HR-亚组患者行NACT前临床与病理指标对比 HR-/HER2-low组具有较高的组织学分级和较低的Ki-67<35%状态,差异均有统计学意义(P<0.05),见表6。
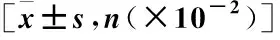
表6 HR-亚组患者NACT前临床与病理指标对比Table 6 Comparison of clinical and pathological indexes before NACT in HR-subgroups patients
3 讨论
HER-2状态在BC的疗效预测和预后判断中具有重要作用,根据浸润癌细胞膜染色的完整性和强弱分为阴性、低表达及阳性三种状态,研究[7-8]证实HER-2阳性已然获益于抗HER-2的治疗,HER-2低表达作为当前定义的中间状态,是否在临床特征及分子病理层面区别于HER-2阴性,是决定其能否潜在获益于抗HER-2治疗或新的治疗手段的前提。当前关于两者差异性的报道并不一致,而且现有关于转移性HER-2低表达BC患者中新型抗体-药物偶联物的最新结果对HER-2二分法提出了挑战[9]。本研究发现HER-2低表达较HER-2阴性BC有较高的患病率(68.6% vs 31.4%),国外报道[10-12]中其患病率在40%~50%之间,而一项纳入我国12467例HER-2真实世界的研究[13]发现其数量在临床中占比高达54%。不同患病率的原因在于ICH0和ICH1+之间的区别还没有临床意义,从而影响了病理学家评估的准确性,有研究在对ICH0的病例行复查后只有15%的一致性,多数被重新归类为ICH1+。也说明HER-2低表达BC的庞大数量,为此加强HER-2低表达群体特异性研究以期使此类患者的治疗更加精准化、多样化、临床获益最大化,对提升我国BC总体生存率具有重要意义。
在一般资料无差异的基础上,本研究发现HER2-low组在NACT前后均具有较高的ER阳性率(约75%),这在相关研究[14-17]中得到相似的结论(ER阳性率为60-85%),并认为HER-2低表达可以被鉴定为与HER-2阴性不同的临床实体,特别是在HR+亚组,可能存在更复杂的HER-2低表达分子景观。而且在总体人群中,HER-2低表达转移性BC的存活时间明显延长,在HR+亚组延长更为显著[23]。因此有研究[18]认为,转移性HR+较HR-/HER-2低表达BC的预后更好。这种结果可能在于HER-2与ER mRNA水平间重要相关性使ER蛋白高度表达[19],从而获得更多内分泌治疗机会,延长了生存周期。但也有研究[20]认为HER-2的低表达不影响预后,且复发率更高,并认为HER-2的低表达可能是HR+/BC治疗的抵抗因子,激素受体和HER2信号通路间的交叉作用干扰了内分泌治疗的效果。因此,HR+/HER-2低表达BC患者ER与HER-2间的密切联系是否会或如何去影响内分泌药物的治疗效果还有待进一步研究。本研究结果显示两组在腋窝淋巴结缩小比例、术后腋窝淋巴结病理状态、M&P分级及组间pCR率等预后指标方面差异无统计学意义,但HER2-low组靶病灶客观缓解率显著低于HER2-zero组,且在HR-/HER-2低表达BC亚组中的pCR率显著降低。基于此,本研究进一步对HR-亚组NACT前临床与病理指标行对比,发现HR-/HER2-low组出现更多的高组织学分级和更低的Ki-67状态。而且在组间HER2-low组Ki-67<35%的比例亦显著高于HER2-zero组,差异均有统计学意义。
尽管在Ki-67表达水平方面,本研究与既往研究[21]结果一致。但也有研究[14]认为HER-2阴性BC主要为II期肿瘤,而HER-2低表达BC出现更多的III期肿瘤但Ki-67中位数更低。Ki-67增殖指数是pCR的正向预测因子,也是影响生存的负向预后因子,Ki-67增殖指数高的肿瘤具有更强的生物学活性,而高组织学分级代表了更幼稚、异型性更明显、生长更活跃,恶性程度更高的肿瘤实体,与化疗效果及预后密切相关。本研究中HR-/HER-2低表达BC具有相对较高的组织学分级和较低的Ki-67状态,因此在一定程度上解释了其pCR率低的原因。
在NACT疗效方面,有研究[22]认为在非转移性环境中,HER-2低表达与HER-2阴性BC对NACT的反应没有显著影响,并在一项既往报道[23]中发现,两者的pCR率也没有显著差异。但也有报道[24]显示,HER-2低表达BC在NACT后的pCR率更低、随访时间点的复发/进展比例更高,并在一项纳入1098例BC的研究[17]中,HER-2低表达BC的pCR率明显低于HER-2阴性,且在HR+亚组中pCR率降低更为显著。本研究中两组在治疗手段上并无差别,但HER-2低表达BC的ORR值更低,因此这种治疗上的无差别性是否能够全面覆盖或精准针对HER-2低表达群体有待进一步去评判。但结合本研究结果及当前多数研究更倾向于HER-2低表达BC对化疗的反应性更差、pCR率更低、复发率更高,并认为其原因可能在于对经典化疗方案的反应较差[15],因此调整经典化疗方案可能带来潜在获益。
同时,最新研究[17]表明,新型抗体-药物偶联物的旁观者效应足够可以使HER-2低到中度表达即产生靶向治疗效应,认为HER-2低表达BC可能存在潜在的靶点[25]。另外,关于HER-2低表达的精准定量检测方法和重新定义也在积极探索[26],未来新的检测方法可能带来HER-2定量描述的变化。但本研究样本量偏少、单中心病理检查审核机制、回顾性研究性质以及单一的瘤体及腋窝淋巴结缩小的评价手段,并且缺乏患者的生存分析以进一步去验证两者的差异性,可能影响结果偏差,因此需进一步深入研究。
4 小结与展望
本研究结果提示,相较于HER-2阴性,HER-2低表达BC具有患病率和激素受体阳性率高、较低Ki-67表达水平,NACT后缩瘤效果较差,且在HR-亚组低pCR率等特征,同时发现HR-/HER-2低表达BC低pCR率与较高的组织学等级和较低的Ki-67状态相关。另外,未来HER-2低表达BC可能会依据激素受体状态(HR+/HR-)进一步细化,或依据新的定量检测方法赋予新的定义,甚至被定义为新的BC分子亚型,并对临床针对性、精准化和靶向治疗产生积极影响。

