抗白垩病相关SNP位点C2587245T在意大利蜜蜂雄蜂幼虫中的抗性鉴定
唐韶晗, 耿 龙, 武 尊, 曾照阳, 王子函, 梁立强,吕 洋,2, 许雪玲, 聂红毅, 李志国,*, 苏松坤,*
(1. 福建农林大学蜂学与生物医药学院, 福州 350002; 2. 黑龙江省农业科学院牡丹江分院, 牡丹江 157041)
蜜蜂是重要的传粉媒介和农业作物高产的关键因素之一(Morse and Calderone, 2000),但蜜蜂的健康同时面临着许多病原的威胁,例如蜜蜂病毒、真菌、寄生虫等(Allen and Ball, 1996)。其中蜜蜂白垩病是蜜蜂最主要的病原之一,蜜蜂白垩病又称美洲白垩病,是由寄生性病原引起的蜜蜂疾病,最早见于意大利蜜蜂Apismelliferaligustica(Aronstein and Murray, 2009),是由蜜蜂球囊菌Ascosphaeraapis感染蜜蜂幼虫而引起的一种真菌性疾病。蜜蜂球囊菌是异宗配合的子囊菌,子囊菌的异性菌丝通过相互接触产生孢子(Pöggeler, 2001; Heath, 2015)。球囊菌的孢子被幼虫摄食后进入肠道,在肠道的围食膜内萌发继而菌丝穿透幼虫体腔造成幼虫死亡,幼虫死亡后继续脱水干燥形成白垩状干尸(Spiltoir and Charles, 1955)。近年来,随着蜜蜂球囊菌基因组测序工作的完成,人们对蜜蜂球囊菌的研究也从形态学、病理学和流行学逐渐深入到转录调控和免疫应答等研究领域(Ansarietal., 2017),研究人员一直致力于寻找与蜜蜂抗白垩病相关的基因和位点。一些研究表明,蜜蜂抗白垩病性状可能与其免疫系统中的一些关键基因和单核苷酸多态性(single nucleotide polymorphism, SNP)位点有关(刘元珍等, 2019),如Defensin和Toll受体基因家族,这些基因在蜜蜂的免疫应答中起着重要作用(Aronstein and Saldivar, 2005; Wuetal., 2020),这些研究结果为我们后续进一步从分子层面防治蜜蜂白垩病奠定了基础(Qinetal., 2006)。
SNP是一种分子标记技术,具有准确度高、特异性强、重复性好、易检测、微量高效等特点,广泛应用于遗传育种的各个领域(Duan and Zhang, 2015; Keaneetal., 2016)。SNP技术在蜜蜂育种领域同样具有重要的应用,它可以帮助育种者更准确地选择具有期望性状的蜜蜂个体,从而加速育种进程、提高育种效率进而改进蜜蜂生产性状相关的品质(Jonesetal., 2020)。此外该技术也可分析蜜蜂基因组数据可用性,并发展多种遗传工具,通过SNP分析,育种者可以鉴定与抗病性相关的基因和位点,并选择携带这些有利基因的个体进行繁殖,从而提高整体蜜蜂群体的抗病能力(Liuetal., 2016)。育种者还可以使用SNP技术对蜜蜂个体进行基因分型,选择育种目标相关的基因进而培育具有高产、高抗病性、温和性格等优良经济性状的蜜蜂品系。此外数量性状位点(quantitative trait locus, QTL)的定位也可以识别与调控数量性状基因有关的DNA区,以及现代基因组技术(如微阵列和RNA-seq)也可用于基因表达分析,这些技术都加深我们对于蜜蜂转录网络这一问题的认识(Pageetal., 2016; Malankhanovaetal., 2017)。不仅如此,这类技术还可以方便地为育种项目寻找实用价值,并通过锁定候选基因培养具抗寄生虫、抗病原体的蜜蜂群体,从而快速地进行遗传筛选,进而降低种群选择的时间与费用。
随着分子技术的发展,蜜蜂幼虫抗白垩病能力相关基因位点筛选也较为完善。通过对不同蜂群进行病原接种,采用QTL技术,发现了幼虫11号染色体可能与幼虫抗白垩病具有显著联系(Hollowayetal., 2013),为幼虫抗白垩病研究提供了方向。后续对抗病蜂群和易感病蜂群的工蜂幼虫进行PCR和Sanger测序,从而筛选出和蜜蜂幼虫抗白垩病相关的SNP位点,最后筛选出1个可以评估蜂群抗白垩病能力的SNP位点C2587245T(Liuetal., 2016),并建立了分子标记辅助选育抗白垩病蜂群的理论基础。之后在SNP位点C2587245T的基础上,通过转录组测序技术对相关差异工蜂幼虫进行差异分析,筛选出抗白垩病相关的基因(Nieetal., 2020),为蜜蜂抗白垩病选育提供了研究基础。前人关于蜜蜂抗病性状相关的研究多以蜂王及工蜂为主,而雄蜂抗病能力的强弱对于蜂群抗病能力同样有很大影响,因此,雄蜂健康与品质已经成为蜜蜂抗病育种中一个不可忽视的方面(Rangel and Fisher, 2019)。以蜂王为首的蜂群显示了较强的抗病力与生产力,继而提高整个蜂群肠道菌群与整体稳态(Nowaketal., 2021)。但因各个蜂群中缺少抗病性雄蜂,导致蜂王婚飞质量不高,造成种群内部遗传多样性不足,打破种群内部稳态,给养蜂人带来经济损失(Rangel and Fisher, 2019)。雄蜂与雌性蜜蜂之间的基因表达差异可能对抗病性产生影响,为验证标记能否稳定地遗传到雄蜂体内,有必要在蜂群外接种并培育在SNP位点C2587245T具有不同基因型的雄蜂并分析其抗病性。本研究结合雄蜂单倍体的生物学特性,通过培育SNP位点C2587245T纯合的不同基因型的雄蜂从而成功地在雄蜂幼虫中表现出该位点的抗病强度,为分子标记辅助育种直接用于生产提供技术支撑。
1 材料与方法
1.1 试虫
本研究所用意大利蜜蜂蜂群购买自福州市福清蜂场,蜂种为蜂强1号,饲养于福建农林大学蜂学与生物医药学院。
1.2 主要试剂及仪器
Chelex-100(索宝来,北京), 1 mol/L DTT, Proteinase K和PCR反应体系试剂盒(Vazyme公司,南京),BWS-5恒温水槽水浴锅(一恒,上海)、低温高速离心机(Applied Biosysems,美国)、电泳仪(六一,北京)、全自动凝胶成像分析仪JS-690D型(培清,上海)、 PCR仪(Bio-Rad,美国)、 显微镜(Leica,德国)。
1.3 无伤害提取DNA
分别收集意大利蜜蜂蜂王蜕皮、1/2翅和1/3后足于1.5 mL离心管中,加入200 μL 5%的Chelex 100溶液、10 μL 20 mg/μL蛋白酶K和7 μL DTT溶液,观察样本位置,确保所有样本都浸泡在溶液里,55 ℃金属浴20 h,取出震荡混匀,100 ℃金属浴8 min,使蛋白酶变性,13 000 g离心3 min,吸取上清液,移至新的1.5 mL离心管中(苏松坤等, 2008)。根据DNA质量,选择最优的实验部位,进行后续实验。
1.4 蜜蜂球囊菌纯化培养、鉴定和孢子液的制备
制作MY-20培养基(葡萄糖200 g,琼脂粉20 g,蛋白胨4 g,酵母提取物3 g,使用无菌水定容至1 000 mL)。收集福建农林大学蜂场蜂箱巢门前的白垩病虫尸,将用次氯酸钠清洗过的白垩病虫尸剪成小段,放于培养基上,转移至33 ℃培养箱中。3 d后,将长出的白色菌丝用接种环接种在新的培养基上,进一步纯化待鉴定菌,7~10 d后菌丝间隙就可长出黑色孢子。取部分待鉴定菌菌丝收集于1.5 mL离心管中,采取酚氯仿提取DNA(王雪研, 2020),用提取的DNA为模板进行PCR,蜜蜂球囊菌5.8S rRNA基因扩增引物:F:5′-TGTCTGTGCGGCTAGG TG-3′;R:5′-CCACTAGAAGTAAATGATGGTTAGA-3′(James and Skinner, 2005)。PCR反应体系: Phanta Max Super-Fidelity DNA Polymerase 0.2 μL, 2×Phanta Max Buffer 5 μL, dNTP Mix 0.2 μL, 正反向引物 (10 μmol/L)各0.4 μL, 水2.8 μL, 蜜蜂球囊菌DNA模板 1 μL。反应程序: 94 ℃预变性5 min; 94 ℃变性30 s, 64 ℃退火30 s, 72 ℃延伸1 min, 35个循环; 72 ℃延伸8 min。委托福州博尚生物公司测序。将测序菌株命名为BE-1,将其与NCBI数据库里进行5.8S rRNA基因序列比对。从GenBank数据库中选取同源性较高的蜜蜂球囊菌菌株和不同亲缘关系的菌株5.8S rRNA基因序列,共选取14种菌株5.8S rRNA基因序列,加上本实验测定的BE-1,利用MEGA 7.0软件构建基于5.8S rRNA基因序列的系统发育树。
收集BE-1黑色孢子充分研磨破壁,10 000 g离心10 min,去上清液,重复3~5次,收集孢子悬浮液采用血球计数板统计孢子液浓度,将孢子液浓度稀释至5×104个孢子/μL,4 ℃保存。收集绿豆大小的BE-1孢子沉淀于1.5 mL离心管中,加500 mL电镜固定液室温固定2 h,委托武汉塞维尔生物公司进行电镜透射扫描,观察其孢子形态结构。
1.5 SNP位点C2587245T为T/T和C/C基因型的蜂王的筛选和处女王的培养
SNP位点C2587245T引物:F: 5′-GTCAAGGTA TCACAAGCGTCA-3′;R: 5′-ATAGTTCGCCCACGAC CA-3′(Liuetal., 2016)。对意大利蜜蜂多个蜂群蜂王进行取样,采用1.3节的方法提取蜂王DNA进行PCR,反应体系和程序同1.4节。PCR产物委托博尚公司测序,筛选出SNP位点为C/C和T/T基因型的蜂王。从筛选出的每个蜂群中收集40头未出房的工蜂幼虫,并对其进行SNP位点检测,统计其后代C/C和T/T基因型占比。选取C/C和T/T基因型占比高的蜂王进行移虫。在筛选出的蜂群中选取1-2日龄幼虫,用移虫针转移到育王杯中。放入1群哺育力强的蜂群中,从放入蜂群的那一天算起10 d时用囚王笼罩住王台,保护培育的处女王,避免出现部分蜂王提前出房而杀死其他未出房处女王的现象。等到处女王出房后,对培育出房的处女王进行基因型筛选,选择C/C和T/T基因型处女王,用CO2迷晕处女王几次,进而刺激处女王生产雄蜂卵。
1.6 雄蜂幼虫的室内饲养和抗病性检测
雄蜂幼虫食物:66%蜂王浆,3%果糖,3%葡萄糖, 28%无菌水(Behrensetal., 2007)。温度为34.5 ℃,相对湿度为97%左右。在C/C和T/T基因型处女王蜂群中用针式扣王笼将蜂王控制在一张新雄蜂脾上使之产卵,3 h后取下扣王笼,待蜂王爬到巢脾另一处后,再次进行限王产卵,3 h后重复以上步骤。移取雄蜂2日龄幼虫至放有预热好的50 μL食物的48孔板中,24 h后吸取残留食物,并继续饲喂雄蜂幼虫50 μL新鲜食物,4日龄时,在24孔板中加入100 μL新鲜食物,把48孔板中的幼虫个体转移至24孔板中,继续饲喂。后续每天同一时间饲喂150 μL新鲜食物,同时清理残留食物。直至饲喂到7日龄时停止饲喂,幼虫开始排泄时,则停止饲喂。记录该饲养方法下雄蜂幼虫的生长状态和计算进入育蛹期的比例。
采用上述饲养方法,3日龄时实验组T基因型雄蜂和C基因型雄蜂饲喂10 μL孢子浓度为5×104个孢子/μL的BE-1孢子悬液,对照组饲喂等量的无菌水,其他饲养条件与上述方法一致。接种BE-1当天为0 d,每24 h记录1次发病幼虫数量。每天观察并记录正常生长的幼虫数量,计算存活率,及时清理发病幼虫,避免发病幼虫对存活幼虫的影响。
1.7 数据分析
通过GramphPad Prism 8绘制生存曲线图,同时使用SPSS 24.0t检验对T基因型和C基因型雄蜂幼虫存活率进行进行差异显著性检验。
2 结果
2.1 蜜蜂球囊菌的形态学鉴定和分子生物学鉴定结果
待测菌白色菌丝由3处接种点长出,蔓延至整个培养基,在两部分菌丝交界处,长出黑色孢子(图1: A),该结果符合球囊菌孢子需要雌株和雄株交配才能产生的特性(Aronstein and Holloway, 2013)。通过对分离纯化的孢子进行扫描电子显微镜发现(图1: B),孢子呈现出直径3~4 μm×1.4~2 μm的椭圆形颗粒,该孢子的形状大小与蜜蜂球囊菌孢子的形态大小相一致。
对PCR扩增获得的490 bp的5.8S rRNA基因片段测序,将该序列提交至NCBI数据库进行相似度分析,分离菌BE-1的5.8S rRNA基因与蜜蜂球囊菌Ascosphaeraapis5.8S rRNA基因序列一致性最高。系统发育树结果显示(图2),BE-1 5.8S rRNA基因与参考蜜蜂球囊菌5.8S rRNA基因(GenBank登录号: MN701962.1)的亲缘关系最近。通过对分离菌的形态学鉴定和分子生物学鉴定可知,分离出来的菌株为蜜蜂球囊菌,可以用于后续实验。
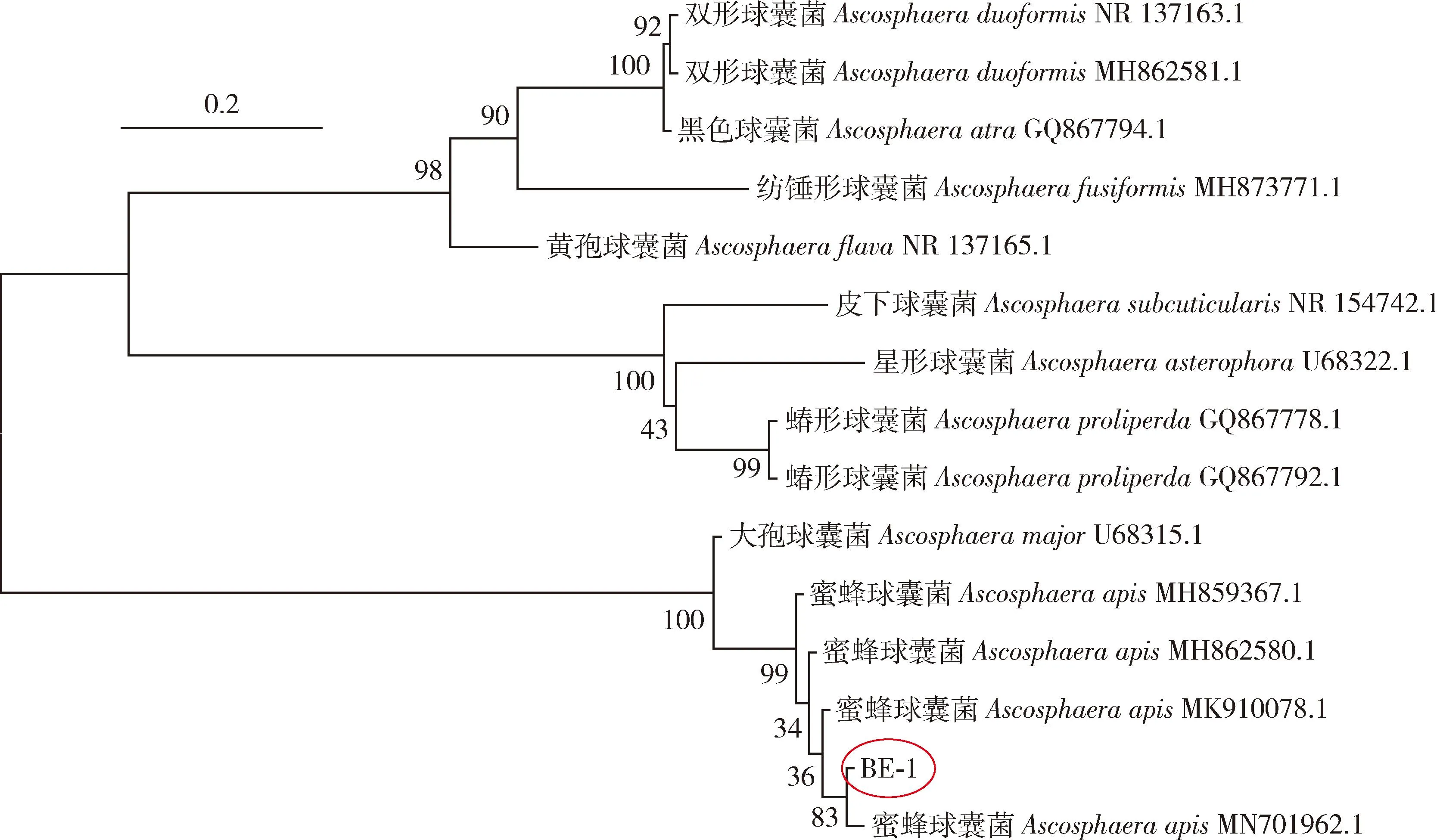
图2 基于菌株BE-1和其他球囊属菌株5.8S rRNA基因序列构建的系统发育树
2.2 筛选到的SNP位点C2587245T C/C和T/T基因型蜂王和后代工蜂基因型占比
从每头蜂王不同组织中提取的DNA,发现翅和后足提取的DNA质量最高且最稳定,翅相较于后足对蜂王影响最小,故从多头蜂王翅DNA的PCR增产物中根据SNP位点C2587245T等位基因频率,筛选出4头C/C基因型蜂王和4头T/T基因型蜂王,其后代工蜂测序结果显示(图3),4头C/C基因型蜂王后代C/C基因型工蜂占比分别为40%, 30%, 0和20%。4头T/T蜂王后代T/T工蜂占比分别为90%, 50%, 30%和100%。后续处女王的培养从后代纯合度最高的几头蜂王中培育。

图3 意大利蜜蜂蜂王SNP位点C2587245T 等位基因频率测序
2.3 人工饲养的SNP位点C2587245T C和T基因型意大利蜜蜂雄蜂幼虫及其抗病性
对照组在饲喂无菌水后6 d时雄蜂幼虫的生长发育状况良好,有95%的幼虫个体完成排泄进入预蛹期,并无发病迹象(图4: A, B),该饲养方法可以保证意大利蜜蜂雄蜂幼虫在实验室条件的正常生长发育。在处理组中,接种5×104个孢子/μL蜜蜂球囊菌悬液后3 d时T基因型雄蜂幼虫已经开始出现死亡,部分个体长出白色菌丝(图4: C),C基因型雄蜂幼虫发育正常,没有出现任何死亡和发病迹象(图4: D)。在接种后6 d时T基因型雄蜂幼虫已经大面积长出白色菌丝,只有个别幼虫个体存活(图4: E),但C基因型雄蜂幼虫个别长出白色菌丝,部分幼虫个体死亡(图4: F),可以得出,C基因型雄蜂和T基因型雄蜂对抵抗白垩病的能力具有差异。
2.4 接种蜜蜂球囊菌后SNP位点C2587245T C和T基因型意大利蜜蜂雄蜂幼虫存活率
根据图5幼虫存活率曲线可知,C和T基因型雄蜂幼虫之间存活率从接种蜜蜂球囊菌后3 d时开始出现差异,随后差异在接种后6 d时达到最大值。饲喂无菌水的对照组中,排除机械操作死亡的个体,其存活率一直为100%。C和T基因型雄蜂幼虫3~10 d存活率具有极其显著差异(P<0.0001),其中在接种后6 d时存活率差异达到最大,T基因型雄蜂幼虫在接种后3 d时开始出现发病个体,发病占比为6.63%,接种后6 d时发病个体占比达到55.61%。相比之下,C基因型雄蜂幼虫在接种后5 d时才开始出现发病个体,发病个体占比1.02%,到接种后6 d时其发病率为7.14%。

图5 SNP位点C2587245T C和T基因型意大利蜜蜂雄蜂3日龄幼虫接种蜜蜂球囊菌后存活率曲线
3 讨论
目前多个物种都已经开发出无伤害提取DNA的技术,可以确保不损伤个体的前提下,获取该个体的DNA,进行后续实验。在螺类上,潘贤辉等(2022)开发了一种无伤害提取螺类DNA的方法,这种方法通过使用一种特殊的化学试剂,将DNA从外壳表面或者体液中提取出来,而不需要破坏细胞膜;在甲螨上,陈燕南等(2022)结合了试剂盒DNA提取法,提出一套针对甲螨无形态损伤的高效DNA提取方法;而高艳和卜云(2014)结合自行配制的试剂和商业化试剂盒, 以弹尾纲(Collembola)、双尾纲(Diplura)和原尾纲(Protura)3类微小节肢动物为实验材料, 摸索出一种可望在微小节肢动物中推广的无形态损伤的DNA提取方法;在克氏原鳌虾上,陆超平和马源潮(2018)通过裂解液和蛋白酶K放入粘液里水浴裂解细胞的方式快速有效的获取克氏原螯虾DNA,不受蛋白质的污染。本研究采取的无伤害提取活体蜜蜂DNA的方法可以在不伤害蜜蜂的情况下提取高质量的蜂王和雄蜂的DNA。蜂王在其婚飞归巢后,几乎不会再出蜂巢活动,所以在获取蜂王1/3翅后,不会影响蜂王的正常活动。在分子辅助选育的过程中,提取蜜蜂DNA用于筛选特定基因型的蜜蜂是必不可少的环节,对于育种者来说,具有优良性状的蜜蜂是很珍贵的,所以该方法对于在不影响蜜蜂生活的前提下来筛选出需要的特定基因型的蜂群至关重要。
从对照组的幼虫生长状况可以看出,本研究采用的雄蜂饲养技术满足雄蜂幼虫的正常生长条件,可以使95%的雄蜂幼虫进入育蛹期,该方法可以用于实验室内雄蜂幼虫的饲养方法。目前相比较于工蜂的人工饲养方法,几乎没有关于雄蜂幼虫的饲养方法,而雄蜂和工蜂的生物学差异,致使很难通过工蜂的饲养条件来饲养雄蜂,这也从根本上阻碍了雄蜂的相关研究,本研究的饲养方法为后续雄蜂幼虫的相关实验提供了研究基础。此外,接种后的4-10 d时C基因型雄蜂幼虫和T基因型雄蜂幼虫之间的存活率差异都为极其显著,然而在接种后6 d时差异达到最大值(图5)。T基因型雄蜂幼虫在接种后3 d时开始出现发病个体,发病占比为6.63%,接种后6 d时发病个体占比达到55.61%。相比之下,C基因型雄蜂幼虫在接种后5 d时才开始出现发病个体,发病个体为1.02%,到接种后6 d时其发病率为7.14%。这说明在该SNP位点差异的雄蜂在抗白垩病的能力上确实存在显著的差异。雄蜂在蜂群中承担着与处女蜂王交尾的作用。相对于工蜂和蜂王,虽然雄蜂在蜂群中的数量较少,产生的直接经济价值较少,且其生命周期较短。进而造成雄蜂的抗病性研究相对较少的现象,大部分关注点还是在工蜂和蜂王的抗病性研究上。然而,雄蜂的健康状况对整个蜂群的生存和繁殖至关重要。雄蜂由于其具有单倍体、可以自由进出其他蜂群等特点,相比于工蜂和蜂王而言,更容易受到病原体感染,如狄斯瓦螨、球囊菌等。在被病原侵染后,雄蜂在生理和基因表达方面可能与其他蜜蜂个体有所不同。本研究为日后雄蜂幼虫的人工饲养提供了方法基础并为后续培育抗白垩病蜂群中雄蜂的选择提供了依据。
随着蜜蜂抗病育种的发展,分子标记辅助已经成为目前培育高产抗病蜂种的研究重点,目前在抗螨、微孢子虫、白垩病和美洲幼虫腐臭病等方面都已经筛选出许多QTL(Behrens Detal., 2011, 2014; Hollowayetal., 2013; Huangetal., 2014),但由于小样本作图QTL区间过大,且数量性状受环境影响过大(Würschum and Kraft, 2014),可能会导致QTL的检测和对QTL效应评估发生偏离,许多检测出来的位点,在一个群体或者家系中定位到的QTL可能不适用于另一个家系或者群体。因此QTL的验证和鉴定时非常重要。研究人员Holloway等(2013)开展了一项研究,探究蜜蜂幼虫的抗白垩病性状与SNP位点之间的关系,发现蜜蜂幼虫第2和11号染色体上的SNP位点与抗病性状有显著关联,这项研究为蜜蜂抗白垩病的分子辅助选育提供了基础。2014年通过重测序技术筛选出蜜蜂中特有的1 620个与抗白垩病相关的SNP位点,这些筛选出来的SNP位点有680个位点位于编码区,其中在蜜蜂第11号染色体上有118个SNP位点,第2号染色体上有52个SNP位点(晏励民, 2014)。之后刘元珍等通过筛选出了抗病幼虫个体和易感病幼虫个体,得到了一个能够评估蜂群抗白垩病能力的SNP位点C2587245T(Liuetal., 2016)。该标记位于MRJP5基因的第2个内含子区域内。在抗白垩病蜂群中,C等位基因频率显著高于易感病蜂群,且具有高C位点频率的蜂群白垩病发病率较低。王雪妍(2020)在该SNP位点C2587245T基础上,对C/C基因型工蜂和T/T基因型工蜂进行了转录组测序,筛选西方蜜蜂工蜂抗白垩病的相关基因。本研究在SNP位点C2587245T的基础上,利用雄蜂单倍纯合体的生物学特性,进行白垩病抗性实验,相比其他SNP位点的验证而言,增加了活体雄蜂幼虫的抗病性实验,进一步验证该SNP位点的遗传稳定性和抗病性。结果证明该SNP位点C2587245T,有助于增加蜜蜂种群的整体抗病能力,降低白垩病等疾病的发生率。通过培育抗性强的蜜蜂品种能够减少疾病给蜜蜂业带来的经济损失,提高蜜蜂产品的产量和品质。并且培育抗病性强的蜜蜂品种有助于减少对化学药物的依赖,降低对蜜蜂和环境的负面影响。
在本研究中发现,感染蜜蜂球囊菌的意大利蜜蜂C和T基因型雄蜂幼虫在发病时间和发病症状等方面具有极其显著的差异(图4),对于意大利蜜蜂雄蜂幼虫中抗白垩病相关SNP位点的抗性鉴定研究,能够揭示该位点的差异与抗白垩病之间的相关性。通过确定这种关联,我们可以更好地了解这个位点的差异对蜜蜂免疫系统的影响,不仅如此,通过抗白垩病相关SNP位点的抗性鉴定研究还能够帮助我们更好地了解雄蜂幼虫免疫系统的免疫机制,并为培育更抗病的蜜蜂品种提供重要的信息和指导。这为后续雄蜂转录组测序的差异样本选择提供了选择基础。也为后续通过转录组测序,筛选出相关免疫的差异基因;为探究雄蜂和工蜂在免疫相关基因表达方面的差异提供基础。此SNP位点C2587245T在蜜蜂抗白垩病抗性机制中具体发挥的作用有待于后续通过RNAi和CRISP/Cas9等技术手段进一步探究。

