程序性死亡受体1/程序性死亡受体配体1抑制剂联合抗血管生成药物治疗晚期肝细胞癌的临床研究进展Δ
江 雪,葛晓英,郑 丹,鲍蕾蕾#
(1.江西中医药大学药学院,南昌 330004; 2.海军军医大学第三附属医院药剂科,上海 200438)
肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌最常见的类型,其发病率和病死率逐年升高。大多数HCC患者被确诊时已为中晚期,主要采用系统抗肿瘤治疗[1]。其中,靶向程序性死亡受体1(PD-1)/程序性死亡受体配体1(PD-L1)抑制剂在治疗HCC方面具有巨大的潜力,但Ⅲ期临床研究结果发现,PD-1/PD-L1抑制剂单药治疗的生存率未优于标准治疗[2-3]。因此,对于晚期HCC,可能需要PD-1/PD-L1抑制剂联合其他治疗方法,从而达到更好的抗肿瘤效果。目前,PD-1/PD-L1抑制剂联合抗血管生成药物治疗晚期HCC的方案被批准用于一线治疗的有阿替利珠单抗联合贝伐珠单抗(简称“T+A”)、信迪利单抗联合贝伐珠单抗类似物IBI305(简称“双达”)和卡瑞利珠单抗联合阿帕替尼(简称“双艾”)。本文针对上述3种方案治疗晚期HCC的临床研究进展进行综合阐述。
1 PD-1/PD-L1抑制剂联合抗血管生成药物的协同作用机制
PD-1是一种免疫检查点受体,主要在激活后的成熟T细胞、B细胞、自然杀伤细胞(NK细胞)、树突状细胞(DC)和单核细胞中表达[4-6]。PD-L1是PD-1的配体,主要在肿瘤细胞、肿瘤浸润细胞和抗原呈递细胞(APC)中表达[7-8]。T细胞表面的PD-1与肿瘤细胞表面的PD-L1结合后,会抑制T细胞的增殖和细胞因子的释放,导致T细胞凋亡,从而诱导肿瘤细胞发生免疫逃逸[9]。因此,免疫治疗可以通过阻断PD-1/PD-L1来抑制肿瘤细胞生长。HCC是一种具有高微血管密度的高度血管化的实体瘤,肿瘤的生长依赖于新血管的生成。血管内皮生长因子(VEGF)是肿瘤血管生成的主要介质[10]。抗血管生成药物分为大分子单抗药物和小分子多激酶抑制剂,可以通过阻断VEGF及其受体来抑制肿瘤内新血管的生成[11]。
PD-1/PD-L1和VEGF除了调控自己的下游分子外,还能介导免疫应答的不同步骤[12]。因此在晚期HCC中,PD-1/PD-L1抑制剂和抗血管生成药物联合治疗在作用机制上存在互补和协同的关系。PD-1/PD-L1抑制剂可以增加DC、CD8+T细胞和NK细胞的募集和活化,并促进M1抗肿瘤巨噬细胞表型[13]。抗血管生成药物不仅可以诱导肿瘤血管正常化,还能减少缺氧,增加成熟DC的数量和功能,促进CD8+T淋巴细胞的肿瘤浸润,降低骨髓来源的抑制细胞和调节性T细胞的浸润和活性,并额外减少M2巨噬细胞极化,最终将免疫抑制转为免疫激活的肿瘤微环境,从而增强PD-1/PD-L1抑制剂的疗效[14-16]。因此,上述2类药物联合治疗可以更大程度地攻击肿瘤,达到更好的治疗效果。
2 PD-1/PD-L1抑制剂联合抗血管生成药物一线治疗晚期HCC的临床研究
2.1 “T+A”组合
联合治疗晚期HCC的Ⅰb期研究结果表明,相比于阿替利珠单抗单药治疗,“T+A”组合的中位无进展生存期(mPFS)延长至5.6个月,并且具有良好的安全性和有希望的抗肿瘤活性[17]。Finn等[18]进行了一项全球性的Ⅲ期研究(IMbrave150研究),共纳入501例接受“T+A”治疗(n=336)或索拉非尼治疗(n=165)从前没有接受过全身治疗的不可切除HCC患者,结果显示,“T+A”联合治疗和索拉非尼治疗组患者的12个月总生存率分别为67.2%和54.6%,mPFS分别为6.8和4.3个月。相较于索拉非尼,“T+A”组合可显著改善总生存期(OS)和无进展生存期(PFS),并且“T+A”组合的耐受性良好,毒性也更容易受控。接下来12个月的随访数据表明,“T+A”组合的中位总生存期(mOS)为19.2个月,索拉非尼的mOS为13.4个月,联合治疗比索拉非尼延长了5.8个月,但相关不良反应的严重程度仍然相似[19]。上述数据证实了“T+A”组合是治疗晚期HCC的目前获益较大的措施之一,并被《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南(2020)》[20]和《晚期肝细胞癌的全身治疗:ASCO指南》[21]推荐为晚期HCC一线治疗方案。
2.2 “双达”组合
联合治疗晚期HCC的Ⅰb期研究结果显示,“双达”组合具有明确的疗效和可控的安全性[22]。Ren等[23]进行了1项国内的Ⅱ—Ⅲ期研究(ORIENT-32研究),共纳入571例接受“双达”治疗(n=380)或索拉非尼治疗(n=191)的不可切除的中国HCC患者。结果显示,“双达”组合的mPFS为4.6个月,索拉非尼的mPFS为2.8个月,“双达”组合的mOS还未达到,但明显长于索拉非尼(10.4个月),并且该联合疗法降低了死亡风险和进展风险,具有可耐受和可控的安全性。对于中国肝癌患者,“双达”组合的疗效更具参考价值,因为纳入的不可切除HCC患者中有94%为乙型肝炎患者。该方案的获批使得信迪利单抗成为首个获批用于肝癌一线治疗的国产PD-1,为不可切除或转移性肝癌患者提供了新的治疗选择。
2.3 “双艾”组合
联合治疗晚期HCC的Ⅱ期研究结果显示,“双艾”组合具有较高的客观缓解率(ORR)、疾病控制率和可接受的不良反应[24]。Qin等[25]进行了1项全球性的Ⅲ期研究(CARES-310研究),共纳入543例接受“双艾”治疗(n=272)或索拉非尼治疗(n=271)的不可切除HCC患者。结果表明,“双艾”组合和索拉非尼的mPFS分别为5.6和3.7个月,“双艾”组合的mOS明显长于索拉非尼(22.1个月vs. 15.2个月)。与索拉非尼相比,联合治疗的死亡风险降低了38%,获得了更高的反应率和疾病控制率。因此,“双艾”组合是晚期HCC的一种新的一线治疗选择。
3 3种组合治疗晚期HCC的Ⅲ期临床研究的差异性
3.1 患者基线特征的差异性
虽然3种联合用药组合都是PD-1/PD-L1抑制剂联合抗血管生成药物,Ⅲ期临床研究设计相似,但IMbrave150研究、ORIENT-32研究和CARES-310研究三者之间还是存有区别。ORIENT-32研究仅在我国进行,而IMbrave150研究、 CARES-310研究均为国际研究,因此,研究的患者基线特征存在差异,见表1。比较上述3项研究中接受联合治疗的患者基线特征发现,ORIENT-32研究中接受联合治疗的患者中位年龄为53岁,患者较为年轻,且患者中乙型肝炎病毒(HBV)感染比例最高,美国东部肿瘤协作组(ECOG)表现状态为1的患者较多,高甲胎蛋白患者比例较高,肝外转移发生率很高,以及既往接受局部治疗的患者最多。CARES-310研究纳入患者情况与ORIENT-32研究相似。相对而言,IMbrave150研究纳入的HBV相关HCC患者感染比例只有38%。上述数据说明,与其他国家的患者相比,我国HBV相关HCC患者的特点为年龄较小,ECOG表现状态不佳,肝外扩展的可能性增加,肿瘤负担高,既往接受局部治疗的可能性增加,肝功能差并且伴有肝硬化。
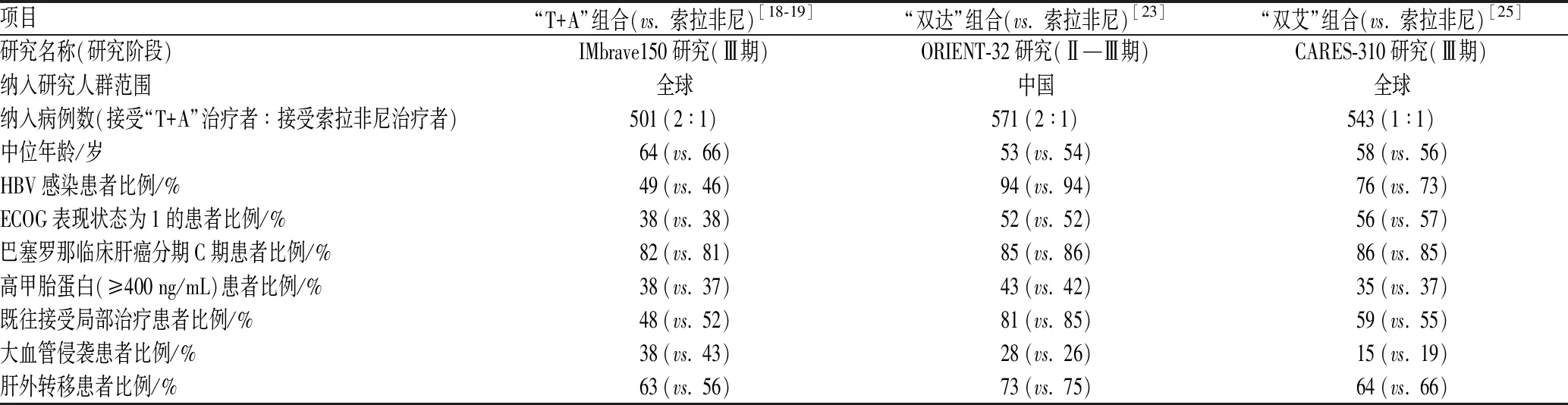
表1 3项研究的患者基线特征
3.2 临床结局和不良反应的差异性
由于纳入人群范围和治疗药物的不同,导致3项临床研究的临床结局和不良反应发生率也存在差异,见表2。

表2 3项研究的临床结局和不良反应发生率
(1)3项临床研究中的ORR不同,虽然IMbrave150研究的更新数据显示“T+A”组合的ORR为30%,但其实CARES-310研究的ORR改善幅度(25%vs. 6%)与其一致。相较于上述2项研究,ORIENT-32研究中“双达”组合的ORR只有21%。最新报道显示,“双艾”组合的mOS长达22.1个月,高于“T+A”组合。迄今为止,“双达”组合在我国晚期HCC患者中的OS还未达到。(2)3项临床研究的任何级别相关治疗不良反应(TRAE)的发生率均约98%,CARES-310研究中“双艾”组合的3级及以上TRAE的发生率较高,但大多数患者得到了充分的管理治疗。例如,“双艾”组合中高血压的发生率要远高于其他2个组合,而且该研究中索拉非尼组的高血压发生率也高于其他2项研究,可能是因为 CARES-310研究人群中ECOG表现状态为1且在基线时接受过局部治疗的患者比例较高,其更容易发生高血压。此外,“双艾”组合中一些常见的3级以上TRAE的发生率高于索拉非尼组,可能是因为该联合治疗时间为索拉非尼的2倍,治疗后的安全访问时间也更长。反应性皮肤毛细血管内皮增生症是“双艾”组合特有的不良事件,是卡瑞利珠单抗具有的一种皮肤相关不良事件[26]。但与卡瑞利珠单药治疗相比,联合治疗可显著降低皮肤毛细血管内皮反应性增生的发生率,可能通过阻断VEGF及其受体来抑制皮肤毛细血管内皮反应性增生的发生[24,27]。其他常见的3级及以上TRAE的发生率见表3。

表3 3项研究中常见的3级及以上TRAE的发生率(%)
4 讨论
PD-1/PD-L1抑制剂联合抗血管生成药物给晚期HCC患者带来了生存益处,意味着两者联合治疗是晚期HCC的一个较好的选择,目前已基本成为主流治疗方案[28]。然而,近年来有些联合治疗的Ⅲ期临床研究未得出阳性结果。Kelley等[29]进行的一项Ⅲ期研究结果显示,与索拉非尼相比,阿替利珠单抗联合卡博替尼治疗显著改善了PFS,其mPFS为6.8个月,但联合治疗的mOS与索拉非尼相似(15.4个月vs. 15.5个月),差异无统计学意义(P>0.05)。帕博利珠单抗联合仑伐替尼治疗不可切除的HCC患者的Ⅰb期研究结果表明,二者合用表现出有希望的抗肿瘤活性和可控的毒性[30]。但在Ⅲ期研究结果中,OS(P=0.022 7)未达到预测的统计学差异(P<0.018 5),PFS(P=0.046 6)亦未达到预先规定的统计学意义(P<0.002),研究以仑伐替尼为对照组,联合治疗不能显著改善mOS(21.2个月vs. 19个月)和mPFS(8.2个月vs. 8个月);相比于REFLECT研究中仑伐替尼的mOS和mPFS(13.6和7.4个月)[31],该研究中仑伐替尼的mOS和mPFS显著延长[32]。Kelley等[29]的Ⅲ期研究结果显示,索拉非尼的mOS长达15.5个月。如果该Ⅲ期研究选用索拉非尼作为对照组,可能会取得阳性结果。虽然上述2项临床研究没有表现出差异性的结果,但目前仍有越来越多PD-1/PD-L1抑制剂与抗血管生成药物联合治疗的临床研究正在进行中,见表4。

表4 PD-1/PD-L1抑制剂联合抗血管生成药物治疗晚期HCC的在研临床试验
在真实世界中,PD-1/PD-L1抑制剂和抗血管生成药物的3种组合治疗晚期HCC患者的有效性与临床研究疗效基本相似。目前已发现在不同区域的晚期HCC患者中,“T+A”组合治疗显示出相似的疗效结果,与临床研究基本一致[33-35]。D’Alessio等[36]进行了1项多中心真实世界研究,不同于Ⅲ期临床研究排除了肝功能分级为Child-Pugh-B级的患者,该研究共纳入154 例(占76%)Child-Pugh-A级的患者,48例(占24%)Child-Pugh-B级的患者,结果显示,与 Child-Pugh-A级患者相比,Child-Pugh-B级患者具有相似的耐受性。Kim等[37]首次比较了“T+A”组合与仑伐替尼在真实世界中治疗不可切除的HCC的疗效和安全性,结果表明,两种治疗方式的疗效相当,组间OS、PFS的差异无统计学意义(P>0.05)。Zeng等[38]评估了“双达”组合在我国晚期HCC患者真实队列中的疗效和耐受性,结果显示,mOS和mPFS分别为344和238 d,有13%的患者发生3级及以上不良事件。研究表明,“双达”组合在实际临床实践中对晚期HCC患者具有良好的临床益处和耐受性。然而,2023年被批准为一线治疗的“双艾”组合在真实世界的研究数据还处于匮乏的状态。
综上所述,PD-1/PD-L1抑制剂与抗血管生成药物联合治疗晚期HCC存在协同互补的作用,抗血管生成药物可显著提高PD-1/PD-L1抑制剂的疗效。目前,PD-1/PD-L1抑制剂与抗血管生成药物联合治疗晚期HCC的临床研究表明,相比于索拉非尼,联合治疗的总体肿瘤反应有所改善,疾病进展减少,PFS相对延长,复发风险降低,不良反应相当。从3种联合用药方案的临床研究中发现,“双达”组合的研究纳入的基本都是HBV相关晚期HCC患者,可能更符合我国临床现状。HCC的发病较为复杂,不同的患者发病机制不同,发病状况不同,可能伴随肝炎病毒感染、代谢性肝病等,都会导致HCC免疫微环境的改变,因此,针对患者的精准用药和个体化用药是晚期HCC治疗研究的重点和难点。PD-1/PD-L1抑制剂与抗血管生成药物联合治疗开启了晚期HCC联合疗法的新时代,许多评估各种免疫疗法组合的临床研究正在进行中,期待这些研究的数据能扩展HCC管理中的治疗策略,为延长晚期HCC患者的生存期提供帮助。

