他汀类药物用于非酒精性脂肪性肝病的疗效与安全性的Meta分析及GRADE评价Δ
张学沛,唐秀能,郑悟华,冯艳玲,李双田,张宏亮3#
(1.广西壮族自治区妇幼保健院临床药学科,南宁530000; 2.南宁市第一人民医院药学部,南宁 530000; 3.广西医科大学第一附属医院药学部,南宁 530021)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是全球最常见的慢性肝病之一,疾病谱包括单纯性肝脂肪变性和非酒精性脂肪性肝炎,部分最终发展为肝硬化,甚至演变为肝细胞癌[1]。据估计,全球约25%的成年人和高达70%的2型糖尿病患者患有NAFLD,我国NAFLD的患病率为6%~27%,NAFLD已成为我国第一大慢性肝病和健康体检肝生物化学指标异常的首要原因[2-3]。NAFLD相关的肝脏并发症也将成为未来10年内最常见的肝移植原因[4]。然而,迄今为止尚无特定的药物被批准用于治疗NAFLD。
NAFLD发病机制复杂多样,有大量证据表明NAFLD是动脉粥样硬化性心血管疾病(ASCVD)的一个未被充分认识和独立的危险因素,而ASCVD是NAFLD患者死亡的主要原因[5]。肝脂肪变性是从孤立的肝脏脂肪堆积到严重的炎症和坏死,因此,NAFLD患者的血脂管理至关重要。他汀类药物为3-羟基-3-甲基戊二酰辅酶A还原酶抑制剂,是血脂异常降脂药物治疗的基石,且在ASCVD高危人群一级预防中可显著减少心血管事件,目前临床上有阿托伐他汀、瑞舒伐他汀、匹伐他汀、洛伐他汀、普伐他汀、辛伐他汀和氟伐他汀等[6]。他汀类药物的不良反应一直是临床关注的问题,出于对其肝毒性的担忧,慢性肝病患者尤其是氨基转移酶升高的患者常未得到他汀类药物治疗。然而,近10年来不断有研究发现他汀类药物除降血脂外,还具有抗氧化、抗炎、新生血管生成等多效性,对NAFLD的治疗提供了新的可能,表现为减少肝脂肪蓄积,改善氧化应激,延缓纤维化,降低肝硬化失代偿和肝细胞癌发生率等[7-9]。目前,关于他汀类药物治疗NAFLD的研究数据仍多来源于临床前及观察性研究,且各研究结论不一[10-15]。基于该背景,本研究通过检索他汀类药物用于NAFLD的随机对照试验(RCT)进行Meta分析,评价其有效性和安全性,旨在为临床合理用药提供参考。
1 资料与方法
1.1 纳入与排除标准
(1)研究对象:经组织病理学或影像学诊断为NAFLD的患者。(2)观察组干预措施:他汀类药物,且不限品种、生产企业、剂型、规格;对照组干预措施:非他汀类药物或安慰剂、生活方式干预。(3)研究类型:RCT,语种不限。(4)结局指标:丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、γ-谷氨酰转移酶(GGT)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、肝脏组织学变化(肝脏超声或肝组织病理检查)以及不良反应发生率。(5)排除标准:①纳入人群合并其他病毒性肝病的研究;②观察组采用他汀类药物与其他调节血脂药或护肝药联合应用的研究;③数据不足,重复发表或无法获取全文的研究;④非RCT,综述、会议摘要、病例报告、动物实验研究。
1.2 文献检索方法
计算机检索PubMed、Embase、the Cochrane Library、MEDLINE、中国生物医学文献数据库、万方数据库、中国知网、维普数据库等,检索他汀类药物治疗NAFLD的RCT研究。检索时间均为建库至2022年7月。检索词包括“他汀”“非酒精性脂肪性肝病”“非酒精性脂肪性肝炎”“Statins”“Hydroxymethylglutaryl-CoA reductase inhibitors”“Non-alcoholic fatty liver disease”和“Non-alcoholic steatohepatitis”。
1.3 文献筛选、资料提取与质量评价
由2名评价员利用NoteExpress文献管理器剔除重复文献,根据纳入与排除标准筛选文献并提取数据。若有歧义,由第3名评价员(张宏亮)讨论解决。采用Cochrane系统评价员手册6.3版推荐的偏倚风险评估工具对纳入的RCT进行质量评价,采用GRADE pro3.6软件对结局指标进行证据级别评价[16]。
1.4 统计学方法
采用RevMan 5.4软件进行Meta分析。计数资料采用优势比(OR)和95%CI表示,连续性变量采用加权均数差(WMD)和95%CI表示。异质性由χ2检验和I2检验判断。若P>0.1,I2<50%,则各研究间无异质性,采用固定效应模型;反之,则采用随机效应模型。P<0.05为差异有统计学意义。分析治疗前后变化值时,采用Cochrane手册的公式1和公式2计算治疗前后差值的均数及标准差[16]。公式1:M差值=M治疗后-M治疗前;公式2:SD差值2=SD治疗前2+SD治疗后2-2×SD治疗前×SD治疗后×0.5。
2 结果
2.1 文献纳入情况
系统检索数据库获得605篇相关文献,包括中文文献315篇,英文文献290篇;剔除重复研究及不符合纳入标准的文献,剩余45篇;通过阅读全文,最后纳入7篇RCT文献,其中6篇为中文文献,1篇为英文文献,见图1。
2.2 纳入研究的基本特征及偏倚风险评价
纳入研究的基本特征和质量评价见表1—2。纳入研究的偏倚风险评估见图2。纳入的7项研究中,在盲法实施方面较差,存在中高风险;随机化、数据完整性和报告结果完整性较好;综合评估,所纳入的研究均为中等偏倚风险。
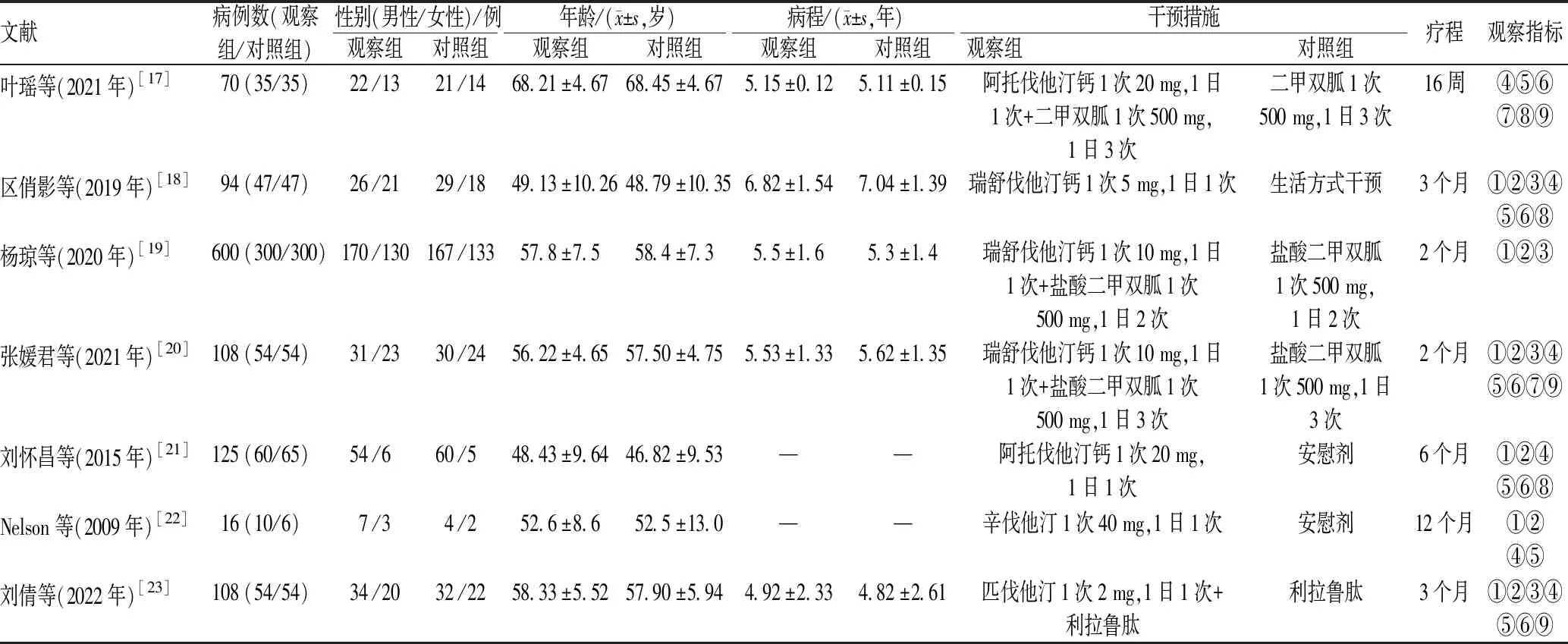
表1 纳入研究的基本特征

表2 纳入研究的质量评价
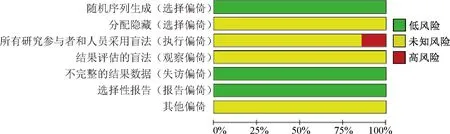
图2 纳入研究的偏倚风险条形图
2.3 Meta分析结果
2.3.1 ALT:6项研究[18-23]比较了治疗前后ALT水平变化,其中3项研究[18-20]采用瑞舒伐他汀,1项研究[21]采用阿托伐他汀,1项研究[22]采用辛伐他汀,1项研究[23]采用匹伐他汀。由于他汀类药物不同品种在药物代谢途径、脂溶性及药理学特性等方面的区别,导致疗效有差别,故根据他汀类药物不同品种进行亚组分析。各研究间存在异质性(P<0.1,I2=77%),采用随机效应模型。Meta分析结果显示,观察组患者ALT水平降低幅度优于对照组,差异有统计学意义(WMD=-10.45,95%CI=-15.49~-5.41,P<0.000 1),见图3。敏感性分析结果显示,逐一剔除纳入研究合并效应量,差异仍有统计学意义(P<0.05)。

图3 观察组与对照组患者ALT水平比较的Meta分析森林图
2.3.2 AST:6项研究[18-23]比较了治疗前后AST水平变化,其中3项研究[18-20]采用瑞舒伐他汀,1项研究[21]采用阿托伐他汀,1项研究[22]采用辛伐他汀,1项研究[23]采用匹伐他汀。各研究间存在异质性(P<0.1,I2=86%),采用随机效应模型。Meta分析结果显示,观察组患者AST水平降低幅度优于对照组,差异有统计学意义(WMD=-9.59,95%CI=-13.03~-6.15,P<0.000 01),见图4。敏感性分析结果显示,逐一剔除纳入研究合并效应量,差异仍有统计学意义(P<0.05)。
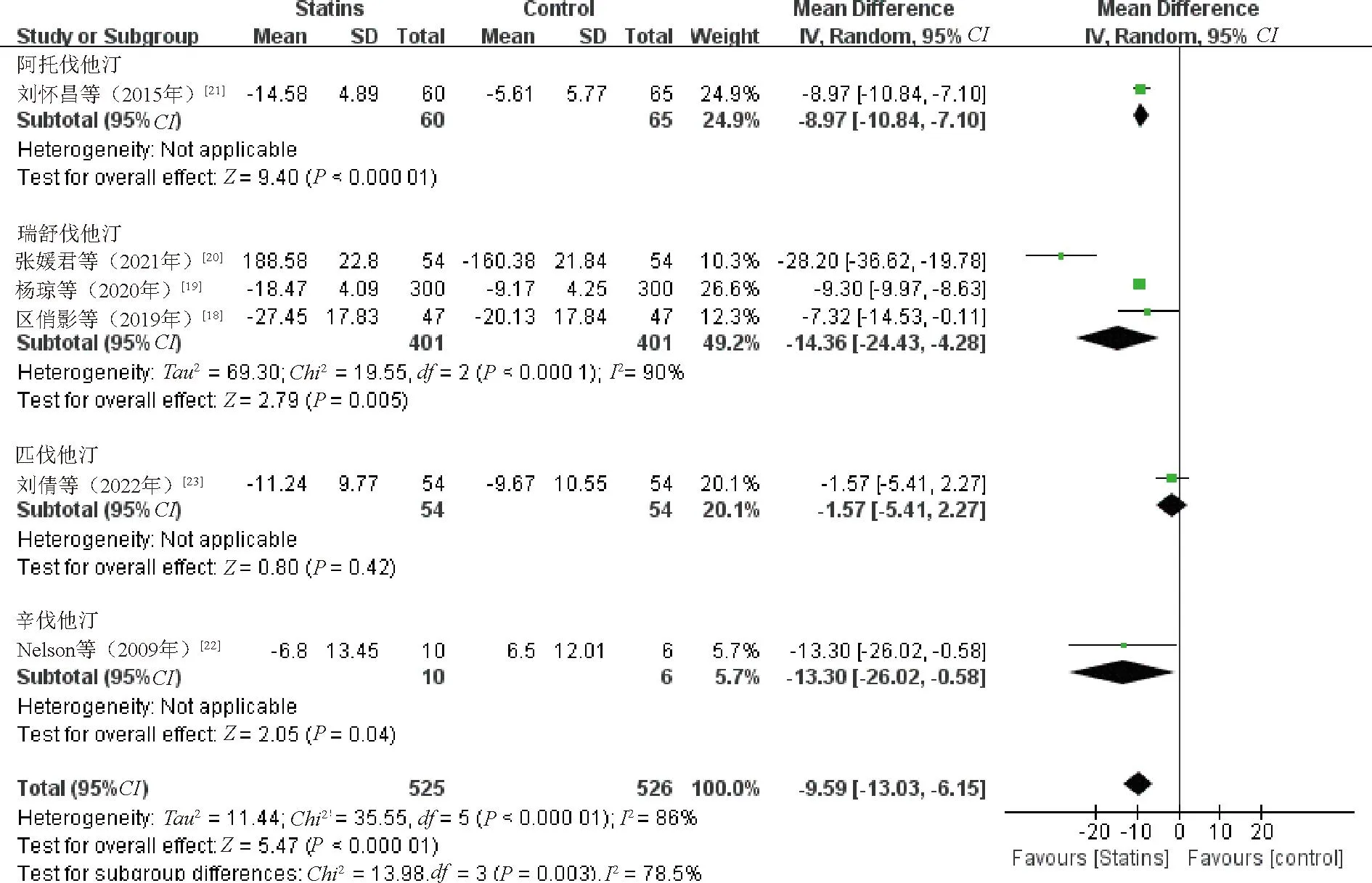
图4 观察组与对照组患者AST水平比较的Meta分析森林图
2.3.3 GGT:4项研究[18-20,23]比较了治疗前后GGT水平变化。各研究间存在异质性(P<0.1,I2=94%),采用随机效应模型。Meta分析结果显示,观察组患者GGT水平降低幅度优于对照组,差异有统计学意义(WMD=-6.37,95%CI=-9.90~-2.84,P=0.000 4),见图5。敏感性分析结果显示,逐一剔除纳入研究合并效应量,差异仍有统计学意义(P<0.05)。
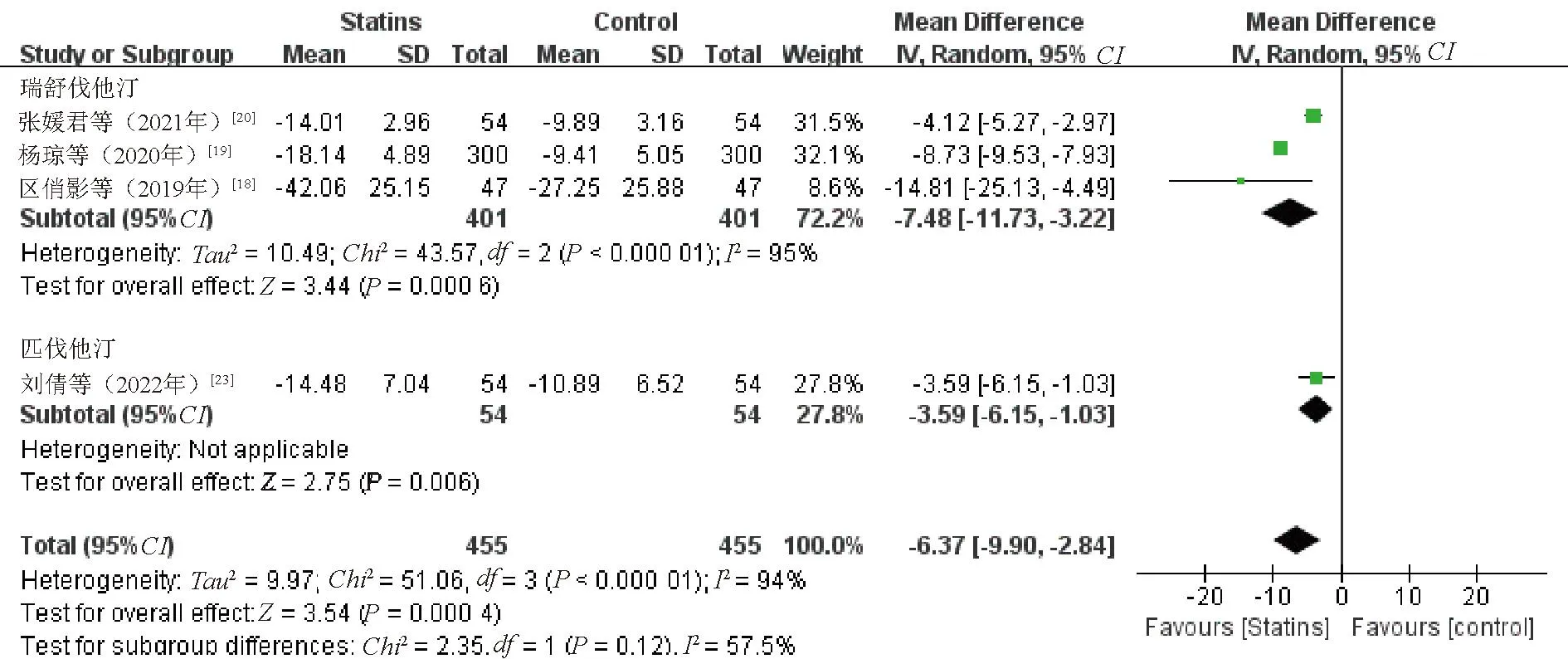
图5 观察组与对照组患者GGT水平比较的Meta分析森林图
2.3.4 TC:6项研究[17-18,20-23]比较了治疗前后TC水平变化。各研究间存在异质性(P<0.1,I2=69%),采用随机效应模型。Meta分析结果显示,观察组患者TC水平降低幅度优于对照组,差异有统计学意义(WMD=-0.80,95%CI=-1.07~-0.53,P<0.000 01),见图6。敏感性分析结果显示,逐一剔除纳入研究合并效应量,差异仍有统计学意义(P<0.05)。
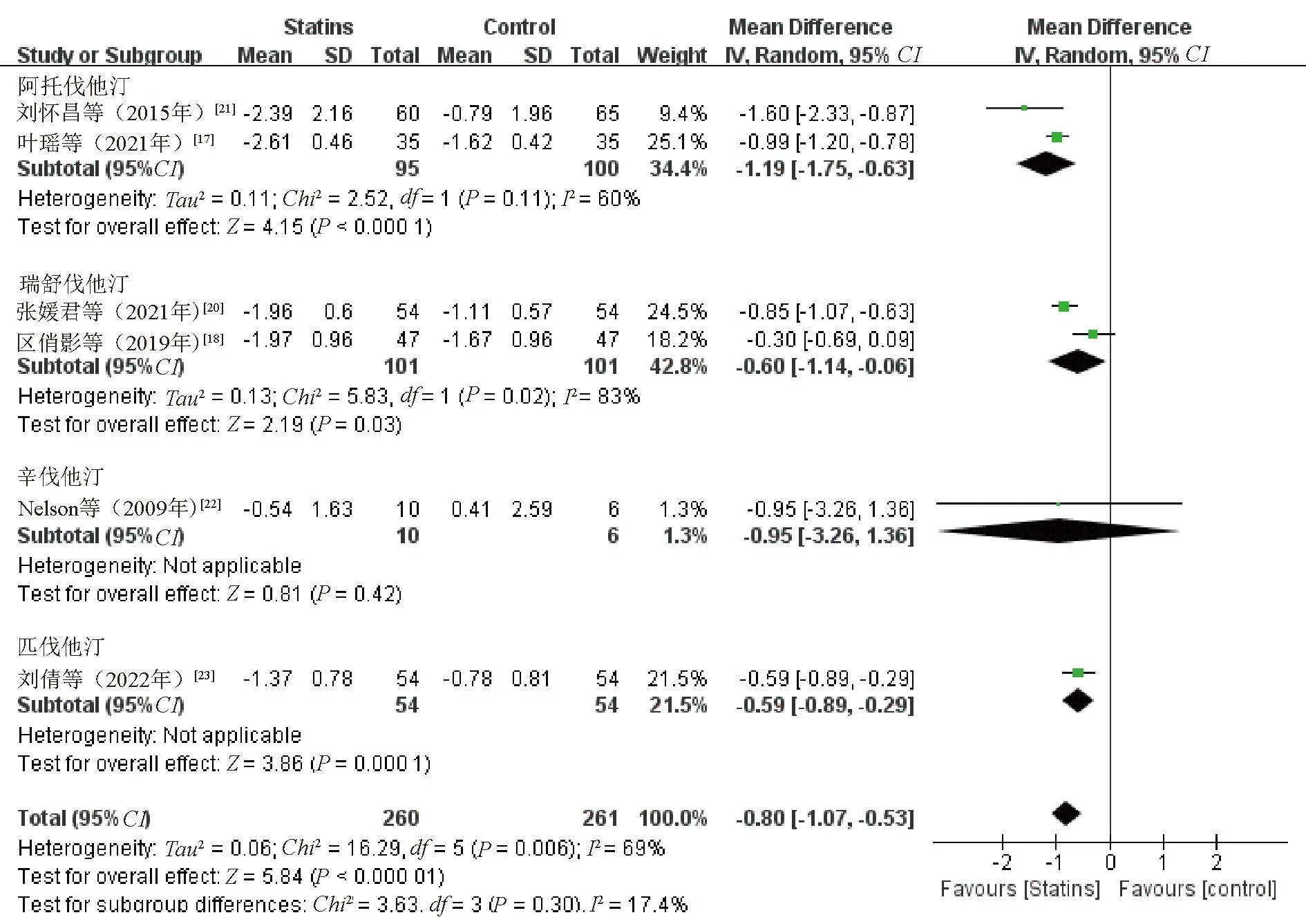
图6 观察组与对照组患者TC水平比较的Meta分析森林图
2.3.5 TG:6项研究[17-18,20-23]比较了治疗前后TG水平变化,各研究间无统计学异质性(P=0.43,I2=0%),采用固定效应模型。Meta分析结果显示,观察组患者TG水平降低幅度优于对照组,差异有统计学意义(WMD=-0.32,95%CI=-0.41~-0.24,P<0.000 01),见图7。敏感性分析结果显示,逐一剔除纳入研究合并效应量,差异仍有统计学意义(P<0.05)。
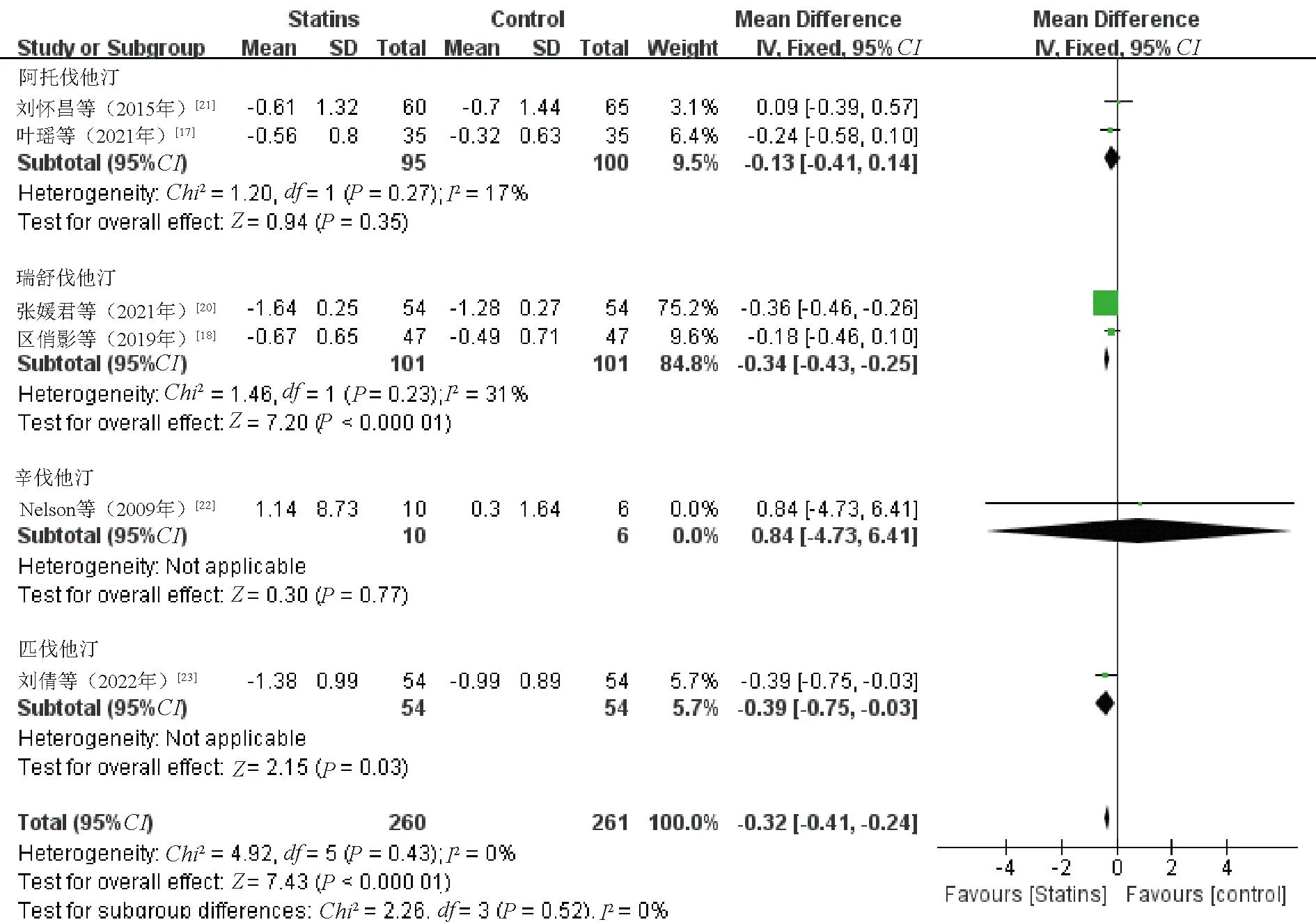
图7 观察组与对照组患者TG水平比较的Meta分析森林图
2.3.6 LDL-C:5项研究[17-18,20-21,23]比较了治疗前后LDL-C水平变化,Meta分析结果显示,观察组患者LDL-C水平降低幅度优于对照组,差异有统计学意义(WMD=-0.59,95%CI=-1.03~-0.15,P=0.009),见图8。敏感性分析中,逐一剔除纳入研究,发现剔除文献[17]、文献[20]、文献[23]后合并效应量,P>0.05,考虑存在报告偏倚。
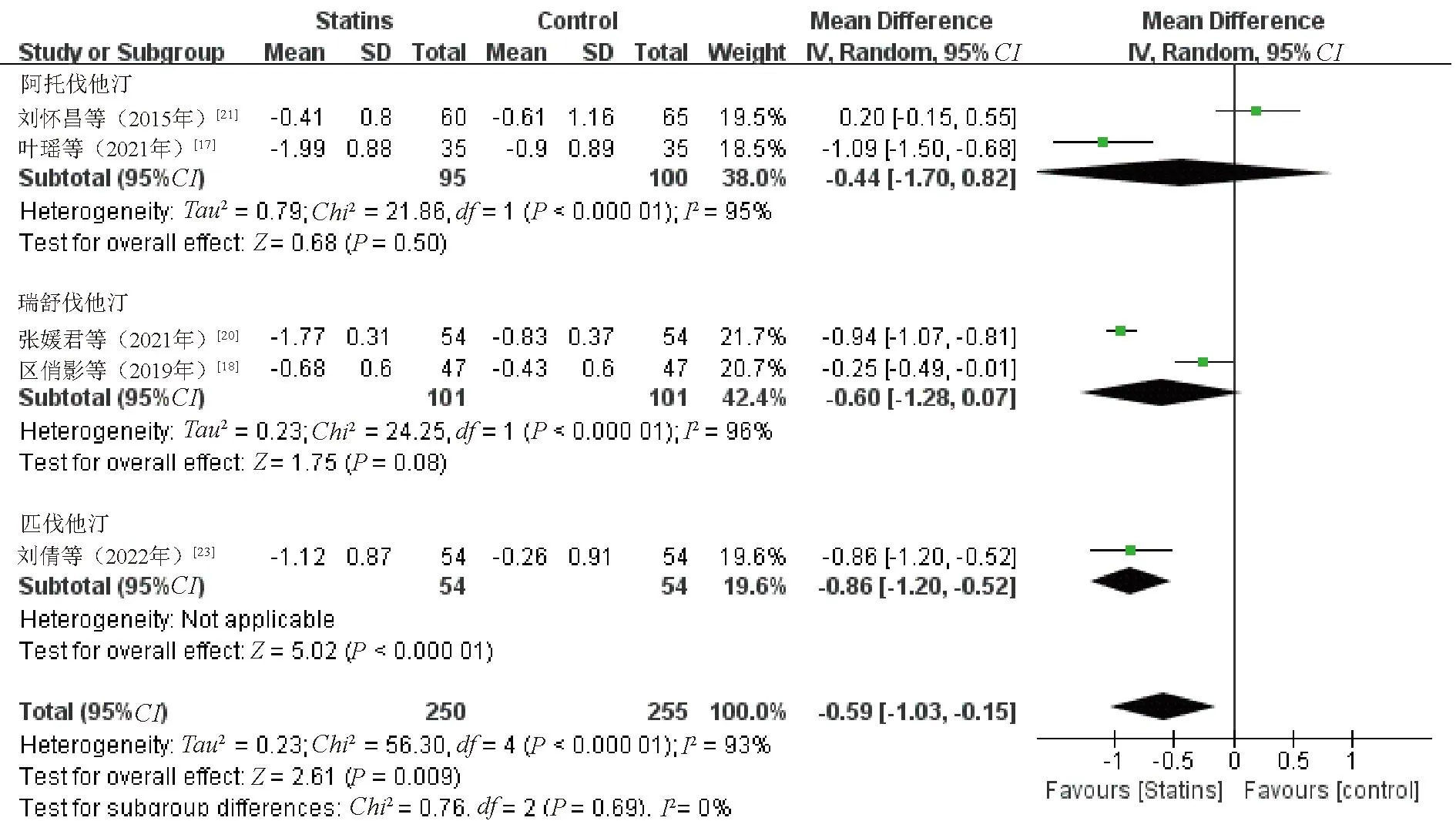
图8 观察组与对照组患者LDL-C水平比较的Meta分析森林图
2.3.7 HDL-C:2项研究[17,20]比较了治疗前后HDL-C水平变化。Meta分析结果显示,观察组患者HDL-C水平升高幅度优于对照组,差异有统计学意义(WMD=0.54,95%CI=0.15~0.93,P=0.007),见图9。因纳入研究较少,不排除存在报告偏倚。
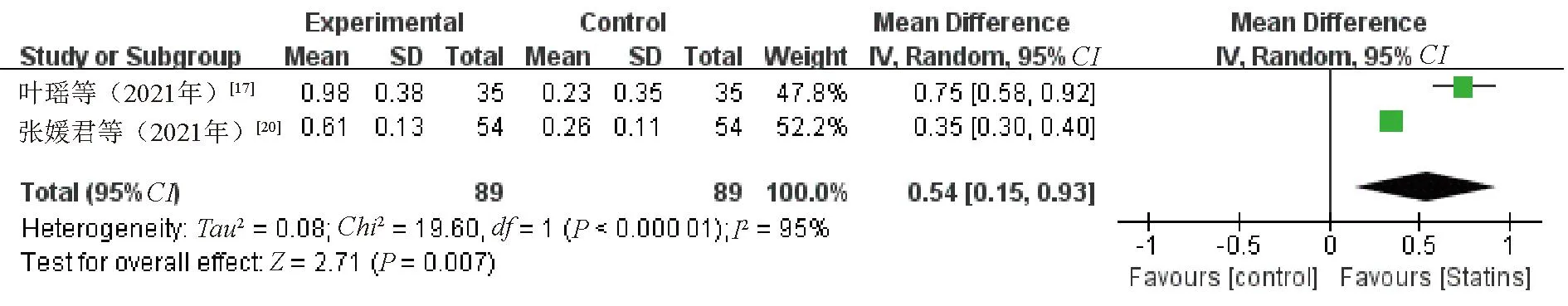
图9 观察组与对照组患者HDL-C水平比较的Meta分析森林图
2.3.8 肝脏超声改善情况:3项研究[17-18,21]评估了肝脏超声脂肪浸润改善程度。Meta分析结果显示,观察组患者肝脏超声改善情况较对照组更显著,差异有统计学意义(OR=2.79,95%CI=1.59~4.90,P=0.000 4),见图10。敏感性分析结果显示,逐一剔除纳入研究合并效应量,差异仍有统计学意义(P<0.05)。
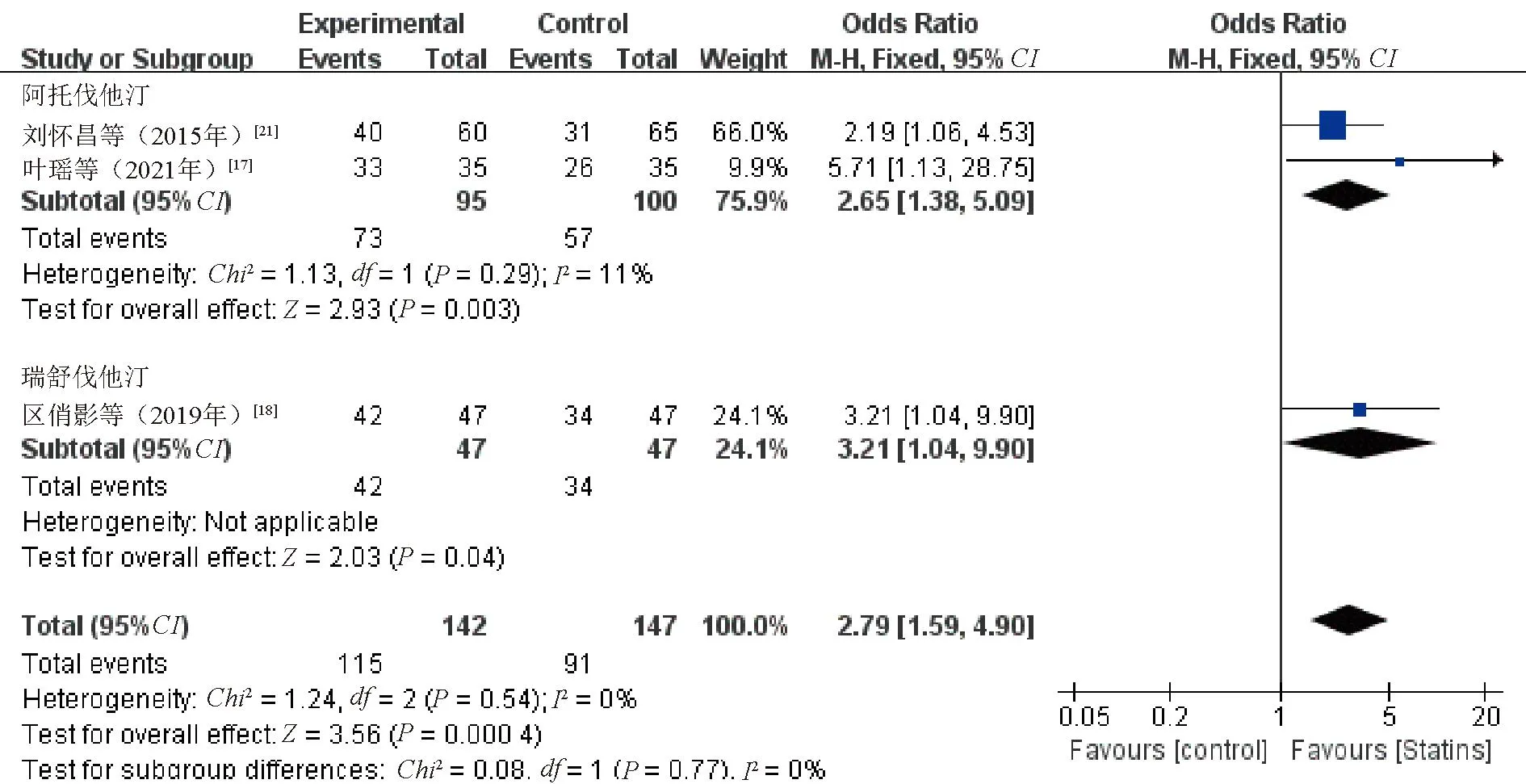
图10 观察组与对照组患者肝脏超声改善情况比较的Meta分析森林图
2.3.9 不良反应:他汀类药物常见不良反应主要为肝酶升高,但通常与剂量相关,偶有胃肠道不良反应、瘙痒、腹泻,罕见肌痛、横纹肌溶解。有3项研究[17,20,23]记录了不良反应发生情况,其中1项研究[17]报告两组患者均未发生不良反应,其余2项研究[20,23]比较了两组患者不良反应发生率。Meta分析结果显示,两组患者不良反应发生率的差异无统计学意义(OR=1.00,95%CI=0.44~2.27,P=1.00),提示他汀类药物治疗未增加不良反应发生风险,见图11。因纳入研究较少,不排除存在报告偏倚。
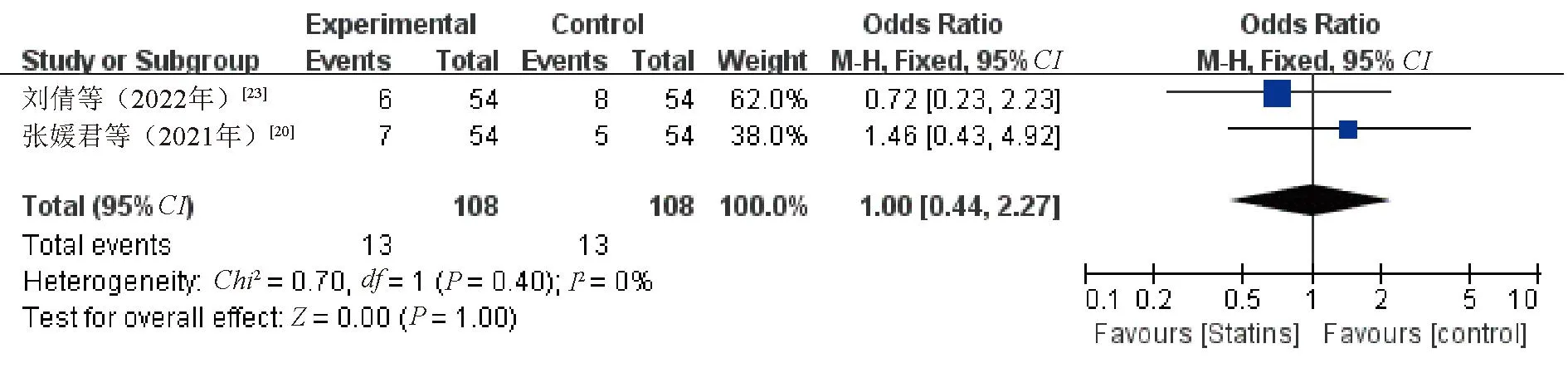
图11 观察组与对照组患者不良反应发生率比较的Meta分析森林图
2.4 报告偏倚评估
Meta分析通常采用直观的漏斗图分析报告偏倚,但当研究数<10篇时,漏斗图提示的偏倚意义不大。本研究纳入分析的研究仅7篇,因HDL-C及不良反应均仅纳入2篇文献,无法进行敏感性分析;将其余指标通过逐一剔除纳入研究后再合并Meta分析,结果显示,除LDL-C外,剩余指标的Meta分析结果稳健。
2.5 GRADE系统推荐分级
对纳入Meta分析的9个结局指标进行证据等级评价,结果显示,TG为中级质量证据,ALT、AST、GGT、TC、肝脏超声改善情况、不良反应发生率为低质量证据,LDL-C、HDL-C为极低质量证据,见表3。
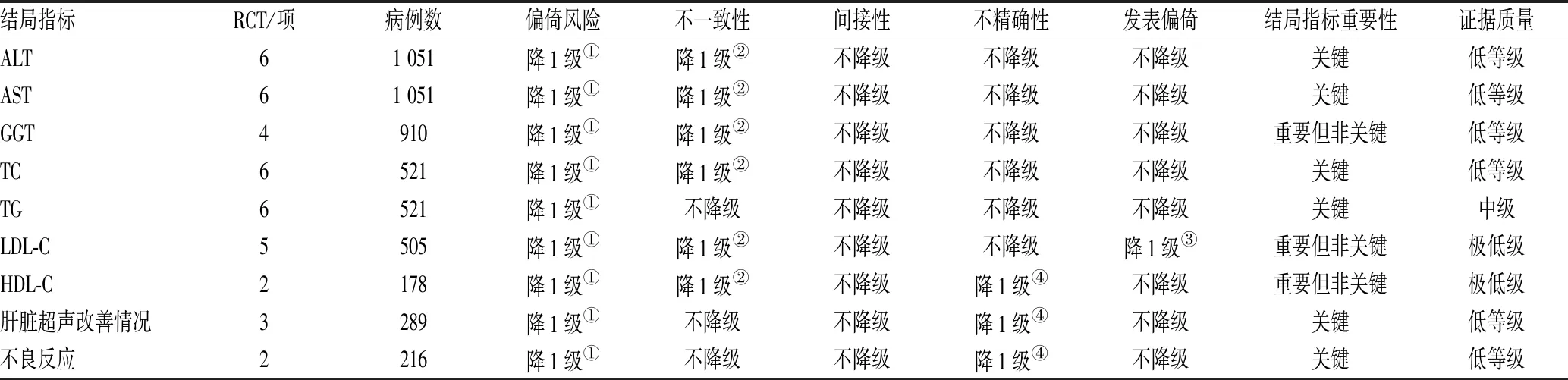
表3 结局指标的GRADE证据质量评价结果
3 讨论
NAFLD是全球最常见的慢性肝病之一,且患病率逐年升高,据估计,到2030年,全球与NAFLD相关的终末期肝病负担将从64%升至156%[24]。至今尚未有获得美国食品药品监督管理局(FDA)批准用于治疗NAFLD的药物。生活方式改变、减重仍是NAFLD治疗的基石,但对大部分患者和临床医师来说都是一个挑战,难以长期维持,因此药物治疗尤为重要[25]。NAFLD是脂质代谢严重系统性紊乱的结果,NAFLD严重程度与ASCVD发生率相关,ASCVD是NAFLD患者死亡的主要原因[5]。他汀类药物作为血脂异常药物治疗基石,可显著降低血清TC、LDL-C、TG水平和升高HDL-C水平,在人类ASCVD防治史上具有里程碑式的意义[6]。鉴于对他汀类药物肝毒性的担心,是否应在慢性肝病患者尤其是肝酶基线升高的患者中使用他汀类药物,医师常常面临两难境地[26]。近年来,不断有研究发现他汀类药物可对NAFLD治疗发挥积极作用。Lee等[27]研究发现,他汀类药物的使用降低了NAFLD发生风险以及NAFLD发生后进展为肝纤维化的风险。Mitsiou等[28]研究发现,接受瑞舒伐他汀治疗的NAFLD患者肝酶降至正常水平,且高剂量瑞舒伐他汀可更多地减少脂肪变性。然而,现有他汀类药物治疗NAFLD的研究数据多来源于临床前及观察性研究,尚缺乏高级别循证依据。
本次Meta分析纳入了7篇RCT文献(1篇外文,6篇中文),共1 121例患者。偏倚风险评估提示,均为中等偏倚风险。Meta分析结果表明,他汀类药物可显著降低NAFLD患者的ALT、AST、GGT、TC、TG、LDL-C水平,升高HDL-C水平,改善肝脏组织学变化。安全性分析结果提示,NAFLD患者接受他汀类药物治疗未增加不良反应发生风险,整体耐受性良好。虽然报告LDL-C指标的研究存在发表偏倚,但仍观察到观察组和对照组患者LDL-C水平均较基线降低。异质性来源考虑可能是他汀类药物品种不同,效价存在差异,且不同他汀类药物的提取、代谢、清除途径不同,可能发生的药物相互作用不同,如辛伐他汀和阿托伐他汀由CYP3A4代谢,而瑞舒伐他汀、匹伐他汀主要通过非肝药酶CYP转化清除[29-30]。部分NAFLD患者合并2型糖尿病、ASCVD或真菌感染,若联合应用CYP3A4抑制剂(如伊曲康唑、伏立康唑等),可增加主要由CYP3A4代谢的他汀类药物的血药浓度。此外,剂量、疗程不同也是异质性来源。GRADE评价结果显示,除TG为中级质量证据外,其余结局指标为低等级或极低等级质量证据。
本研究的创新点:(1)采用了Meta分析和GRADE软件综合评价他汀类药物用于NAFLD的疗效与安全性,对临床用药的指导意义更强。(2)结局指标涉及肝功能生化检查(ALT、AST、GGT)、血脂检查(TC、TG、LDL-C、HDL-C)、肝脏超声检查以及不良反应发生率等方面,评价更全面。(3)对他汀类药物不同品种进行了亚组分析,可为临床选药提供参考。
本研究的局限性:(1)现有的他汀类药物包括阿托伐他汀、瑞舒伐他汀、匹伐他汀、洛伐他汀、普伐他汀、辛伐他汀、氟伐他汀等,不同他汀类药物的药动学特性、效价存在差异,剂量也与不良反应风险相关[31];各研究采用药物品种、给药剂量、疗程不一,影响结果的精确性。(2)部分结局指标纳入的研究较少,无法进行敏感性分析,可能存在发表偏倚。(3)对他汀类药物多种潜在药物相互作用的研究不充分,临床上联合用药可能会增加他汀类药物不良反应发生风险。(4)肝纤维化分期与NAFLD患者长期总体死亡率、肝移植和肝脏相关事件独立相关,肝活检可以对NAFLD纤维化进行分级和分期[32]。但他汀类药物对NAFLD肝脏组织学影响的研究甚少且存在争议,纳入研究多为影像学检查数据,缺乏肝活检标本的组织学分析。
事实上,接受他汀类药物发生氨基转移酶升高的患者约为1%,但通常没有症状,具有临床意义的病例极其罕见[33]。美国FDA取消了对长期服用他汀类药物患者定期评估肝功能的建议,并表示严重的他汀类药物所致肝损伤在个别患者中是罕见和不可预测的[34]。Björnsson等[35]从瑞典不良反应咨询委员会收集了1988—2010年由他汀类药物引起的不良反应报告,其中仅1例服用他汀类药物的患者需要进行肝移植,2例患者死于药物性肝损伤(DILI)。他汀类药物诱导的DILI大多数是特异质效应结果,且由于大多数他汀类药物经肝药酶CYP代谢,潜在的药物相互作用可能会升高他汀类药物的血药浓度,建议在启动他汀类药物治疗前检测肝酶基线水平,结合患者血脂指标、肾功能、联合用药等选择他汀类药物品种,个体化调整剂量。基于本研究的情况,他汀类药物用于NAFLD患者的治疗是有益的且安全性较好,但受纳入研究样本量不足及证据质量限制,未来仍需大规模、高质量研究进一步验证。

