益生菌辅助沙库巴曲缬沙坦+胺碘酮对心房颤动射频消融术后患者近远期疗效的研究Δ
张明婷,毛建云,席建芬,韩文杰,李卓琪,赵东坡
(1.张家口市第一医院心内科,河北 张家口 075000; 2.张家口市第一医院健康管理科,河北 张家口 075000)
心房颤动是临床常见的心律失常,世界范围内发病率约0.5%,其发病机制较为复杂,既往临床通过遗传学、分子生物学等技术深入研究心房结构重构、心肌袖等方面取得了很大进展,但具体发病机制尚未明确[1-2]。近年来,利用代谢组学、宏基因组学等方法分析发现,心房颤动患者的肠道菌群结构存在明显改变,肠道菌群结构可能是治疗及预防心房颤动的切入点[3]。现阶段,射频消融术(RFCA)是治疗心房颤动的首选方法,但术后约54.6%的患者会复发;故术后多给予胺碘酮等复律药物,但胺碘酮长期使用存在较大不良反应,难以达到预期效果[4]。沙库巴曲缬沙坦为高血压、心力衰竭的常用治疗药物,有助于改善心功能、维持窦性心律,且不良反应较小[5]。有研究发现,肠道菌群及代谢产物可促进肠道神经生成,且能使心脏自主神经活性增强,与心房颤动的发生相关[6]。本研究尝试采用改善益生菌辅助沙库巴曲缬沙坦+胺碘酮治疗行RFCA术的心房颤动患者,以期为临床改善患者近远期心血管不良事件、复发率提供参考,现报告如下。
1 资料与方法
1.1 资料来源
本研究符合《赫尔辛基宣言》要求,征得我院伦理委员会和患者家属签字同意(伦理批准号为2021049)。选取2021年6月至2022年6月我院收治的行RFCA术的心房颤动患者90例。纳入标准:符合《2016年欧洲心脏病学会心房颤动管理指南》[7]中相关诊断标准;发病时伴呼吸困难、头晕等症状;经超声心动图、心电图等检查确诊;美国纽约心脏病学会(NYHA)心功能为Ⅱ—Ⅳ级;行RFCA术;3个月内无其他心血管手术史。排除标准:昏迷、休克者;存在重要脏器病变者;既往有心脏或胸部手术史者;伴有凝血障碍者;存在病态窦房结综合征者;伴急慢性传染性疾病者;过敏性体质者;存在急性脑出血者;蒙特利尔认知评估异常,无法正常沟通者;伴有恶性肿瘤者。根据治疗的方案不同将患者分为对照组、观察组和益生菌组,各30例。三组患者基线资料均衡可比,见表1。

表1 三组患者一般资料比较
1.2 方法
三组患者均接受RFCA治疗。(1)对照组患者术后口服盐酸胺碘酮片(规格:0.2 g),术后第1周1次0.2 g,1日3次;术后第2周1次0.2 g,1日2次;术后第3周开始1次0.2 g, 1日1次。(2)观察组患者给予沙库巴曲缬沙坦钠片[规格:以沙库巴曲缬沙坦计100 mg(沙库巴曲49 mg/缬沙坦51 mg)]+盐酸胺碘酮片,盐酸胺碘酮片用法与用量同对照组。沙库巴曲缬沙坦钠片的初始服用剂量为1次50 mg,1日2次,然后每1~2周视患者情况增加50 mg,最高剂量为1次200 mg,1日2次。(3)益生菌组患者在观察组的基础上加用双歧杆菌乳杆菌三联活菌片(规格:0.5 g),口服,1次1.5 g,1日3次。三组患者均连续用药12个月。
1.3 观察指标
(1)心房结构指标:治疗前,治疗3、6和12个月后,检测三组患者的左心房内径(LAD)、左心房容积(LAV)、二尖瓣返流面积(MRA)、左心室射血分数(LVEF)、左心室舒张末期容积指数(LVEDVI)和左心室收缩末期容积指数(LVESVI)。(2)治疗前,治疗3、6和12个月后,采集三组患者外周肘静脉血4 mL,离心后分离血清,采用酶联免疫吸附试验测定心肌纤维化指标[可溶性生长刺激表达基因2蛋白(sST2)、半乳凝素-3(Gal-3)]水平,采用放射免疫法检测神经内分泌激素[血管紧张素Ⅱ(AngⅡ)、去甲肾上腺素(NE)]水平。(3)肠道菌群代谢产物:治疗前,治疗3、6和12个月后,采用化学比色法测定三组患者的总胆汁酸、氧化三甲胺(TMAO)水平。(4)比较三组患者药品不良反应发生情况。(5)比较三组患者近远期心血管不良事件发生率、复发率。术后3个月内为近期,术后3个月以后为远期。心血管不良事件包括血栓栓塞、恶性心律失常和充血性心力衰竭。复发:经12导联心电图或24 h动态心电图明确为心房颤动、心房扑动或房性心动过速持续时间>30 s。
1.4 统计学方法
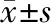
2 结果
2.1 三组患者不同时间心房结构指标比较
治疗前,三组患者的LAD、LAVI、MRA、LVEF、LVEDVI和LVESVI水平比较,差异均无统计学意义(P>0.05)。治疗3、6和12个月后,三组患者的LAD、LAVI、MRA、LVEDVI和LVESVI水平均较治疗前降低,LVEF水平较治疗前升高,差异均有统计学意义(P<0.05);且益生菌组患者上述指标与观察组、对照组比较,差异均有统计学意义(P<0.05),见表2。
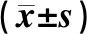
表2 三组患者不同时间心房结构指标比较
2.2 三组患者不同时间心肌纤维化指标及神经内分泌激素比较
治疗前,三组患者血清sST2、Gal-3、AngⅡ和NE水平比较,差异均无统计学意义(P>0.05)。治疗3、6和12个月后,三组患者血清sST2、Gal-3、AngⅡ和NE水平均较治疗前降低,差异均有统计学意义(P<0.05);且益生菌组患者上述指标与观察组、对照组比较,差异均有统计学意义(P<0.05),见表3。

表3 三组患者不同时间心肌纤维化指标及神经内分泌激素比较
2.3 三组患者不同时间肠道菌群代谢产物比较
治疗前,三组患者血清总胆汁酸、TMAO水平比较,差异均无统计学意义(P>0.05)。治疗3、6和12个月后,益生菌组患者血清总胆汁酸、TMAO水平较治疗前降低,且低于观察组、对照组,差异均有统计学意义(P<0.05);观察组、对照组患者治疗3个月后血清总胆汁酸、TMAO水平与治疗前比较,差异均无统计学意义(P>0.05),见表4。

表4 三组患者不同时间肠道菌群代谢产物比较
2.4 三组患者药品不良反应发生情况比较
三组患者头晕恶心、低血压、咳嗽、肝功能异常及总不良反应的发生率比较,差异均无统计学意义(P>0.05),见表5。

表5 三组患者药品不良反应发生情况比较[例(%)]
2.5 三组患者近远期心血管不良事件发生率、复发率比较
三组患者近远期心血管不良事件发生率比较,差异均无统计学意义(P>0.05);三组患者近期复发率比较,差异无统计学意义(P>0.05);益生菌组患者远期复发率低于观察组、对照组,差异有统计学意义(P<0.05),见表6。

表6 三组近远期心血管不良事件发生率、复发率比较[例(%)]
3 讨论
目前,心房颤动的治疗以复律、控制心率及预防复发为主,RFCA术是复律常用有效手段,但其对窦性心律的维持效果有待提高,因此,探究RFCA术后维持窦性心律的有效药物方案十分重要。胺碘酮可降低窦房结频率,使房室传导时间、心室肌动作电位时间延长,减慢房室结传导,改善心肌缺血;同时能阻断起搏所致心房重构,促进心房颤动转复[8-9]。但胺碘酮对窦性心律的1年维持率仅50%~70%,远期疗效欠佳,且长期使用有较明显不良反应[10]。沙库巴曲缬沙坦为双效血管紧张素受体-脑啡肽酶抑制剂,有双靶点抑制效果,可增强水钠吸收,通过干扰AngⅡ降低醛固酮释放,抑制AngⅡ介导的交感神经兴奋、心肌纤维化,还可作用于心肌钙通道的心房肌细胞膜,减少心肌纤维化,停止心房阻滞引起的不规则折返,扭转心脏重构,进而抑制心房颤动复发[11-13]。
心房颤动患者肾素-血管紧张素-醛固酮系统被激活,交感神经兴奋、AngⅡ和NE分泌增加,激活氧化应激介质,导致心房结构重构,并引起心肌纤维化、心房复极不均,导致心房颤动发生[14]。张婉馨等[15]研究证实,胺碘酮与沙库巴曲缬沙坦联合治疗可确切改善老年心力衰竭伴心房颤动患者的心功能,有利于调节神经内分泌激素。AngⅡ、NE可反映神经内分泌系统活性,二者持续升高可导致水钠潴留、血流障碍,增加血管压力、能量消耗,加重心脏负荷,促使疾病进展。本研究结果显示,治疗3、6和12个月后,益生菌组患者心房结构各项指标明显改善,血清sST2、Gal-3、AngⅡ和NE水平低于观察组、对照组,表明益生菌辅助沙库巴曲缬沙坦+胺碘酮有助于调节神经内分泌激素,改善心肌纤维化、心房重构。结合临床研究分析,肠道微生物群落结构改变影响宿主代谢,参与多种代谢、心血管疾病的发展,能增加冠心病、心力衰竭等心房颤动相关危险因素的发生风险[16-17]。同时,胆汁酸代谢异常可引发心肌细胞凋亡、脂代谢紊乱和心肌纤维化,增加心房颤动复发风险。有文献报道,心房颤动患者肠道菌群中三甲胺合成相关酶释放显著增多,而释放这些酶的大肠埃希菌、梭状芽孢杆菌和真细菌等在患者肠道中的水平呈升高趋势[18]。本研究中,益生菌组患者治疗3、6和12个月后血清总胆汁酸、TMAO水平较治疗前降低,且低于观察组、对照组,而观察组、对照组患者治疗3个月后肠道菌群代谢产物无明显改变,提示益生菌可改善心房颤动RFCA术后患者肠道菌群失衡,主要通过口服有益菌群改善肠道屏障功能,生成抗菌因子、抑制致病菌,减少促心房颤动危险因素的发生,降低心房颤动的发生风险。肠道微生物失调可导致TMAO的积累,有害微生物代谢产物转移到循环系统中可影响自主神经功能,直接或间接诱导机体免疫机制和炎症反应,促进心房颤动发生[19-20]。
RFCA术后近期复发与手术所致的心律失常效应有关,RFCA术急性热损伤所致炎症反应、射频能量所致心房电活动改变、RFCA术对心房自主神经功能的影响均可能引起心房颤动复发。RFCA术后远期复发则可能与肺静脉内异常电活动、靶肺静脉的电传导恢复有关[21-22]。本研究中,益生菌组患者远期复发率低于观察组、对照组,提示益生菌辅助沙库巴曲缬沙坦+胺碘酮更利于改善远期机体异常电活动。心肌纤维化是心房颤动的病理基础,本研究中益生菌辅助沙库巴曲缬沙坦+胺碘酮从复律、改善心脏重构、心肌纤维化和肠道菌群代谢产物等方面共同作用于RFCA术后窦性心律的维持,参与调节电重构、结构重构过程中的炎症反应、氧化应激等多种信号通路,抑制心房基质纤维化,提高窦性心律维持率,进而减少心房颤动复发。
综上所述,益生菌辅助沙库巴曲缬沙坦+胺碘酮可有效调节心房颤动RFCA术后患者的神经内分泌激素、肠道菌群代谢产物,改善心房结构与心肌纤维化,降低RFCA术后远期复发率,且具有一定的安全性。

