SLIT治疗BA的效果及对IL-17、IL-27水平和Th17/Treg平衡的影响
赵明明, 杭燕萍, 杨良凤, 葛林阳, 郑海霞, 陈文静
南京市高淳人民医院呼吸与危重症医学科,江苏南京211300
支气管哮喘(bronchial asthma,BA)是一种具有家族聚集倾向的气道慢性炎症性疾病,以喘息、气促、咳嗽为主要症状。据调查,全球约有3亿人口患有BA,发病率为1%~18%,且呈持续上升趋势。其病程长、易反复,对患者的身心健康造成严重危害[1-2]。BA发病机制复杂,临床研究发现辅助性T细胞17(T helper cell 17,Th17)/调节性T细胞(regulatory T cell,Treg)失衡及相关细胞因子白细胞介素-17(interleukin,IL)-17、IL-27与BA的发生存在一定的相关性,Th17/Treg平衡作用日益受到人们重视[3]。Th17细胞是T细胞的特殊谱系,该细胞在变应性疾病中的含量较多。Treg细胞可控制机体的免疫反应性,诱导免疫耐受。IL-17由Th17细胞特异性分泌,在固有免疫反应、病原体的防御等方面起到了不可忽视的作用。IL-27主要由树突状细胞分泌,其作为多功能的免疫细胞因子,在免疫性疾病中至关重要[4]。目前,采取科学的手段对BA患者进行治疗已成为临床研究的热点。舌下脱敏治疗(sublingual immunotherapy,SLIT)是针对免疫系统进行变应原脱敏,具有便于使用、无痛安全等优点[5-6]。然而,BA患者在进行SLIT治疗前后血清中IL-17、IL-27水平的变化以及是否可对Th17/Treg免疫平衡起到调控作用的研究较少。为了提高BA的诊疗水平,本文旨在分析SLIT治疗BA的疗效,及其对IL-17、IL-27水平和Th17/Treg平衡的影响。
1 资料和方法
1.1 临床资料
收集2016年1月—2017年8月于本院诊治的124名BA患者的临床资料。纳入标准:①符合BA诊断标准[7],均为非急性发作期的中重度BA患者;②对尘螨过敏,皮肤点刺试验结果显示螨变应原阳性。排除标准:①伴其他呼吸疾病;②合并免疫功能疾病;③近1个月内服用全身糖皮质激素或抗生素;④妊娠或哺乳期妇女。将患者随机分为观察组(n=62)和对照组(n=62)。治疗后通过电话对两组进行随访,对照组退出者4例,观察组退出者6例。两组的性别、年龄、体质指数、病程、病情程度、肺功能等临床资料均衡可比(P>0.05;表1)。本研究已通过本医院伦理委员会的审核。SLIT的适用人群:①常规抗过敏药治疗无效或造成无法耐受的不良反应;②不接受皮下免疫治疗;③无法坚持长期药物治疗。

表1 两组临床资料比较
1.2 治疗方法
两组入院后均接受补液、吸氧、纠正酸碱失衡、祛痰止咳等常规治疗。对照组接受布地奈德福莫特罗粉吸入剂(瑞典AstraZeneca AB公司,160 μg/4.5 μg/吸),1吸/次,2次/天。观察组在对照组基础上接受粉尘螨滴剂1~4号(浙江我武生物科技股份有限公司),舌下含服,1次/天。于1~3周使用1~3号滴剂(质量浓度分别为1、10、100 mg/L),1~7天分别为1、2、3、4、6、8、10滴,舌下含服2 min后口服。第4周至结束使用4号滴剂(质量浓度为333 mg/L),3滴/天。两组均连续治疗2年。
1.3 哮喘控制情况的评估
治疗结束后,采用哮喘控制问卷[8]判断两组过去4周内哮喘控制情况,共5个问题,每个问题5分,总分25分,25分为完全控制,20~24分为良好控制,<20分为未控制。总控制率=完全控制率+良好控制率。
1.4 日间、夜间的临床症状评分
日间症状评分标准[9]:无症状为0分;轻微症状,持续时间短暂为1分;≥2次的轻微症状,持续时间短暂为2分;较多次的轻微症状,对日常生活影响较小为3分;较多次的严重症状,对日常生活产生影响为4分;症状严重,无法正常生活为5分。夜间症状评分标准[9]:无症状为0分;1次醒来为1分;≥2次醒来为2分;多次醒来为3分;夜间无法入睡为4分。
1.5 IL-17、IL-27、Th17和Treg的检测
治疗前后抽取两组空腹静脉血5 mL,离心,分离血清,-80 ℃保存。保留2 mL于4 ℃保存。使用酶联免疫吸附法检测IL-17和IL-27,IL-17、IL-27试剂盒分别由上海谱振生物科技有限公司和上海沪震实业有限公司提供,操作均遵循说明书。使用流式细胞仪检测Th17和Treg细胞,无菌环境下向测样管中加入Th17细胞(CD4+IL-17+)和Treg细胞(CD4+CD25+Foxp3+)的特异性标记抗体孵育,计算外周血Th17/CD4+及Treg/CD4+比例,操作均遵循说明书。
1.6 统计学方法
应用SPSS 22.0软件处理,计量资料比较采用t检验,计数资料比较采用χ2检验,采用Pearson相关性分析外周血IL-27、IL-27与Th17和Treg细胞比例的相关性。P<0.05表示差异有统计学意义。
2 结 果
2.1 两组疾病控制情况比较
观察组完全控制率和总控制率高于对照组,差异具有显著性(P<0.05;表2)。
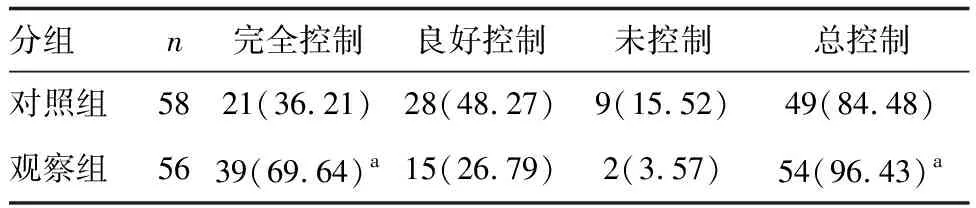
表2 两组疾病控制情况比较 例(%)
2.2 两组临床症状评分比较
治疗后,两组临床症状评分均低于治疗前,且观察组均低于对照组(P<0.05;表3)。
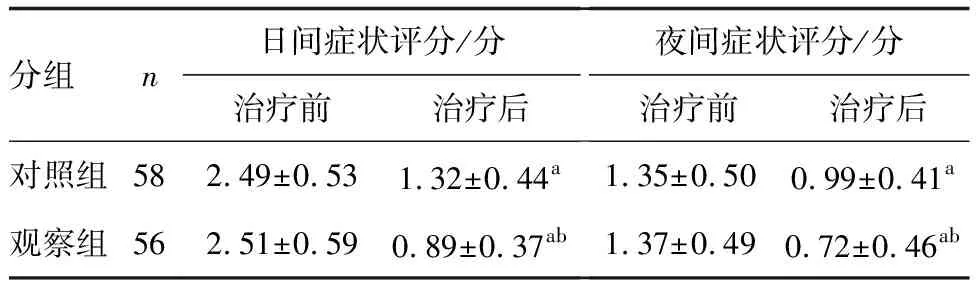
表3 两组临床症状评分比较
2.3 两组外周血IL-17、IL-27水平比较
治疗后,观察组IL-17水平低于治疗前,两组IL-27水平均高于治疗前,且观察组IL-17水平低于对照组,IL-27水平高于对照组(P<0.05;表4)。

表4 两组外周血IL-17、IL-27水平比较 ng/L
2.4 两组外周血Th17和Treg细胞比例比较
治疗后,两组Th17/CD4+、Th17/Treg均低于治疗前,Treg/CD4+均高于治疗前(P<0.05),且观察组Th17/CD4+、Th17/Treg均低于对照组,Treg/CD4+高于对照组(P<0.05;表5)。
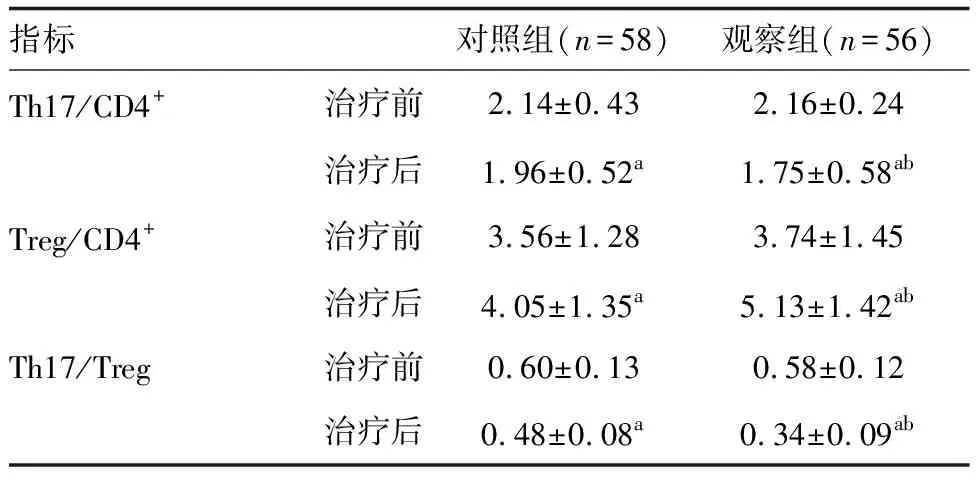
表5 两组外周血Th17和Treg细胞比例比较 %
2.5 外周血IL-17、IL-27与Th17和Treg细胞比例的相关性
IL-17与Th17/CD4+呈正相关(r=0.623,P<0.001),与Treg/CD4+呈负相关(r=-0.664,P<0.001);IL-27与Th17/CD4+呈负相关(r=-0.742,P<0.001),与Treg/CD4+呈正相关(r=0.666,P<0.001;图1)。

图1 外周血IL-17、IL-27与Th17和Treg细胞比例的相关性
3 讨 论
近年来,中国BA发病人数日益增多,BA具有顽固性、易复发性,严重影响患者的身心健康。当前,临床上BA的主要治疗手段为抗炎、解痉等,具有一定的临床效果,但其无法彻底根治,仍未取得理想作用[10]。因此,临床上有必要寻找有效的方法对BA患者进行治疗,以改善患者生活质量。
SLIT是一种新型给药方式,能快速改善BA症状,在治疗期间及停止治疗后的多年内仍可维持症状稳定,具有给药方便、患者接受度高等特点。目前SLIT已被纳入哮喘治疗方案中,在过敏性哮喘、变应性鼻炎等疾病治疗中发挥着关键作用[11]。本研究发现,BA患者应用SLIT后,患者的总控制率较高,临床症状评分较低。结果表明,SLIT治疗BA具有良好的效果,可控制哮喘情况,缓解哮喘症状。BA患者的血清、鼻腔和支气管分泌物中通常有大量的嗜酸性粒细胞,其活化后能释放白三烯类物质,导致气道黏膜水肿,从而发生一系列病理生理反应[12]。SLIT可减少白三烯类物质的产生,抑制免疫球蛋白E介导的超敏反应及肥大细胞脱颗粒,降低支气管平滑肌对组胺的反应性,减少炎症因子的释放,缓解气道炎症反应,进而获得良好的治疗效果[13]。SLIT不仅能拮抗Th17细胞增殖,还能上调Treg相关细胞因子的表达,进而调节Th17/Treg平衡,这对抑制呼吸道炎症反应、舒张气道平滑肌具有有利作用[14-15]。
Th17与Treg细胞两者相互拮抗保持免疫系统正常运转,临床普遍认为BA的发生与Th17/Treg细胞失衡存在相关性[16]。Th17细胞以分泌IL-17为主要特征,对炎症反应和免疫反应有着关键影响。Treg细胞具有免疫调节功能,可诱导免疫耐受。IL-27不仅能促进免疫,还能抑制免疫,其参与T细胞活化状况的调节,影响自身免疫性疾病的发生发展。IL-27可抑制Th17细胞的分化,减少IL-17的分泌,并能上调Foxp3的转录及表达,增强Treg细胞的免疫抑制功能。SLIT可增加IL-27含量,且其水平与抑制Th17反应息息有关[17]。本研究结果提示:SLIT可纠正BA所致的Th17/Treg免疫失衡,并且IL-17和IL-27可能参与Th17/Treg免疫调节,在BA的发生机制中具有重要作用。
SLIT治疗BA具有良好的效果,可降低外周血IL-17水平,增加外周血IL-27水平,且纠正Th17/Treg免疫失衡。本研究的纳入病例数较少,今后仍需进一步扩大样本量予以证实。

