Chi-CpG NP的制备及其对rNMB0315蛋白的免疫效果
王雁, 李振宇
1.南华大学衡阳医学院附属第二医院手术室,湖南衡阳421001;2.衡南县人民医院,湖南衡阳421199
B群脑膜炎奈瑟菌(Neisseria meningitidis serogroup B,MenB)可穿过鼻黏膜屏障,在血液中大量繁殖,引起流行性脑脊髓膜炎(流脑)。研究指出,针对呼吸道传染性疾病,黏膜免疫为更有效的免疫方式,因此研发安全高效黏膜疫苗对流脑的预防具有重要意义[1-3]。
CpG的寡脱氧核糖核苷酸(CpG-oligodeoxynucleotides,CpG-ODN)作为黏膜免疫佐剂可上调共刺激分子表达,诱发机体的系统免疫和黏膜免疫,但生物稳定性不佳、易被核酸酶降解,需有效的载体来提高其稳定性和有效性[4-5]。壳聚糖纳米颗粒(chitosan nanoparticles,Chi NP)为黏膜疫苗载体,可促进抗原吸收并提呈给抗原提呈细胞,引起黏膜免疫反应[6]。研究证实,B群脑膜炎奈瑟菌0315(Neisseria meningitides serogroup B 0315,NMB0315)为MenB疫苗的候选抗原[7]。本研究制备黏膜免疫佐剂Chi-CpG NP,检测其对重组NMB0315(recombinant NMB0315,rNMB0315)蛋白的免疫效果。
1 材料和方法
1.1 材料
MenB标准株(MC58)来源于美国ATCC公司;E.coli BL21重组表达菌(pET-30a/NMB0315)由本实验室保存;140只3~4周龄雌性BALB/c小鼠[体质量(16±2.1)g]来源于湖南斯莱克景达实验动物有限公司。佐剂Chi NP溶液由广汉恒宇新材料有限公司惠赠;CpG-ODN 1826(TCCATGACGTTCCTGACGTT)由上海生工合成;辣根过氧化物标记山羊抗小鼠抗体购自美国Proteintech公司,细胞因子白细胞介素(interleukin,IL)-4、γ干扰素(interferon-γ,IFN-γ)及IL-17A试剂盒购自美国eBioscience公司。
1.2 蛋白疫苗的制备
将保存的pET-30a/NMB0315扩增培养,1.0 mmol/L IPTG,30 ℃,摇床,180 r/min,诱导表达6 h,NMB0315蛋白采用Ni-NTA亲和层析法进行纯化,BCA法定量,SDS-PAGE分析纯度。
1.3 Chi-CpG NP悬液的制备和安全性分析
将1 500 μg CpG-ODN溶于0.01 mol/L硫酸钠溶液配制成1 500 mg/L溶液;取等量Chi NP溶液和CpG-ODN溶液于55 ℃水浴30 min;随后将Chi NP加入到CpG-ODN溶液中,涡流震荡30 s,室温静置30 min,制备Chi-CpG NP悬液。聚合物分散指数(polydispersity index,PDI)及Zeta电位由Zetasizer电位仪测定。透射电子显微镜下观察Chi-CpG NP形态,测定上清中游离的蛋白含量评价其吸附蛋白的能力。
将40只雌性BALB/c小鼠于SPF环境中适应性饲养7天,随机分为PBS组、CpG组、Chi NP组、Chi-CpG NP组,每组10只。PBS组采用20 μL PBS,CpG组采用15 μg CpG,Chi NP组采用20 μL Chi NP,Chi-CpG NP组采用15 μg Chi-CpG NP,各组均每天滴鼻1次,连续7天,各组小鼠滴鼻免疫液体的终体积为20 μL。每天称量各组小鼠体质量,第8天取各组小鼠肺组织HE染色,观察炎症反应的程度评价佐剂对免疫小鼠肺组织的影响。
1.4 动物免疫和标本收集
将100只BALB/c小鼠随机分为PBS组、rNMB0315组、rNMB0315+CpG组、rNMB0315+Chi NP组、rNMB0315+Chi-CpG NP组,每组20只。PBS组采用20 μL PBS,rNMB0315组采用30 μg rNMB0315,rNMB0315+CpG组采用30 μg rNMB0315+15 μg CpG,rNMB0315+Chi NP组采用30 μg rNMB0315+20 μL Chi NP,rNMB0315+Chi-CpG NP组采用30 μg rNMB0315+含15 μg Chi-CpG NP处理小鼠,各组小鼠滴鼻免疫液体的终体积为20 μL。各组小鼠经乙醚麻醉后分别在第0、7、14、21天经鼻腔免疫。收集第0、7、14、21、42天小鼠血液;收集第42天小鼠阴道灌洗液及鼻腔灌洗液;第42天无菌获取脾脏,于超净工作台中制成单个细胞悬液。
1.5 Chi-CpG NP辅佐的rNMB0315疫苗免疫活性检测
1.5.1 体液免疫检测 rNMB0315蛋白包被ELISA板,取第42天小鼠阴道灌洗液、鼻腔灌洗液或取第0、7、14、21、42天血清作为一抗,间接ELISA法检测小鼠sIgA水平、总IgG及亚类,酶标仪读取450 nm处光密度(optical density,OD)值。
1.5.2 细胞免疫检测 将上述收集的淋巴细胞悬液计数并将细胞调整至6.0×106个/mL,1 mL/孔加至细胞培养板中,rNMB0315蛋白刺激,于5%CO2、37 ℃培养48 h,吸出上清,ELISA检测IL-4、IFN-γ、IL-17A水平。
1.5.3 疫苗的免疫保护效果观察和免疫血清体外杀菌活性实验 免疫42天后,各组小鼠腹腔注射致死剂量MC58[7]后,并观察小鼠14天内存活情况。刮取MC58菌苔配制成4×103个/mL菌液。再将菌液与补体等体积混匀。待测血清56 ℃ 40 min灭活,用无菌PBS按1∶2、1∶4、1∶8、1∶16、1∶32倍比稀释。将12.5 μL菌液与12.5 μL补体(人血清)混合再与25 μL稀释的待检血清混合,37 ℃温育1 h。将混合物均匀涂布于巧克力琼脂培养平板,37 ℃ 5%CO2过夜培养。设置阳性对照组(诊断血清)、阴性对照(包括灭活补体+菌液、血清+灭活补体+菌液、补体+菌液)。血清体外杀菌活性用于评估脑膜炎球菌疫苗的保护效力。分别以阴性对照和阳性对照为标准判定结果,抑制50%脑膜炎奈瑟菌菌量生长的血清最大稀释度的倒数为小鼠血清杀菌抗体滴度。
1.6 统计学处理
采用Graphpad Prism8软件分析。组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 蛋白的鉴定
纯化分析结果显示,得到与rNMB0315相对分子质量46 kDa相符的目的条带(图1)。
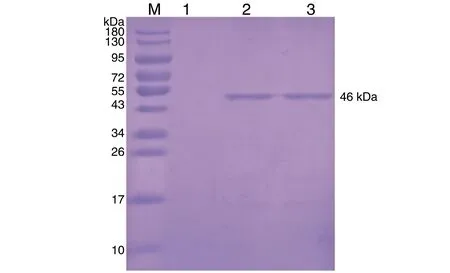
图1 rNMB0315蛋白鉴定结果M为Marker;1为E.coli BL21;2、3为纯化的rNMB0315。
2.2 Chi-CpG NP特性检测
2.2.1 Chi-CpG NP形态及吸附能力 成功制备Chi-CpG NP。Chi-CpG NP形态与Chi NP相似,类似球形,大小均一,分散均匀,未出现明显的聚集。Chi-NP、Chi-CpG NP纳米颗粒均具有较好的蛋白吸附特性,吸附率分别为(91.5±8.5)%、(85.5±8.2)%,但差异无显著性(P>0.05;图2)。

图2 Chi-CpG NP形态及吸附能力A为Chi NP和Chi-CpG NP外形(透射电子显微镜);B为Chi NP和Chi-CpG NP对rNMB0315的吸附率。
2.2.2 Chi-CpG NP的理化性质 Chi NP、Chi-CpG NP纳米颗粒粒径120~150 nm、表面电位10~15 mV、PDI均小于0.5,结果证明CpG-ODN装载到Chi NP对其理化性质影响较小。
2.2.3 Chi-CpG NP免疫安全性评估 各组小鼠连续7天体质量稳步增长,且增长曲线近似,但组内及组间差异均无显著性(P>0.05);HE结果显示,4组小鼠肺组织可见完整的肺泡,仅有轻微的白细胞浸润(图3)。

图3 Chi-CpG NP安全性评估A为各组小鼠肺组织HE染色结果(200×);B为各组小鼠体质量变化。
2.3 Chi-CpG NP辅佐的rNMB0315疫苗的免疫活性
2.3.1 体液免疫应答 从第7天开始,各免疫组IgG、IgG1、IgG2a随着时间递增而升高,并且在第42天达峰值(P<0.05)。在第21、42天时,IgG、IgG1、IgG2a rNMB0315+CpG组、rNMB0315+Chi-NP组、rNMB0315+Chi-CpG NP组高于rNMB0315组(P<0.05);rNMB0315+Chi-CpG NP组高于rNMB0315+CpG组和rNMB0315+Chi-NP组(P<0.05;图4)。
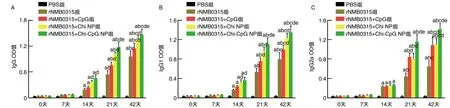
图4 不同时间免疫后特异性体液免疫应答a为P<0.05,与同组7天比较;b为P<0.05,与同组14天比较;c为P<0.05,与同组21天比较;d为P<0.05,与rNMB0315组同时间比较;e为P<0.05,与rNMB0315+CpG组和rNMB0315+Chi NP组同时间比较。
2.3.2 黏膜免疫应答 第42天时,小鼠鼻腔灌洗和阴道灌洗液中特异性sIgA水平rNMB0315+Chi-CpG NP组、rNMB0315+Chi-NP组明显高于rNMB0315组(P<0.05),rNMB0315+Chi-CpG NP组高于rNMB0315+CpG组和rNMB0315+Chi NP组(P<0.05;图5)。

图5 免疫42天后特异性黏膜免疫应答a为P<0.05,与rNMB0315组比较;b为P<0.05,与rNMB0315+CpG组和rNMB0315+Chi NP组比较。
2.3.3 各组小鼠细胞免疫水平比较 免疫后42天,rNMB0315+CpG组IFN-γ水平高于rNMB0315组(P<0.05);IL-4、IFN-γ、IL-17A水平rNMB0315+Chi-NP组、rNMB0315+Chi-CpG NP组高于rNMB0315组(P<0.05);rNMB0315+Chi-CpG NP组高于rNMB0315+CpG组和rNMB0315+Chi NP组(P<0.05;图6)。
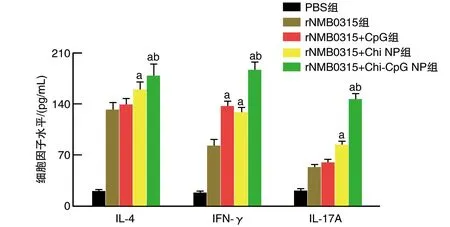
图6 各组小鼠细胞免疫水平比较a为P<0.05,与rNMB0315组比较;b为P<0.05,与rNMB0315+CpG组和rNMB0315+Chi NP组比较。
2.4 Chi-CpG NP辅佐的rNMB0315疫苗免疫保护效果
3天内rNMB0315+Chi-CpG NP组、rNMB0315+Chi-NP组、rNMB0315+CpG组、rNMB0315组小鼠存活率分别为80%、70%、50%、40%(图7)。免疫第42天,rNMB0315+Chi-CpG NP组小鼠免疫血清杀菌抗体滴度为1∶4,其他免疫组为1∶2。

图7 各组疫苗免疫小鼠MC58攻击后的存活率
3 讨 论
脑膜炎球菌主要通过呼吸道感染,诱导呼吸道黏膜免疫可有效抵御脑膜炎球菌侵袭[1,8]。高效的黏膜免疫能提高抗原的免疫原性,刺激机体产生高效的免疫应答[9]。研究表明,纳米颗粒诱导机休产生黏膜和系统免疫应答[10-11]。Sadati等[12]发现,Chi-CpG能显著增强小鼠的体液免疫和细胞免疫从而降低小鼠死亡率。本研究结果显示,Chi-CpG NP辅佐rNMB0315滴鼻免疫小鼠,可使小鼠机体免疫效果增强,小鼠的存活率提高。
研究证实,粒径在100~500 nm的纳米颗粒可有效穿过黏膜屏障,使抗原有效地被抗原提呈细胞摄取[13]。本研究所合成的Chi-CpG NP粒径120~150 nm,可递送抗原至免疫细胞,改善抗原稳定性并加强其免疫原性;安全性评估实验证实未导致小鼠肺部发生炎症改变,安全性良好。评估脑膜炎球菌疫苗有效性的重要指标是血清学保护效力[14-15]。本研究检测结果显示,Chi-CpG NP辅佐rNMB0315诱导产生的特异性抗体水平显著提升,其原因是CpG-ODN不稳定容易被核酸酶降解,而Chi NP能使CpG-ODN有效递送,并被抗原提呈细胞有效识别,从而激发免疫应答[16]。
脑膜炎球菌感染机体首先在鼻黏膜黏附定植[17],而sIgA是黏膜抗感染免疫应答中的主要保护因子,具有抗病原菌定植的作用,能中和病原体的毒力分子[18]。本研究结果显示,Chi-CpG NP辅佐的rNMB0315疫苗可有效诱导局部和远端黏膜免疫应答。黏膜表面丰富的Th17细胞刺激辅助性T细胞产生sIgA;Th17细胞分泌IL-17A可有效抵御经黏膜系统入侵的微生物[19]。Li等[20]证实,IL-17A在抵御呼吸道病原体鹦鹉热衣原体感染中发挥着重要作用。本研究结果显示,Chi-CpG NP辅佐的rNMB0315疫苗能诱导小鼠产生高水平的IL-17A。
综上,本研究成功制备了Chi-CpG NP。Chi-CpG NP能增强rNMB0315蛋白的免疫效果,提高小鼠的存活率。

