光活化消毒技术治疗牙髓-牙周综合征疗效及对患者龈沟液炎症因子水平的影响
任 建,贾丽颖,刘 莹,张 军,赵 沙,李 涛
(河北医科大学口腔医院,河北 石家庄 050011)
牙髓-牙周综合征在临床较为常见,其病理变化同时涉及牙髓与牙周组织。由于牙齿根管与牙周组织在解剖结构上联系密切,存在大量侧支根管、副根管、牙本质小管、穿通纤维等,如果牙髓或牙周发生感染,细菌、炎症介质、内毒素等可通过上述结构互相渗透、影响,对牙周形成双重损害,持续进展可造成牙齿缺失[1-2]。该病通常需要同时实施根管治疗与牙周治疗,但隐藏于根管或牙周组织中的细菌、毒素等可能成为导致治疗失败的主因[3]。因此,寻求一种高效灭菌、消毒的新技术具有重要临床意义。光活化消毒技术(Photoactivated disinfection technology,PAD)是一种新近应用于临床的抗微生物技术,其特点是作用菌谱广,灭菌效果高、可有效杀灭根管和牙周的细菌,且安全性良好、不良反应小,操作简便[4-5]。牙髓-牙周综合征的发病可能与牙菌斑、免疫异常、糖尿病等多种因素有关,是导致牙齿疼痛、缺失的主因[6]。本研究观察了我院2022年6月至2023年6月期间56例应用PAD辅助治疗的牙髓-牙周综合征患者的临床治疗情况,现报告如下。
1 资料与方法
1.1 一般资料 选取2022年6月至2023年6月收治的牙髓-牙周综合征患者56例为研究对象,病例纳入标准:符合牙髓-牙周综合征诊断标准[7];年龄≥18岁;均为单颗患牙;口内余留牙数≥18 个;依从性良好,定时复诊、配合随访者。排除标准:近3个月内接受过抗生素治疗;近6个月内接受过牙周系统治疗;合并心脑血管病、血液系统疾病、严重肝肾功能不全、凝血功能异常等;合并口腔黏膜疾病或肿瘤者;过敏体质者;妊娠、哺乳期女性。上述患者随机分为两组各28例,对照组男15例,女13例,年龄37~61岁,平均(47.93±7.03)岁;前磨牙11 例,上磨牙9例,下磨牙8例。观察组男17例,女11例,年龄39~59岁,平均(48.48±7.94)岁;前磨牙10例,上磨牙11例,下磨牙7例。两组患者一般资料比较差异无统计学意义(均P>0.05),具有可比性。
1.2 治疗方法
1.2.1 对照组接受常规一次性根管治疗术与牙周基础治疗:①根管治疗:牙冠表面常规消毒、开髓,彻底清理坏死牙髓组织,对根管进行全面探查,避免遗漏根管,准确确定工作长度。EDTA润滑根管,常规进行根管预备,交替使用3%双氧水、1%次氯酸钠溶液冲洗根管,然后实施根管充填,材料为AHplus根管充填糊剂(国械注进20153171462)。②牙周基础治疗:超声洁治配合龈上手动洁治器去除龈上牙石及菌斑,高度抛光后,实施龈下刮治与根面平整术(SRP)。
1.2.2 观察组在对照组基础上,同时应用PAD辅助治疗:光敏剂为0.01%亚甲基蓝(CAS编号7220-79-3)。①PAD 根管治疗:常规进行根管预备并交替使用3%双氧水、1%次氯酸钠溶液冲洗根后,在根管中注入PAD Plus溶液,等待大约1 min,期间使用根管锉搅动,使溶液浸润至整个根管;使用适用根管的工作尖照射2 min,功率为750 mW。②PAD牙周治疗:实施SRP后,将PAD Plus溶液注入牙周袋,等待大约1 min,期间搅拌溶液,使其充分接触牙周袋各个部位,使用适用于牙周的工作尖照射1 min,功率参数同PAD根管治疗。
1.3 观察项目及疗效评价标准
1.3.1 牙周相关指标:分别于治疗前、治疗后12周评估牙龈指数(GI);根据Florida牙周检测系统,采用专用探针检测牙周袋探诊深度(PD)、附着丧失水平(AL)、探诊出血(BOP)指标。
1.3.2 龈下细菌相对丰度:于治疗前、治疗后12周采集龈下菌斑样本,提取样本基因组DNA,通过Illumina Miseq平台实施基因测序,采用贝叶斯算法进行分类分析,绘制物种累积曲线,获取龈下细菌相对丰度。
1.3.3 龈沟液炎症因子水平:于治疗前、治疗12周将滤纸签插入牙周袋或龈沟内30 s,然后取出置于EP管中低温保存。检测前将滤纸条解冻,加入1 ml磷酸盐缓冲液,震荡30 min后离心取上清液,采用酶联免疫吸附法检测肿瘤坏死因子-α(TNF-α)、白细胞介素-18(IL-18)、IL-6、IL-1β水平。试剂盒均购自赛默飞世尔科技公司。
1.3.4 临床疗效:治疗后12周,参照《口腔科学》疗效标准进行评估。显效:症状完全消失,GI比治疗前降低>50%,PD比治疗前降低>2 mm;有效:症状明显改善,30%
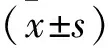
2 结 果
2.1 两组牙周相关指标比较 两组治疗前各项牙周相关指标比较差异无统计学意义(均P>0.05),治疗后观察组GI、PD、AL、BOP均低于对照组(均P<0.05),见表1。
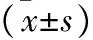
表1 两组牙周相关指标比较
2.2 两组龈下细菌相对丰度比较 观察组治疗后龈下细菌相对丰度均低于对照组(均P<0.05),见表2。
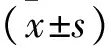
表2 两组龈下细菌相对丰度比较
2.3 两组龈沟液炎症因子水平比较 治疗后观察组各项炎症指标均低于对照组(均P<0.05),见表3。
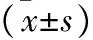
表3 两组龈沟液炎症因子水平比较
2.4 两组临床疗效比较 观察组总有效率高于对照组(P<0.05),见表4。

表4 两组临床疗效比较[例(%)]
3 讨 论
牙髓-牙周综合征病情复杂,患牙同时存在牙髓、牙周病变,且相互连通,导致治疗较为棘手。常规根管治疗可有效改善牙髓炎、根尖周炎等,但治疗过程中消毒不彻底,遗留在根管中的细菌或牙周组织的菌斑生物膜,可导致牙髓腔再次感染[8-9]。SRP可破坏菌斑生物膜结构,改善牙周组织病变,但对于根分叉区、牙周袋深部等结构,器械难以到达,操作较为困难,SRP术中常规的牙周消毒仍难以解决细菌消毒不彻底的问题[10]。PAD是近年开发并应用于临床的一种高效灭菌治疗手段。已有研究报道,PAD技术具有多种优点[11-12]:①PAD治疗操作简单,对机体的创伤极小;②PAD治疗的作用菌谱广,能有效杀灭大部分口腔致病菌;③能够充分作用于病变组织,到达器械难以到达的部位;④灭菌效果良好,可避免全身使用抗生素可能出现的耐药菌问题;⑤安全性高,无毒副作用,可重复应用。
细菌感染是牙髓-牙周综合征重要的致病因素,已有研究证实,其相关致病菌多达30余种,常见的特殊致病菌有11 种,其中牙龈卟啉单胞菌、中间普雷沃菌均是公认的牙周炎致病菌,是大部分牙周病变部位及龈下菌斑的优势菌[13]。福赛坦纳菌是口腔常见菌群之一,常存在于重度牙周炎患牙附着丧失部位,其感染定植是加重牙槽骨吸收、牙周袋深度增大的重要原因[14]。齿垢密螺旋体属于革兰阴性厌氧菌,存在口腔中,与牙龈红肿、出血等牙周病变的发病密切相关[15]。本研究中两组患者均检出上述菌群,且治疗后观察组上述菌群相对丰度显著低于对照组,表明PAD辅助治疗具有良好的抑制致病菌群的效果。PAD 的基本治疗要素包括光敏剂、组织氧浓度以及适度光源,由不同波长的光波驱动,通过生物组织中激发态光敏物质的退激而起到破坏细菌细胞壁,发挥抵抗致病微生物的作用[16]。已有研究证实,PAD可杀灭传统根管疗法后依然存留的细菌,对于耐药菌株也具有一定杀灭作用[17]。
在牙髓-牙周综合征治疗中,龈沟液炎症介质水平可反映患者的病情进展情况[18-19]。龈沟液中TNF-α水平升高,可影响牙周膜纤维细胞碱性磷酸酶的生理作用,进一步加重牙周损伤[20]。IL-6 的表达增加,可加重炎性反应,促进牙体骨质牙槽骨成分破坏,刺激牙龈细胞凋亡,造成牙龈萎缩[21]。IL-18主要由活化的单核细胞分泌,参与促进炎症细胞的吞噬,以及诱导牙周炎症急性期蛋白合成,促进细胞增殖和分化[22]。IL-18水平升高与牙周炎患者各项临床症状密切有关[23]。IL-1β具有促进趋化性细胞因子作用,其水平升高可引起单核细胞和T淋巴细胞的聚集与浸润,从而导致龈沟液等局部炎症介质水平升高[24]。IL-1β的血清水平能够刺激牙周炎相关基因的表达,并刺激环氧化酶2、磷脂酶A2、NO合酶、干扰素γ以及黏附蛋白等效应蛋白的表达,在炎症反应中起着重要作用[25]。本研究结果显示,治疗后观察组上述炎症因子水平比对照组明显降低,提示应用PAD辅助治疗对炎症的控制效果较佳,能够有效改善牙周炎症,其原因是PAD治疗具有更佳的灭菌效果,可有效杀灭残余细菌。当牙髓与牙周组织中细菌量减少时,细菌毒素的刺激作用减弱,牙周组织分泌的炎症介质因子也随之减少,因此PAD辅助治疗可起到有效控制感染、抑制炎症的作用。
本研究中,治疗后观察组各项牙周临床指标、治疗有效率均优于对照组。这与以往研究关于应用PAD可有效提高牙周、牙髓病变治愈率的结论具有一致性。牙髓-牙周综合征的感染物可存在于根管内、根尖周组织、牙周组织等多个病变部位。本研究中所有患者均先接受一次性根管治疗术,经过完善的根管治疗与PAD治疗,能够彻底杀灭存在于根管中的细菌,清除根管内部感染病灶源,避免根管内致病细菌感染患牙牙周组织;然后再实施PAD牙周治疗,杀灭深根分叉部位、牙周袋内残留细菌,防止牙周源性细菌感染髓腔,这就有效阻断了牙髓、牙周间的相互不良影响,从而提高治疗效果。
综上,牙髓-牙周综合征患者在常规治疗基础上实施PAD辅助治疗,可有效改善牙周状况,抑制口腔细菌,改善炎症,提高疗效。PAD 治疗操作简单,不会明显延长治疗时间或给患者增加不适,具有较高的临床应用价值。本研究随访时间较短,关于PAD治疗的长期效应,还有待以后进一步研究探讨。

