黄芩苷调节JAK2/STAT3信号通路对口腔鳞癌细胞增殖、凋亡和侵袭的影响
戴 琦,崔 宁,刘文卓
(济南市中西医结合医院,山东 济南271100)
口腔癌在全球恶性肿瘤中排名靠前,属于较常见的头颈部癌症,其中超过90%起源于鳞状组织,是口腔癌中最常见的,所以又被称为口腔鳞癌(Oral squamous cell carcinoma,OSCC)。OSCC的预后较差,病死率也较高,而且其分子发病机制也很复杂[1-2]。虽然手术、化疗、放疗已经在OSCC中得到了应用,但是患者的生存率并未明显提高,治疗效果不理想[3]。因此需要开发新的治疗OSCC的方法。黄芩苷是从黄芩中提取的中药单体,对多种肿瘤都具有抗肿瘤作用。黄芩苷又是一种黄酮苷,广泛作用于癌症的发生和发展阶段,调节不同信号通路,单独或联合用药可以抑制细胞增殖,减缓癌症进展[4-5]。例如有报道显示黄芩苷可以通过miRNA表达,调节肺癌的发展,从而发挥抗肿瘤活性[6]。相关研究称信号转导和转录激活子3(Signal transducer and activator of transcription 3,STAT3)是一种在不同的恶性肿瘤发生和发展过程中的重要蛋白。而Janus激酶2(Janus kinase 2,JAK2)磷酸化后则可以激活STAT3发挥作用[7-8]。JAK2/STAT3通路调控细胞增殖和凋亡,激活JAK2/STAT3通路可以诱导OSCC、非小细胞肺癌的进展;还对具有放射抗性的结直肠癌发挥作用,改善结直肠癌患者的预后[9-11]。综合上述报道,本文选取黄芩苷对JAK2/STAT3信号通路在OSCC细胞增殖、凋亡和侵袭中的作用进行探讨。
1 材料与方法
1.1 实验细胞 人OSCC细胞CAL27来自上海博尔森生物科技有限公司。
1.2 主要试剂 DMEM细胞培养液购自厦门慧嘉生物科技有限公司;胎牛血清购自成都点纯科技有限公司;黄芩苷(批号572667)来自上海麦克林生化科技股份有限公司;JAK2/STAT3通路激动剂Broussonin E 来自云南西力生物技术股份有限公司;膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)、碘化丙啶(PI)凋亡试剂盒、兔源一抗JAK2、磷酸化JAK2(p-JAK2)、STAT3、磷酸化STAT3(p-STAT3)、增殖细胞核抗原(PCNA)、β-actin购自爱必信(上海)生物科技有限公司;Transwell小室来自上海惠研生物科技有限公司;白细胞介素(IL)-18、IL-1β酶联免疫吸附(ELISA)试剂盒购自上海远慕生物科技有限公司;兔源一抗基质金属蛋白酶-9(MMP-9)、Bcl-2相关X蛋白(BAX)购自北京中杉金桥生物技术有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自北京泰泽嘉业科技发展有限公司。
1.3 细胞培养 人OSCC细胞系CAL27在DMEM完全培养基中培养,并补充有10%胎牛血清和1%青霉素/链霉素,在37 ℃湿润的含5% CO2的培养箱中培养。
1.4 细胞分组并用集落形成测定各组细胞增殖能力 对于集落形成测定,将细胞以1×103个细胞接种在6孔板中,分别用100、150、200 mg/L的黄芩苷处理细胞并分为低浓度黄芩苷组、中浓度黄芩苷组、高浓度黄芩苷组[12],另外再用200 mg/L的黄芩苷+20 μmol/L JAK2/STAT3激活剂Broussonin E[13]进行处理作为高浓度黄芩苷+Broussonin E组,对照组不做其他特殊处理。孵育1周后,吸去培养基,将各组细胞在乙醇中固定10 min,然后用0.5%的结晶紫进行30 min细胞染色,然后使用显微镜进行检测分析。
1.5 流式细胞术分析各组细胞凋亡 将各组细胞培养24 h后,用PBS洗涤,重悬并以1×105/ml的浓度,将各组细胞与Annexin V-FITC和PI在室温下避光孵育15 min,使用流式细胞仪进行流式细胞术分析细胞凋亡率。
1.6 各组细胞侵袭测定 各组CAL27细胞以1×106每孔的数量加入涂有基质胶的24孔Transwell小室的上室中,与不含FBS的DMEM共同培养;在Transwell小室的下室中添加含FBS的DMEM培养液,在培养箱中共同孵育。固定各组侵袭的CAL27细胞,用细胞染色液染色并在光学显微镜下拍照、计数。
1.7 ELISA法检测细胞中IL-18、IL-1β表达水平 将各组细胞消化、裂解离心,收集上清液备用。根据说明,使用IL-18 ELISA试剂盒和IL-1β ELISA试剂盒检测IL-18、IL-1β的表达水平。
1.8 Western blot检测p-JAK2/JAK2、p-STAT3/STAT3、PCNA、BAX、MMP-9蛋白表达水平 通过RIPA缓冲液从各组CAL27细胞中提取总蛋白,并通过BCA蛋白检测试剂盒测定浓度,将蛋白质用10%的SDS-PAGE凝胶电泳分离,然后转移到PVDF膜上,在TBS缓冲液中用1% BSA脱封闭膜,并在4 ℃下与一抗孵育,JAK2(1∶1000)、p-JAK2(1∶1000)、p-STAT3(1∶1000)、STAT3(1∶1000)、PCNA(1∶1000)、BAX(1∶1000)、MMP-9(1∶1000)、β-actin(1∶1000)。洗膜然后在室温下与HRP标记的二抗孵育1 h,用ECL检测试剂处理,使用Image Lab软件定量每种蛋白质的相对水平。
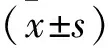
2 结 果
2.1 各组CAL27细胞增殖能力比较 与对照组相比,低浓度黄芩苷组、中浓度黄芩苷组、高浓度黄芩苷组的细胞集落形成率下降(均P<0.05);中浓度黄芩苷组、高浓度黄芩苷组与低浓度黄芩苷比较,细胞集落形成率也下降(均P<0.05);高浓度黄芩苷组与低浓度黄芩苷比较,细胞集落形成率降低(P<0.05),高浓度黄芩苷+Broussonin E 组与高浓度黄芩苷组比较,细胞集落形成率上升(均P<0.05)。见表1。
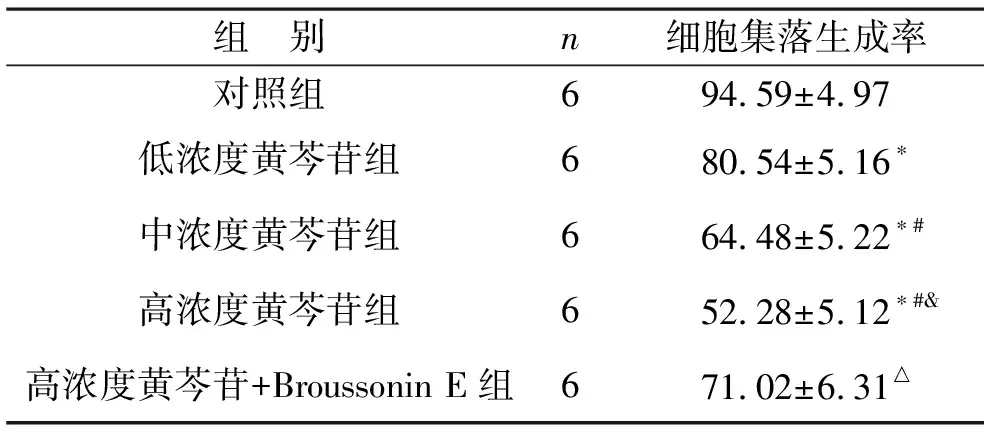
表1 各组CAL27细胞集落生成率比较(%)
2.2 各组CAL27细胞凋亡率比较 低浓度黄芩苷组、中浓度黄芩苷组、高浓度黄芩苷组与对照组比较,CAL27细胞凋亡率升高(均P<0.05);中浓度黄芩苷组、高浓度黄芩苷组与低浓度黄芩苷相比,细胞凋亡率同样增加(均P<0.05);高浓度黄芩苷组与低浓度黄芩苷相比,细胞凋亡率增加(P<0.05);而高浓度黄芩苷+Broussonin E 组与高浓度黄芩苷组比较,细胞凋亡率降低(P<0.05)。见表2。
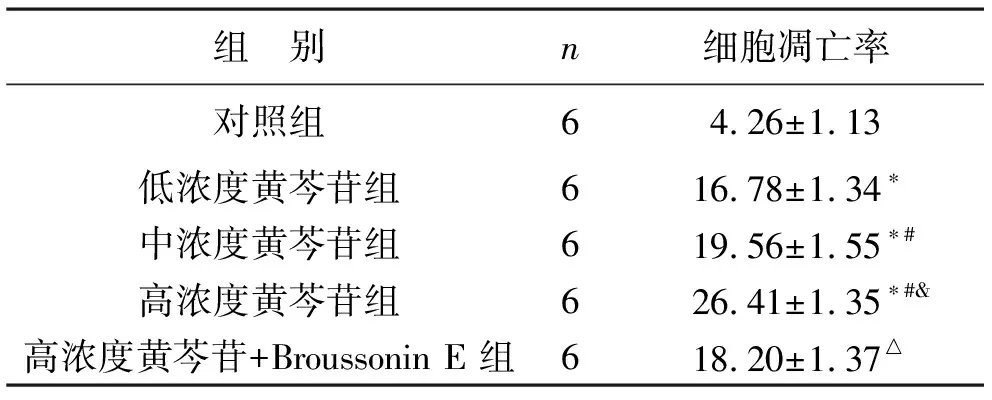
表2 各组CAL27细胞凋亡率比较(%)
2.3 各组CAL27细胞侵袭能力比较 与对照组比较,低浓度黄芩苷组、中浓度黄芩苷组、高浓度黄芩苷组CAL27细胞侵袭数减少(均P<0.05);中浓度黄芩苷组、高浓度黄芩苷组与低浓度黄芩苷相比,细胞侵袭数再次减少(均P<0.05);高浓度黄芩苷组与中浓度黄芩苷组比较,细胞侵袭数目也减少(P<0.05);与高浓度黄芩苷组比较,高浓度黄芩苷+Broussonin E组CAL27细胞侵袭数增加(P<0.05)。见表3。

表3 各组CAL27细胞侵袭数目比较(个)
2.4 各组CAL27细胞中IL-18、IL-1β表达水平比较 与对照组相比,低浓度黄芩苷组、中浓度黄芩苷组、高浓度黄芩苷组的IL-18、IL-1β表达水平降低(均P<0.05);中浓度黄芩苷组、高浓度黄芩苷组与低浓度黄芩苷相比,细胞IL-18、IL-1β表达水平降低(均P<0.05);高浓度黄芩苷组与低浓度黄芩苷相比,细胞中IL-18、IL-1β水平降低(均P<0.05);与高浓度黄芩苷组比较,高浓度黄芩苷+SC79组CAL27细胞中IL-18、IL-1β水平增加(均P<0.05)。见表4。
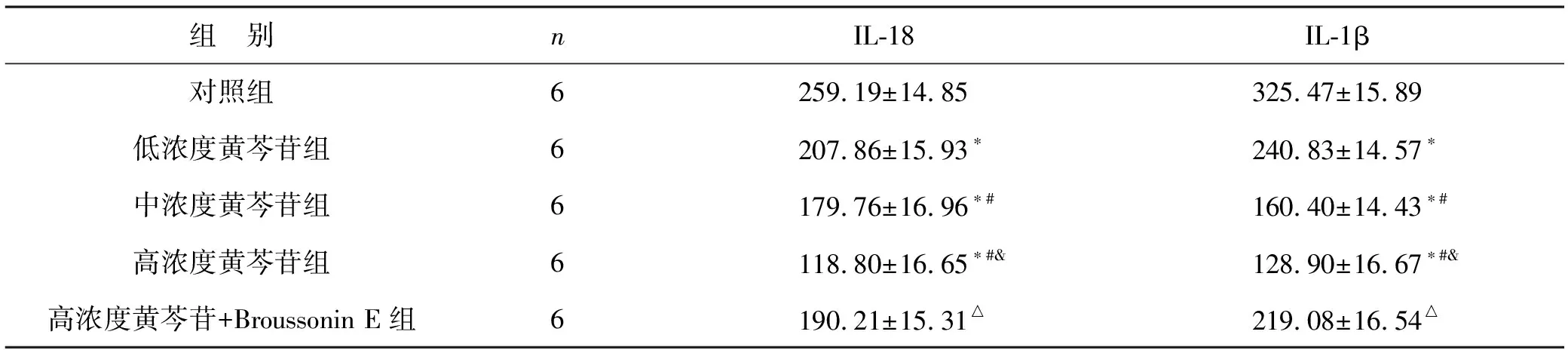
表4 各组CAL27细胞中IL-18、IL-1β表达水平比较(pg/ml)
2.5 各组CAL27细胞中p-JAK2/JAK2、p-STAT3/STAT3、PCNA、BAX、MMP-9蛋白表达比较 与对照组比较,低浓度黄芩苷组、高浓度黄芩苷组的p-JAK2/JAK2、p-STAT3/STAT3、PCNA、MMP-9蛋白表达降低,BAX蛋白表达增加(均P<0.05);中浓度黄芩苷组、高浓度黄芩苷组与低浓度黄芩苷组相比,p-JAK2/JAK2、p-STAT3/STAT3、PCNA、MMP-9蛋白表达降低,BAX蛋白表达增加(均P<0.05);高浓度黄芩苷组与低浓度黄芩苷组相比,蛋白表达趋势同前组一致(均P<0.05);与高浓度黄芩苷组比较,高浓度黄芩苷+Broussonin E 组p-JAK2/JAK2、p-STAT3/STAT3、PCNA、MMP-9蛋白表达升高,BAX蛋白表达降低(均P<0.05)。见表5。
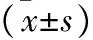
表5 各组CAL27细胞中p-JAK2/JAK2、p-STAT3/STAT3、PCNA、BAX、MMP-9蛋白表达比较
3 讨 论
OSCC是口腔内最常见的癌症之一,由于口腔组织在环境、遗传等因素的影响下,其复发率、转移率和致死率都很高,并且预后也较差[14-15]。目前常采用化疗以及放疗的方法进行治疗,但是生存率较低[16-17]。OSCC的转移性使其病死率大大增加,肿瘤细胞转移到身体的其他部位,形成新的肿瘤,使OSCC的治疗难度增大,患者生存率降低[18]。所以探索OSCC的发生发展机制,开发新的治疗策略就显得尤为重要。因此本文选取人OSCC细胞CAL27,对其增殖、凋亡和侵袭,以及药物作用影响进行研究。
黄芩苷具有抗炎、抗氧化、抗病毒、抗肿瘤等多种生物活性,对于炎症、氧化应激、癌细胞转移都有一定的治疗作用[19]。近年来人们开始探索其在抗肿瘤中的作用,研究显示其主要阻断细胞周期、抑制细胞凋亡,并且对细胞转移也有抑制作用[20]。比如有报道称黄芩苷可以通过AMPK信号通路抑制而使胆管癌细胞凋亡,为胆管癌治疗提供新方法[21]。但黄芩苷对于OSCC的研究还较少,故本文对黄芩苷在OSCC中的作用进行探究。结果显示,低、中、高浓度的黄芩苷处理会使CAL27细胞的集落形成率降低,抑制细胞的增殖,促进细胞凋亡,而且细胞侵袭数目也明显减少。此外炎症因子水平降低、增殖相关蛋白PCNA、促凋亡蛋白BAX、侵袭相关蛋白MMP-9表达也发生变化。且随着黄芩苷浓度的变化,相关实验指标变化程度也不同,都证明黄芩苷可以抑制OSCC细胞的增殖和侵袭,促进OSCC细胞凋亡,具有治疗OSCC的潜力。
众多研究显示JAK2/STAT3信号通路在很多癌症中都发挥作用。其在肝细胞癌中被活化后会促进肿瘤转移[22];JAK2/STAT3信号通路在胃癌中通过炎症因子异常激活后,会增加p-JAK2、p-STAT3的表达,促进肿瘤发展[23];趋化因子激活JAK2/STAT3通路使OSCC的上皮间质转化受到影响,采用JAK2/STAT3通路抑制剂可以抑制OSCC细胞的干性;其次在肺癌中JAK2/STAT3通路抑制后,可以降低癌细胞的增殖、迁移和侵袭能力[24-25]。本文继续研究JAK2/STAT3信号通路在OSCC中作用以及黄芩苷对JAK2/STAT3信号通路的影响。结果显示,OSCC CAL27细胞中p-JAK2/JAK2、p-STAT3/STAT3表达升高,低、中、高浓度黄芩苷处理后细胞中p-JAK2/JAK2、p-STAT3/STAT3蛋白表达降低。随着黄芩苷浓度升高,p-JAK2/JAK2、p-STAT3/STAT3蛋白表达越少。本研究推测黄芩苷可能抑制JAK2/STAT3信号通路对CAL27细胞的增殖、凋亡和侵袭产生影响。为了验证此猜测,使用JAK2/STAT3信号通路激活剂Broussonin E干预高浓度黄芩苷处理的CAL27细胞,结果显示Broussonin E的加入明显地减弱了高浓度黄芩苷对CAL27细胞的增殖和侵袭的抑制,并减少了细胞凋亡。表明黄芩苷可能通过抑制JAK2/STAT3通路影响OSCC细胞的增殖、凋亡和侵袭,对OSCC产生作用。
综上所述,黄芩苷可能通过抑制JAK2/STAT3通路进而影响OSCC细胞的增殖、凋亡和侵袭,本文为提升OSCC的治疗,降低细胞转移,提高患者生存率开拓了新的策略。而本研究尚未对其进行体内探索,有待进一步更加深入地探究。

