肠炎沙门菌疫苗株Sm24/Rif12/Ssq在蛋鸡体内的定殖规律
崔国林,闫雪敏,孟晨晨,李佳佳,赵 洋,王雪芬,薛晓阳,周守长
(1.华裕农业科技有限公司,河北邯郸 056000;2.河北工程大学生命科学与食品工程学院,河北邯郸 056038)
Sm24/Rif12/Ssq 疫 苗( 商 品 名AviPro®SalmonellaVac E)株是由肠炎沙门菌PT4 通过化学诱变方式获得的一种代谢漂移突变株[1],亦是国内外普遍使用的肠炎沙门菌弱毒活疫苗株之一[2]。相较于肠炎沙门菌野毒株,Sm24/Rif12/Ssq 疫苗株生长代次时间延长,细胞膜通透性升高,对红霉素敏感,但对利福平和链霉素耐药[1];它可在动物体内存活14~21 d,但不能在自然环境中存活[3]。Sm24/Rif12/Ssq 疫苗免疫可显著降低鸡蛋载菌量和载菌率[4],减少泄殖腔排毒率[5-6]。研究[7-8]显示,SPF 鸡感染肠炎沙门菌标准株CVCC3377 后,从感染后7 d 开始持续性排毒至21 d,并从感染后7 d开始出现可检测的平板凝集抗体和ELISA 抗体。然而,Sm24/Rif12/Ssq 疫苗株中部分基因的缺失和突变导致其毒力弱化,同时也导致疫苗株对环境的适应性发生变化[1],其在蛋鸡体内的定殖规律不同于肠炎沙门菌野毒株。因此,本研究选取0日龄、6 周龄和16 周龄蛋鸡,分别进行Sm24/Rif12/Ssq疫苗首免、二免和三免,并于免疫后不同时间点检测疫苗株核酸及抗体产生情况,以期明确疫苗株在蛋鸡体内定殖和抗体产生规律,从而为科学制定或优化免疫程序提供基础数据。
1 材料与方法
1.1 试验动物
0日龄(出雏当日,60 只)、6 周龄(40 只)和16 周龄(40 只)海兰褐蛋鸡,饲养于华裕农业科技有限公司育雏场和产蛋场。
1.2 主要试剂
链霉素、利福平,购自北京索莱宝科技有限公司;BPW 培养基和BGA 培养基,购自北京陆桥技术股份有限公司;肠炎沙门菌疫苗Sm24/Rif12/Ssq(商品名AviPro®SalmonellaVac E),购自礼蓝(上海)动物保健有限公司;AceQ qPCR Probe Master Mix,购自南京诺唯赞生物科技股份有限公司;鸡白痢、鸡伤寒多价染色平板凝集试验抗原,购自北京中海生物科技有限公司;D 群沙门菌ELISA 试剂盒,购自BioChek 公司。
1.3 试验动物免疫程序
1.3.1 首免 选择60 只0日龄海兰褐蛋鸡,对其中50 只滴口免疫1 羽份Sm24/Rif12/Ssq 疫苗(1×108CFU/只),剩余10 只滴口免疫等体积灭菌生理盐水(空白对照组)。
1.3.2 二免 选择40 只已完成Sm24/Rif12/Ssq疫苗首免的6 周龄海兰褐蛋鸡,对其中30 只滴口免疫1 羽份Sm24/Rif12/Ssq 疫苗(1×108CFU/只),剩余10 只滴口免疫等体积灭菌生理盐水(空白对照组)。
1.3.3 三免 选择40 只已完成Sm24/Rif12/Ssq疫苗二免的16 周龄海兰褐蛋鸡,对其中30 只滴口免疫1 羽份Sm24/Rif12/Ssq 疫苗(1×108CFU/只),剩余10 只滴口免疫等体积灭菌生理盐水(空白对照组)。
1.4 首免后检测
分别于Sm24/Rif12/Ssq 疫苗首免后1、3、5 和7 d,随机采集10 只试验组和2 只空白对照组雏鸡的咽拭子、泄殖腔拭子和单根盲肠样品,并置于含200 μg/mL 链霉素和100 μg/mL 利福平的BPW 培养液中,37 ℃静置培养16~24 h。取1 mL BPW 菌悬液,12 000 r/min 离心5 min后,以50 μL 生理盐水重悬沉淀并煮沸15 min,即为样品核酸模板。采用qPCR 检测上述样品核酸模板。 反应体系(20.0 μL)[9]:AceQ qPCR Probe Master Mix 10.0 μL,ROX 0.4 μL,invAF(5'-GCTGCTTTCTCTACTTAAC-3')0.4 μL(10 μmol/L),invAR(5'-GTAATGGAATGACGAACAT-3')0.4 μL(10 μmol/L),invAP(5'-FAM-CATCACCATTAGTACCAGAATCAGTMGB-3')0.4 μL(10 μmol/L),核酸模板2.0 μL,无菌水6.4 μL。反应程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 34 s,40 个循环。

图1 首免后Sm24/Rif12/Ssq 疫苗在蛋鸡体内载量变化情况(柱形图上标表示阳性率/%)
同时,在每个采样时间点采集上述雏鸡肝脏样品,称重后置于1 mL 含2 颗钢珠的生理盐水中,50 Hz 匀浆1 min,取100 μL 匀浆液涂布于含有200 μg/mL 链霉素和100 μg/mL 利福平的BGA 培养基,37 ℃培养16~24 h 后进行细菌计数。
于免疫后30 d,采集10 只鸡血清,利用鸡白痢、鸡伤寒多价染色平板凝集试验抗原测定平板凝集抗体;同时,利用D 群沙门菌ELISA 试剂盒测定ELISA 抗体。ELISA 试剂盒结果判定标准:S/P≥0.5,肠炎沙门菌抗体阳性;S/P<0.5,肠炎沙门菌抗体阴性。S/P= 0.5 时,抗体滴度为654.39。
1.5 二免和三免后检测
于Sm24/Rif12/Ssq 疫苗二免或三免后4 d,采集30 只试验组和10 只空白对照组鸡泄殖腔拭子置于含200 μg/mL 链霉素和100 μg/mL 利福平的BPW 培养液中,37 ℃静置培养16~24 h 后,采用1.4 方法进行qPCR 检测。
于二免后30 d,三免后30、60、100 d,分别采集30 只试验组和10 只空白对照组鸡血清,测定平板凝集抗体和ELISA 抗体。
1.6 数据分析
使用GraphPad Prism 9 软件进行图表绘制,利用IBM SPSS Statistics 25 软件进行数据统计分析。首免后脏器细菌载量采用one-way ANOVA 进行数据显著性分析,二免和三免后泄殖腔疫苗株载量采用T-test 进行数据显著性分析,P<0.05 代表差异有统计学意义。
2 结果
2.1 Sm24/Rif12/Ssq 疫苗首免后定殖检测
盲肠、肝是肠炎沙门菌在机体内的主要定殖器官[3,10],因此将二者作为本研究疫苗株定殖检测的靶位。由于样品杂菌较多,直接进行细菌计数误差过大,故采用qPCR 方法测定细菌核酸,核酸量与细菌载量呈正比。结果显示:咽拭子和盲肠样品中疫苗株细菌载量呈先上升后下降趋势,单个时间点咽拭子细菌载量变异系数为0.13~0.44,盲肠样品细菌载量变异系数为0.19~0.34,细菌阳性率呈逐步下降趋势,至免疫后7 d,细菌阳性率已降至60%~70%(图1-A);泄殖腔拭子细菌载量相对稳定,单个时间点细菌载量波动更小,变异系数为0.07~0.13,细菌阳性率均在90%以上(图1-A);肝脏样品细菌载量逐步下降至103CFU/g,细菌阳性率逐步下降至50%(图1-B)。空白对照组均无细菌检出。
2.2 Sm24/Rif12/Ssq 疫苗二免和三免后定殖检测
Sm24/Rif12/Ssq 疫苗首免后保护时间有限[5],往往需要进行加强免疫。如图2所示,二免或三免后,泄殖腔拭子阳性率为17%~20%,三免后细菌载量显著低于二免(P<0.05),且均显著低于首免后3~5 d(图1-A)。空白对照组均无细菌检出。
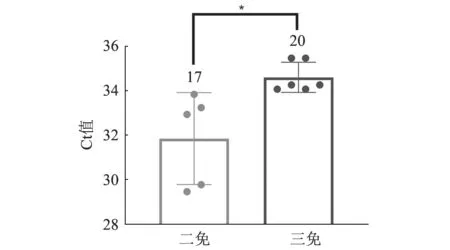
图2 Sm24/Rif12/Ssq 疫苗二免和三免后4 d泄殖腔拭子qPCR 检测结果(柱形图上标表示阳性率/%)
2.3 Sm24/Rif12/Ssq 疫苗免疫后抗体检测
对免疫后血清采用平板凝集试验初检,发现均未出现明显的凝集现象,即平板凝集抗体均为阴性。采用D 群沙门菌ELSIA 试剂盒检测血清的结果(图3)显示,平均抗体滴度随日龄上升而逐步升高,至三免后60 d 达到峰值,且同时间点平均抗体滴度超过抗体阳性阈值(图3-A),单个样品最高抗体滴度为4 562;首免后30 d 抗体阳性率为0,二免后30 d 抗体阳性率为10.7%,三免后30、60、100 d 的抗体阳性率分别为30.0%、57.0%、61.0%(图3-B)。空白对照组均无细菌抗体检出。

图3 Sm24/Rif12/Ssq 疫苗免疫后ELISA 抗体变化规律
3 讨论
研究[3]显示,Sm24/Rif12/Ssq 疫苗株可在1日龄免疫的SPF 雏鸡泄殖腔排毒12 d。与之相似,另有研究[5]显示,Sm24/Rif12/Ssq 疫苗株在1日龄免疫的罗曼褐雏鸡泄殖腔排毒10 d,在7 或16周龄免疫的鸡泄殖腔排毒5 d。但是,以上研究均基于泄殖腔拭子细菌培养方法,而沙门菌判定可能受泄殖腔杂菌干扰,且不能定量。本实验室分别采用BGA 琼脂平板培养法和qPCR 法检测免疫后8 d雏鸡泄殖腔的疫苗株载量,结果显示疫苗株阳性率分别为30%和80%(数据未发表),说明平板分离法检测污染样品的敏感性较低。因此本研究选用qPCR 方法判定非脏器样本疫苗株载量。
Sm24/Rif12/Ssq 疫苗经口免疫,途经口腔、盲肠和泄殖腔,并在其中增殖和扩散。与之对应,首免后1~7 d,咽拭子、泄殖腔拭子和盲肠样品中均有细菌检出,说明疫苗株可在口腔、泄殖腔和盲肠存活7 d 以上;在每个检测时间点,泄殖腔拭子细菌载量和稳定性均高于咽拭子和盲肠样品,细菌阳性率均在90%以上,加之泄殖腔拭子易于采集且对动物刺激较小,因此泄殖腔适于作为疫苗定殖或排毒检测的靶位。首次免疫后1 d,疫苗株即可进入雏鸡肝脏,随后疫苗株载量持续下降,检出阳性率仅为50%~90%,而肠炎沙门菌标准株在雏鸡体内载量于攻毒后5 d 达到峰值,随后下降,且检出阳性率为100%[10]。这些差异可能是Sm24/Rif12/Ssq 疫苗株有别于野毒株的重要表现:①疫苗株在雏鸡体内增殖能力有限,可快速被机体免疫系统清除,导致其在雏鸡脏器载量持续性下降;②疫苗株经口免疫,侵袭进入肝的细菌数量有限,导致部分雏鸡肝脏无可检测数量的细菌。
与首免后疫苗排毒规律不同,二免和三免后疫苗排毒量(细菌载量)和排毒率均显著低于首免。与之类似,雏鸡在0日龄首免后3 d 的疫苗排毒量和排毒率均高于7日龄首免(数据未发表),这可能与以下原因相关:①0日龄首免时,雏鸡消化道尚未形成多样性菌群结构,梭菌科或肠杆菌科细菌占主导优势[11],可能利于肠炎沙门菌疫苗株定殖和增殖,而高日龄免疫时,鸡消化道已形成多样性菌群结构,乳杆菌和肠球菌成为优势菌群,拮抗疫苗株定殖。②经过首免后,雏鸡消化道形成了针对肠炎沙门菌的黏膜免疫,可以抑制疫苗株的二免和三免后定殖。
鸡白痢平板凝集试验以全菌体作为诊断抗原,易受抗原试剂批次质量、血清质量和鸡群其他细菌感染等因素干扰,特异性和敏感性欠佳,且其结果判定主要依靠肉眼,受主观影响较大;但其成本低,适于大群普筛。ELISA 方法以纯化的蛋白作为包被抗原,依靠酶标仪判别结果,其特异性和敏感性良好,但成本较高,较适于重点样品确诊。本研究选择以上两种方法同时检测免疫后血清,发现凝集抗体均呈阴性,推测原因一方面可能由于肠炎沙门菌抗体与鸡白痢沙门菌诊断抗原并不完全配型,降低了平板凝集试验的敏感性;另一方面可能由于疫苗在体内存在时间较短,未能诱导产生高水平抗体。但是加强免疫之后,血清中可检测到低水平抗体,并随免疫次数增加而升高,说明疫苗可以诱导机体产生抗体,抗体阳性率可作为疫苗免疫效果的评判指标。

