重组木聚糖酶的高密度发酵及其定向制备低聚木糖
赵 剑, 解静聪, 姜 越, 杨 静, 徐 浩, 张 宁
(中国林业科学研究院 林产化学工业研究所;江苏省生物质能源与材料重点实验室;国家林业和草原局林产化学工程重点实验室;林木生物质低碳高效利用国家工程研究中心;江苏省林业资源高效加工利用协同创新中心,江苏 南京 210042)
半纤维素是木质纤维原料的主要化学组分之一,是由木糖为主的多种戊糖以不同类型的糖苷键聚合而成[1],其通过化学、生物等手段所制备的低聚木糖具有开发成为高附加值保健品、饲料添加剂和片剂药品辅料的潜力。低聚木糖指的是聚合度2~6的直连木寡糖,由β-1,4-木糖苷键连接,对青春双歧杆菌、植物乳杆菌等公认的肠道益生菌具有高效的选择性增殖作用[2-3]。如谢玮等[4]研究发现:仅需口服0.7 g低聚木糖2周,即可改善人体肠道菌群分布情况,双歧杆菌等益生菌的比例约可提高1倍。此外,低聚木糖还有稳定血压、降血脂和降血糖作用[5-7]。因其显著的益生元作用,选择性高效转化农林剩余物为低聚木糖也是目前研究热点。Zhang等[8]在pH值2.7和150 ℃下,利用乙酸水热预处理玉米芯30 min,制备的低聚木糖得率可达45.91%。Huang等[9]在172 ℃下,以6.5%乙酸溶液水热预处理杨木木屑27 min,低聚木糖得率可达51%。但上述研究仍有部分聚合度较高的木寡糖未降解。内切木聚糖酶可以选择性水解β-1,4-木糖苷键[10],通过木聚糖酶水解的手段可以进一步提高木质纤维乙酸水热反应产物中低聚木糖的产量[11]。目前,多种来源不同且催化特性不同的木聚糖酶基因[12-13],已在大肠杆菌、芽孢杆菌、酿酒酵母、里氏木霉和烟草为宿主的异源表达系统中成功表达。通过诱导产酶条件的优化,可有效地降低木聚糖酶使用成本,为木聚糖酶在饲料、造纸和医药等领域的广泛应用提供了基础条件。作者所属实验室在前期工作中构建了一种来源于拟杆菌的木聚糖酶基因的重组大肠杆菌,本研究优化5 L发酵罐水平下重组大肠杆菌高密度(即高菌体生物量)发酵产重组木聚糖酶的诱导条件,并以乙酸水热预处理杨木屑所得液体产物为原料,通过探讨木聚糖酶水解的影响因素,分析了木聚糖酶水解过程中木糖和低聚木糖等产物分布规律,以期为开发杨木屑水解产物定向制备高得率低聚木糖的方法提供基础数据。
1 实 验
1.1 原料、试剂和仪器
玉米芯木聚糖,半纤维素质量分数85.5%,实验室自制[14];杨木屑,江苏宿迁杨岭木材加工厂;杨木屑乙酸水解液,主要成分为木聚糖约6.45 g/L,木糖约2.08 g/L,低聚木糖(聚合度2~6)约3.24 g/L,是以杨木屑为原料,经40 g/L乙酸溶液在170 ℃ 下水热反应4 h获得。参考文献[15]配制3,5-二硝基水杨酸(DNS)溶液;胰蛋白胨及酵母提取物,美国Oxoid公司;氨苄青霉素(Amp)及异丙基-β-D-硫代半乳糖苷(IPTG),上海生工生物工程公司。木二糖、木三糖、木四糖、木五糖和木六糖、KH2PO4、K2HPO4、D-生物素、甘油、柠檬酸和柠檬酸三钠等均为市售分析纯。
重组大肠杆菌PET-PdoXyn10A-DE3由中国林业科学研究院林产化学工业研究所生物质能源研究室保存。Terrific Broth(TB)培养基:甘油 10 g/L,酵母抽提物24 g/L,胰蛋白胨12 g/L,KH2PO42.31 g/L,K2HPO416.43 g/L,D-生物素 0.4 mg/L;补料TB培养基:甘油500 g/L,酵母抽提物60 g/L,胰蛋白胨30 g/L,KH2PO42.31 g/L,K2HPO416.43 g/L,D-生物素1.2 mg/L;Luria-Bertani(LB)培养基:胰蛋白胨 10 g/L,酵母抽提物5 g/L,NaCl 10 g/L。
Bio120型7.5 L生物反应器,美国艾本德公司;HH-2数控水浴摇床,上海维诚公司;Synergy HTX全波段读板机,美国BioTek公司;Avanti JXN-30冷冻离心机,美国Beckman Coulter公司;超声波细胞破碎仪,宁波新芝公司。
1.2 高密度发酵重组木聚糖酶诱导条件的测定
将含有重组大肠杆菌PET-PdoXyn10A-DE3的300 g/L甘油冻存液(-80 ℃)取出,在100 mg/L Amp的LB平板上划线后,倒置于37 ℃恒温培养箱中培养过夜。挑取单菌落到300 mL LB液体培养基中,经37 ℃、 180 r/min摇床培养至菌体光密度(OD600)为15.0时,将其接种于装有3.5 L TB培养基的7.5 L生物反应器中,并添加补料TB培养基至总液体体积为5 L,37 ℃下培养6~8 h后,通过对诱导剂浓度、诱导OD600值、诱导温度以及诱导pH值的调节,探讨诱导条件对重组酶诱导表达的影响。在诱导后第12 h开始收集发酵液1 mL,在4 ℃ 条件下经1 000 r/min 离心5 min后去除上清液,置于100 ℃烘箱中保温至绝干,获得菌体。同时,在上述去除上清液的菌体中加入与上清液相同体积的0.05 mol/L柠檬酸-柠檬酸三钠缓冲溶液(pH值4.8)并充分重悬菌体,经超声波破碎后,4 ℃ 条件下经1 200 r/min离心20 min,即获得重组木聚糖酶粗酶液,用于测定不同诱导条件下重组木聚糖酶的酶活力。
1.3 重组木聚糖酶酶活力的测定
1.3.1标准曲线的绘制 配制10 g/L 木糖标准溶液,将其分别添加到200 μL水中至终质量浓度为0.05~1.2 g/L,分别加入300 μL DNS试剂,混匀后经沸水浴10 min,取出后立即冰浴至室温,在550 nm下读取吸光度值(A550)作为X轴,对应的木糖质量浓度(Cx)作为Y轴,绘制标准曲线:Cx=0.369 4A550-0.022,R2=0.999 7。
1.3.2酶活力的测定 参照文献[16-18]测定酶活力,具体方法为:反应体系总体积为200 μL,其中,0.5 mol/L柠檬酸-柠檬酸三钠缓冲溶液10 μL,15 g/L玉木芯木聚糖溶液170 μL,置于酶最适反应温度下孵育10 min后,向反应体系中加入稀释至适宜浓度的酶液20 μL,混匀后,孵育10 min。向离心管中加入300 μL DNS试剂终止反应,沸水浴10 min 后冰浴至室温,在550 nm下读取吸光度值。在标准曲线的线性范围内,根据吸光度值换算出重组木聚糖酶水解底物后释放的还原糖的量。
在最适酶反应条件下,每分钟释放1 μmol还原糖所需酶的量定义为1个酶活力单位。相对酶活力定义为:在同组单因素(反应温度或反应pH值)实验中测得的最高酶活力为 100%,同组单因素实验其它条件下的酶活力以百分比形式显示。
1.4 重组木聚糖酶的酶解性能
以质量浓度约为5 g/L的玉米芯木聚糖为底物,取7.756 mL杨木屑乙酸水解液置于50 mL锥形瓶中,加入0.5 mol/L柠檬酸-柠檬酸三钠缓冲溶液(pH值 5.2)0.5 mL、重组木聚糖酶及适量蒸馏水,至液体总体积为10 mL,充分混匀后以硅胶塞塞紧瓶口,置于40 ℃水浴摇床中,150 r/min振荡水解,所取样品于10 000 r/min条件下离心10 min后,取上清液进行相关组分的测定。
1.5 分析方法
木质纤维原料中半纤维素含量的测定按照 NREL标准方法进行分析;水解产物还原糖的测定采用DNS法[15];水解产物中单糖含量的测定采用HPLC法,条件为Bio-Rad Aminex HPX-87H色谱柱(300 mm×7.8 mm,45 μm),5 mmol/L硫酸为流动相,流速为0.8 mL/min,柱温为65 ℃。低聚木糖含量的测定选用(Dionex ICS-5000)高效离子色谱,CarbonPac PA200 IC色谱柱(50 mm×3 mm,5.5 μm),流动相为100 mmol/L NaOH和500 mmol/L NaAc,流速为0.3 mL/min,柱温为30 ℃, 低聚木糖得率按照下式计算:
Y=(C2+C3+C4+C5+C6)/C0×100%
式中:Y—低聚木糖得率,%;C2~6—木二糖到木六糖的质量浓度,g/L;C0—反应前木聚糖质量浓度,g/L。
2 结果与分析
2.1 诱导条件对高密度发酵制备重组木聚糖酶的影响
2.1.1诱导剂浓度的影响 重组木聚糖酶基因诱导表达是由表达载体PET-20b上T7强启动子控制,异丙基-β-D-硫代半乳糖苷(IPTG)是常用的诱导剂[19]。当发酵初始阶段菌体OD600值为35时,将培养温度调节至28 ℃后,分别加入IPTG至终浓度为0.1、 0.25、 0.5和0.75 mmol/L,将补料速度调节至36 mL/h,诱导表达12~15 h。诱导剂浓度对高密度发酵重组木聚糖酶的表达情况和菌体生物量的影响如表1所示。当IPTG浓度为0.1 mmol/L时,发酵液中重组大肠杆菌生物量最高可达24.42 g/L,单位发酵液木聚糖酶酶活力达218.11 U/mL。当IPTG浓度为0.25 mmol/L时,单位发酵液木聚糖酶酶活力达277.37 U/mL,随着IPTG浓度的继续增加,重组大肠杆菌的生物量呈下降趋势,其可能原因是IPTG具有一定毒性,特别是在高密度发酵状态下,当浓度升高后对大肠杆菌细胞的生长存在抑制作用;同时大量异源蛋白的持续转录对大肠杆菌自身也会造成较大的代谢压力。因此,当IPTG浓度继续提高至0.75 mmol/L时,菌体生物量降低至21.15 g/L,相应地单位发酵液木聚糖酶酶活力出现了一定程度的降低。由此可见,重组大肠杆菌高密度发酵产木聚糖酶的最佳诱导剂浓度为0.25 mmol/L。

表1 高密度发酵重组木聚糖酶诱导表达条件优化
2.1.2诱导OD600值的影响 由于诱导剂IPTG具有细胞毒性[20],选择适宜的菌体浓度(OD600值)有利于促进菌体生物量的积累,并可能提高单位发酵液中重组木聚糖酶的酶活力。当发酵初始阶段菌体OD600值分别达15、 35、 55和75时,将培养温度调节至28 ℃后,加入诱导剂至终浓度为0.25 mmol/L,将补料速度调节至36 mL/h,诱导表达12~15 h。诱导OD600值对高密度发酵重组木聚糖酶的表达情况和菌体生物量的影响如表1所示。当大肠杆菌菌体浓度较低时,在28 ℃下开始诱导,单位发酵液中重组木聚糖酶的酶活力显著低于其他诱导OD600值条件,可能是由于初始阶段重组大肠杆菌生长速率受到诱导剂的毒性影响,导致发酵后期菌体生物量的积累。当菌体的OD600值达到75时,重组大肠杆菌的对数生长期已结束,经过剧烈的生长代谢过程,发酵液中积累了较多的生长抑制物,可能影响重组木聚糖酶的诱导表达。当菌体光密度OD600值为55时,单位发酵液中重组木聚糖酶酶活力达到最高值317.38 U/mL。由此可见,重组大肠杆菌高密度发酵产木聚糖酶的最佳诱导OD600值为55。
2.1.3诱导温度的影响 当发酵初始菌体OD600值达到55时,将培养温度分别调节至28、 31、 34、 37 ℃,加入诱导剂至0.25 mmol/L,将补料速度调节至36 mL/h,诱导表达12~15 h。诱导温度对高密度发酵重组木聚糖酶的表达情况和菌体生物量的影响如表1所示。当诱导表达温度为37 ℃时,虽然菌体生物量高达31.53 g/L,但单位发酵液重组木聚糖酶酶活力仅为308.05 U/mL。这可能是因为重组大肠杆菌诱导表达异源蛋白时,易产生折叠错误的无活性包涵体蛋白。当诱导温度为34 ℃时,单位发酵液的重组木聚糖酶酶活力可达362.67 U/mL,高于其他诱导温度条件,重组大肠杆菌生物量为25.83 g/L。这可能是因为降低诱导表达温度可以降低目的蛋白的翻译速度,减少蛋白的折叠错误,从而提高可溶性目的蛋白的积累。当诱导温度为28 ℃时,菌体生物量仅为23.88 g/L,显著低于其他温度条件下发酵的菌体生物量。这可能是因为较低的诱导温度影响重组大肠杆菌的生长代谢速度,不利于菌体量的积累。因此,重组大肠杆菌高密度发酵产木聚糖酶的最佳诱导温度为34 ℃。
2.1.4诱导pH值的影响 当发酵初始菌体OD600值达到55时,将培养温度调节至34 ℃,将发酵液pH值分别调节至6.2、 6.6、 7.0和7.4,添加诱导剂至终浓度为0.25 mmol/L,将补料速度调节至36 mL/h,诱导表达12~15 h。诱导pH值对高密度发酵重组木聚糖酶的表达情况和菌体生物量的影响如表1所示。当诱导pH值为7.0时,单位发酵液重组木聚糖酶酶活力显著高于其他pH值条件。这可能是因为该pH值条件下对重组大肠杆菌的细胞膜通透性最为适宜,能够保证菌体在高密度发酵条件下的正常生长代谢。
综上所述,在5 L生物反应器水平下,高密度发酵产重组木聚糖酶的最优条件为诱导剂IPTG浓度为0.25 mmol/L、诱导OD600值为55、诱导温度为34 ℃、诱导pH值为7.0。此时重组大肠杆菌的菌体生物量为28.83 g/L,酶活力为362.67 U/mL。
2.2 重组木聚糖酶制备低聚木糖的工艺优化
2.2.1温度对重组木聚糖酶酶活力的影响 不同来源木聚糖酶的最适反应温度差异较大,真菌来源的木聚糖酶最适反应温度通常为45~50 ℃,而根据细菌生长环境的温度差异,细菌来源木聚糖酶的最适反应温度范围从10 ℃至100 ℃ 均有报道。因此,在酶水解反应过程中选择木聚糖酶的最适反应温度是获得高催化反应活性和酶水解效率的重要影响因素。以玉米芯木聚糖为底物,在pH值5.2、酶液添加体积20 μL、反应时间10 min条件下,考察反应温度对重组木聚糖酶酶活力的影响,结果见图1(a)。由图可知,当反应温度在20~40 ℃之间时,重组木聚糖酶的酶活力逐渐升高。当反应温度为40 ℃ 时,重组木聚糖酶表现出最高催化活性。当反应温度继续升高时,重组木聚糖酶的酶活力呈下降趋势。原因可能是木聚糖水解反应属于吸热反应,提高反应温度,可提高活化底物分子的比例,使得更多底物分子进入过渡态,从而使得酶反应速率显著提高;但过高的反应温度会严重影响酶蛋白的稳定性,破坏酶蛋白分子的二级结构,从而降低酶反应速率。

图1 温度(a)和pH值(b)对重组木聚糖酶酶活力的影响
2.2.2pH值对重组木聚糖酶酶活力的影响 不同来源木聚糖酶的最适反应pH值差异显著,真菌来源的木聚糖酶的最适反应pH值普遍呈酸性,而细菌来源的木聚糖酶最适pH值呈弱酸性、中性和弱碱性。在温度40 ℃、酶液添加体积20 μL、反应时间10 min条件下,考察pH值对重组木聚糖酶酶活力的影响,结果见图1(b)。由图可知,当反应pH值在4.0~5.2之间时,重组木聚糖酶的酶活力呈逐渐升高的趋势。当反应pH值为 5.2时,重组木聚糖酶表现出最高催化活性。当反应pH值继续升高,酶活力呈下降趋势。其原因可能是反应体系中H+浓度的变化,一方面显著改变酶催化结构域中活性中心氨基酸残基的解离状态,进而影响酶催化活性中心对过渡态底物分子的亲核作用;另一方面也影响酶分子表面的电荷分布,进而影响酶分子的溶解度和结构稳定性,pH值过高或过低都不利于维持酶分子的催化活性。结合2.2.1节,反应温度40 ℃和pH值5.2为重组木聚糖酶的最适反应条件,该条件与来源于假丁酸弧菌[21]、绳状青霉菌[22]的木聚糖酶最适合反应条件相似。
2.2.3酶添加量对重组酶水解杨木木聚糖的影响 杨木木屑乙酸水解产物中,除了木糖和低聚糖外,还有一部分聚合度较高的木寡糖。这部分长链木寡糖经木聚糖酶水解可转化为附加值更高的低聚木糖(聚合度2~6)。在重组木聚糖酶的最适反应条件(40 ℃,pH值5.2)下酶水解5 h,考察重组木聚糖酶添加量对杨木木屑乙酸水热反应液体产物酶水解过程的影响,结果见表2。由表可知,随着重组木聚糖酶添加量的提高,木糖和聚合度为2~4的低聚木糖的量均呈逐渐升高的趋势,当酶添加量为12 U/mL时,低聚木糖的量达到最高为3.20 g/L。当酶添加量提高至16 U/mL时,低聚木糖的量略有减少,而木糖的量增加至2.13 g/L。其原因可能是重组木聚糖酶底物中β-1,4-糖苷键具有广泛选择性,在水解高聚合度木寡糖(聚合度>6)的同时,也会将部分低聚木糖水解成木糖。这一情况与现有报道的来源于出芽短梗霉[23]、巴伦高兹类芽孢杆菌[24]、掌形藻类[25]和Streptomycessp.[26]的木聚糖酶具有相似的水解规律。因此,重组木聚糖酶水解乙酸水热预处理杨木木屑液体产物提高低聚木糖含量的最佳酶添加量为12 U/mL。
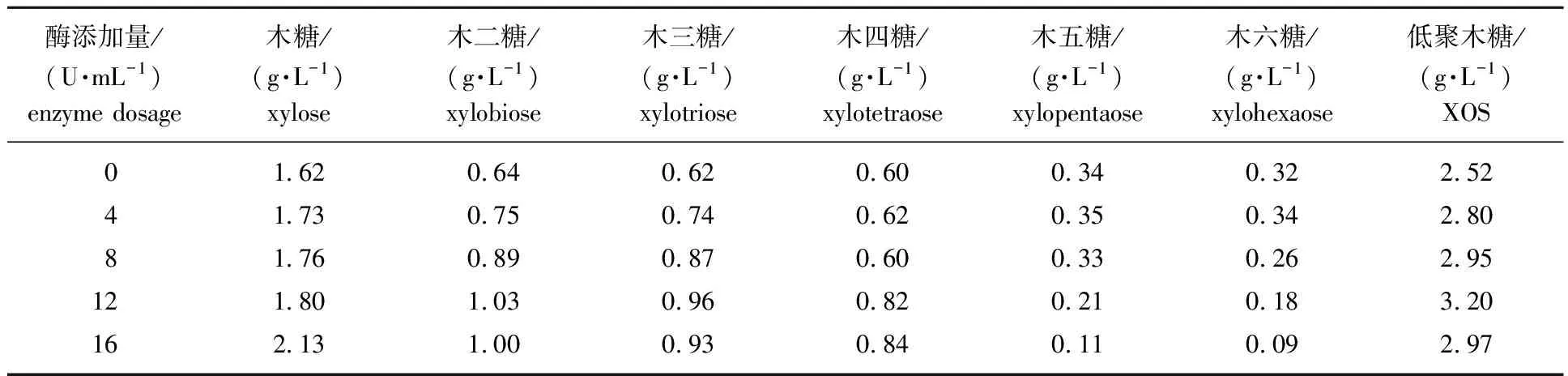
表2 酶添加量对重组木聚糖酶水解杨木木聚糖产物的影响
2.2.4酶水解反应时间对重组酶水解杨木木聚糖的影响 重组木聚糖酶属于β-1,4-内切木聚糖酶,其水解木寡糖的同时也能以低聚木糖为底物进行水解生成木糖。因此,酶反应时间对降低反应产物中非目标产物木糖的含量,提高低聚木糖的含量具有重要影响。在重组木聚糖的最适反应条件(40 ℃,pH值5.2)下,添加重组木聚糖酶至终浓度为12 U/mL,分别在水浴振荡水解4、 5、 6和7 h后进行定时取样,测定杨木屑乙酸水解液的酶水解产物中低聚糖和木糖的含量变化,结果见表3。由表可知,当酶水解反应时间为6 h时,低聚木糖的量达到最高,由初始的2.52 g/L提高至3.21 g/L,木五糖的量从0.34 g/L减至0.18 g/L,木六糖的量从0.32 g/L下降至0.13 g/L,表明重组木聚糖酶可能优先降解聚合度较高的木寡糖[26]。当反应时间延长至7 h后,低聚糖的量反而略有下降,且木糖的量提高至1.91 g/L。其原因可能是长链木寡糖含量降低后,重组木聚糖酶对低聚木糖的水解作用提高,使得非目标产物木糖的含量增加。这一现象与已有报道的来源于温泉基因组[27]、嗜气芽孢杆菌KGJ2[28]、热普通链霉菌TISTR1948[29]和枝霉菌[30]的木聚糖酶对榉木木聚糖和燕麦木聚糖水解过程具有相似的规律。

表3 酶反应时间对重组木聚糖酶水解杨木木聚糖产物的影响
综上所述,在酶水解过程的初始阶段,最佳反应条件为酶反应温度40 ℃、pH值 5.2、酶添加量12 U/mL、杨木屑乙酸水解液经酶水解反应6 h,此条件下,低聚木糖为3.21 g/L,其中木二糖、木三糖、木四糖、木五糖和木六糖的量分别为1.09、 0.97、 0.84、 0.18、 0.13 g/L,木糖的量为1.82 g/L。
3 结 论
3.1高密度发酵产重组木聚糖酶的最佳诱导表达条件为:诱导剂浓度0.25 mmol/L、诱导OD600值为55、诱导温度为34 ℃、诱导pH值为7.0,此时菌体生物量为28.83 g/L,单位发酵液重组木聚糖酶的酶活力可达362.67 U/mL。
3.2以杨木屑乙酸水解液为底物,重组木聚糖酶水解制备低聚木糖的最佳条件为:温度40 ℃、pH值5.2、酶添加量为12 U/mL、反应6 h,此条件下低聚木糖为3.21 g/L,其中木二糖、木三糖、木四糖、木五糖和木六糖的量分别为1.09、 0.97、 0.84、 0.18、 0.13 g/L,木糖为1.82 g/L。

