表面展示SARS-CoV-2 抗原蛋白乳酸乳球菌工程菌的构建
王佳莹,张祖朔,陈佰胜,王丹丹,于 飞,檀建新
(1.河北农业大学 食品科技学院,河北 保定 071000;2.河北农业大学 河北省人畜共患病原微生物分析与防空重点实验室,河北 保定 071000;3.河北农业大学 生命科学学院,河北 保定 071000)
2019 新型冠状病毒肺炎(COVID-19)是由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的呼吸道疾病[1]。自2019 年12 月以来,SARS-CoV-2在全球范围内迅速传播,并逐步发展成全球大流行疾病。迄今为止,SARS-CoV-2 的传播已经给全球人类带来了重大损失。截至2023 年,已导致全球接近7 亿的确诊病例,约690 万人死亡,而且该病毒仍在传播流行,为世界各地的医疗系统带来了沉重的负担[2]。新冠病毒主要编码4 种结构蛋白,即刺突蛋白(S)、膜蛋白(M)、包膜蛋白(E)、核衣壳蛋白(N)[3]。其中,介导病毒感染的蛋白主要是S 蛋白,与感染细胞密切相关[4]。S 蛋白由S1 和S2 两个功能亚基组成,S1 亚基由N-末端结构域(NTD)和受体结合结构域(RBD)组成,可以与宿主血管紧张素转化酶2(ACE2)受体结合[5],S2 含有完成膜融合所需的分子机器,刺突蛋白通过构象变化完成膜融合过程,进而导致严重的肺部炎症。因此,S1 亚基及其RBD 结构域在病毒与受体细胞识别和结合过程中发挥重要作用,同时也是疫苗研制的主要目标蛋白[6]。研究发现S 蛋白串联重复的RBD 二聚体,产生高水平抗体,是有效的疫苗抗原,而RBD 在病毒中以三聚体形式存在于刺突蛋白中,可能更具抗原特性[7-8]。
以乳酸菌作为抗原递送载体的策略在近些年获得了广泛的关注,乳酸菌具有免疫调节作用,可以通过与肠道上皮细胞和黏膜相互作用来影响宿主免疫系统[9-10]。因为食品级乳酸菌的安全性,经其表达的外源蛋白可以不经过纯化而与乳酸菌一同服用,当重组乳酸菌定植于消化道黏膜后,可以源源不断地为人体提供相应的抗原蛋白[11]。除此之外,乳酸菌的生长速度快、免疫原性弱、自身分泌的蛋白量很少,这使其成为表达外源蛋白的理想选择[12]。在乳酸菌表达过程中,为了更好展示目的蛋白并且避免过量的外源蛋白在菌内的积累、降解产生可能对菌体有害的物质,需要及时将外源蛋白分泌到细胞外,所以高效的表面定位系统是必不可少的,目前常用是Usp45 信号肽和3Lysm 锚定基序[13]。近年来,研究人员一直在努力开发一些高效且控制效果良好的乳酸菌表达系统,以此让乳酸菌能够表达某些特定病毒的抗原蛋白。
Lim 等[14]用运载蛋白AcmA 及信号肽Usp45融合RSV 病毒的1 个抗原表位(G 蛋白),共同呈现在L.lactis的表层。Guo 等[15]人利用4 种乳酸菌制备了可以显著降低牛奶蛋白引起的过敏反应的发酵乳饮料,这种饮料通过降低小鼠血清中总IgG、总IgG1 和总IgE 抗体水平来缓解过敏症状。孙珊等[16]人利用UreB 基因工程乳杆菌研制了1 种色香味俱佳的可以预防幽门螺旋杆菌感染的UreB 活性酸奶,表明乳酸菌是表达外源蛋白的良好载体。本研究利用食品级表达载体pNZ8149 和绿色荧光蛋白(GFP)、新冠病毒S1 蛋白上的RBD 结构域构建了3 个重组表达载体并把3 种蛋白在乳酸乳球菌上进行表面展示,将乳酸菌的生物学特征和食用安全性相结合,为将来的新冠病毒疫苗及其他病原体的疫苗研制提供依据。
1 材料与方法
1.1 材料与试剂
Lactococcus lactisNZ3900、表达载体pNZ8149购自杭州宝赛生物科技有限公司;pET28b-GFP 质粒由本实验室保存;pcDNA3.1(+)-His-SARS-CoV-2-Omicron-Spike 质粒 由河北农业大学于飞教授提供;细菌基因组DNA 提取试剂盒、质粒小提试剂盒、DNA 纯化回收试剂盒购自天根生化科技有限公司;GM17 培养基购自青岛海博生物技术有限公司;Nisin 购自上海腾准生物科技有限公司;TriQuick Reagent 总RNA 提取试剂购自北京索莱宝科技有限公司;RNA 提取液(25∶24)购自北京博奥拓达科技有限公司;DEPC 水(DNase、RNase free)购自碧云天生物技术有限公司;EasyScript® One-Step gDNA Removal and cDNA Synthesis SuperMix 试剂盒、染料法荧光定量预混试剂购自北京全式金生物技术有限公司;Anti-GFP-Tag 一抗、Anti-His-Tag 一抗、HRP-山羊抗小鼠IgG(H+L)购自北京博奥龙免疫技术有限公司;YF®488 羊抗鼠二抗购自苏州优逸兰迪生物科技有限公司。
1.2 仪器与设备
PCR 仪 德 国Biometra 公 司;RT-PCR 仪 美 国ABI 公司;Gene PuLser Xcell 电穿孔仪 美国Bio-Rad 公司;Tanon 4800 全自动化学发光图像分析系统 北京原平皓生物技术有限公司;荧光显微镜Axio-Imager-M2 卡尔蔡司管理有限公司。
1.3 引物设计
用于基因扩增的引物(表1)由北京擎科生物科技股份有限公司合成。
1.4 L.lactis 表达载体的构建
根 据GenBank 中Usp45 信 号 肽( 登 录 号:M60178.1) 序列,设计Usp45 基因片段扩增引物(Primer1、3);按参考文献[17]设计3LysM(C 端肽聚糖锚定结构域) 扩增引物(Primer2、4),以L.lactisNZ3900 基因组为模板通过融合PCR(引物1 ~4)扩增获得Usp45-3LysM融合基因片段。以表1 中的Primer1、5、6 为引物,以Usp45-3LysM融合基因片段、pET28b-GFP 质粒为模板,通过融合PCR 以及酶切连接的方式构建pNZ8149-GFP 载体;分别以Primer1、7 ~11;Primer1、9 ~13 为引物。以Usp45-3LysM融合基因片段、pcDNA3.1(+)-His-SARS-CoV-2-Omicron-Spike 质粒为模板,通过融合PCR 及酶切连接的方式构建pNZ8149-2RBD 和pNZ8149-3RBD 载体。载体构建流程如图1 所示,反应程序参考文献[18]。
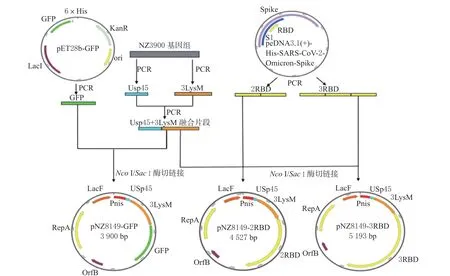
图1 表面展示载体构建流程图Fig.1 The flow chart of construction of the surface displaying vectors
1.5 乳酸乳球菌感受态细胞的制备、转化和转化子的筛选
感受态细胞制备和电转化方法按文献[19]中的方法进行,参数设置(脉冲:25 μF,电阻200 Ω,电压2 000 V)。30 ℃静置培养24 h 后于Elliker 固体筛选培养基中挑取阳性转化子进行菌落PCR 验证,PCR 反应体系:上下游引物(Primer1、6 用 于 验 证pNZ8149-GFP,Primer1、11 用 于 验证pNZ8149-2RBD/3RBD )各0.5 µL,2×EsTaqMasterMix 5 µL,ddH2O 4 µL,在平板中蘸取少许菌体于上述体系中混匀;反应程序:预变性95 ℃5 min,变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃3 min,25 个循环后,终延伸72 ℃ 10 min。将上述PCR 产物经琼脂糖凝胶电泳鉴定后挑选阳性克隆并送至北京擎科生物科技股份有限公司测序验证。
1.6 重组乳酸菌的诱导及诱导条件的优化
①活化培养:将阳性重组乳酸乳球菌接种于5 mL GM17 液体培养基中30 ℃静置培养过夜,再按4%的接种量接种于5 mL GM17 液体培养基中,继续培养3 ~4 h 直至OD600≈0.4。②诱导表达:分别用终质量浓度为0 、1.0、5.0、10.0、20.0、40.0、80.0 和100.0 ng/mL 的Nisin[19]诱导5 mL 重组菌液,15 h 后终止培养。③RNA 提取:依次取经不同浓度Nisin 诱导后的菌液3.0 mL,4 ℃,12 000 r/min离心5 min,沉淀中加入1.0 mL 总RNA 提取试剂,涡旋振荡,常温静置5 min。离心后取800.0 μL 加入到1.50 mL 离心管中,再加入200.0 μL RNA 提取液,混匀冰上静置3 min。然后离心后取上清200.0 μL加入到1.5 mL 离心管中,再加入异丙醇混匀,于-20 ℃下醇沉30 min。4 ℃,12 000 r/min 离心10 min,弃上清,用75% 乙醇洗涤沉淀2 次,每次4 ℃,12 000 r/min 离心2 min,弃上清,开盖静置约15 min,加入10.0 μL DEPC 水溶解,备用。④反 转 录:按 照EasyScript® One-Step gDNA Removal and cDNA Synthesis SuperMix 试剂盒说明进行操作。⑤实时荧光定量PCR 检测:利用表1 中的引物(Primer 14 ~17),通过实时荧光PCR 筛选最佳诱导浓度[20]。⑥按照步骤①重新培养重组菌液至OD600≈0.4,加入步骤⑤选出最佳浓度的Nisin 诱导5、10、15、20、25 和30 h 后终止培养,4 ℃,12 000 r/min 离心5 min,按步骤③④⑤操作选定最佳诱导时间。
1.7 表达产物SDS-PAGE 和Western blot 分析
阳性转化子诱导表达后,取1.0 mL 菌液4 ℃12 000 r/min 离心5 min 收集菌体,超声波破碎(300 w,3 s /3 s,15 min)后制备蛋白样品,进行SDS-PAGE 电泳,电泳结束后转膜进行Western blot,步骤包括①转膜:将聚偏二氟乙烯(PVDF)放在甲醇中浸泡5 min,将分离胶和PVDF 膜固定,调电压至300 V,电泳3 h 转膜。②封闭:转膜完毕后,将PVDF 膜转移至封闭液中封闭30 min 或过夜。③洗涤:用TTBS 液在水平摇床上洗膜3 次,每次5 min。④一抗、二抗孵育:于PVDF 膜上加入适量由TTBS 脱脂乳缓冲液按1∶1 000 分别稀释的一抗GFP-Tag、His-Tag,室温孵育3 h。之后用TBST 清洗3 次,每次10 min。于PVDF 膜上加入适量TTBS 脱脂乳缓冲液按1∶10 000 稀释的二抗,室温孵育2 h。⑤显色观察:用TTBS 溶液清洗3 次,每次10 min,于PVDF 膜上滴加超灵敏化学发光显色液显色;使用凝胶成像仪观察结果。
1.8 表达产物的间接免疫荧光
①阳性转化子诱导表达后,取1.0 mL 菌液4 ℃,5 000 r/min 离心10 min,弃上清;②菌体沉淀用无菌PBS 缓冲液洗涤3 次,4 ℃,5 000 r/min 离心10 min,弃上清;③加入PBS 1∶200 稀释的一抗(鼠抗his 单克隆抗体),混合均匀,37 ℃水浴作用60 min;④用PBS 缓冲液吹吸菌体,震荡混匀后,4 ℃,5 000 r/min 离心5 min,弃上清,清洗3次;⑤加入PBS 1∶200稀释的二抗(YF®488 羊抗鼠二抗),混合后于37 ℃作 用60 min,4 ℃,5 000 r/min 离 心5 min;⑥用PBS 缓冲液悬浮菌体,混匀后4 ℃,5 000 r/min 离心5 min,弃上清,重复洗涤3 次;⑦最后将菌体沉淀悬浮于200 µL PBS 缓冲液中,取适量涂片;⑧自然干燥后,用预冷无水乙醇固定30 min,荧光显微镜下观察。
2 结果与分析
2.1 目的基因的获得
分别以L.lactisNZ3900 基因组、pcDNA3.1(+)-His-SARS-CoV-2-Omicron-Spike 质 粒 和pET28b-GFP 为 模 板,PCR 扩 增Usp45+3LysM、RBD和GFP基因,PCR 产物的凝胶成像结果如图2。
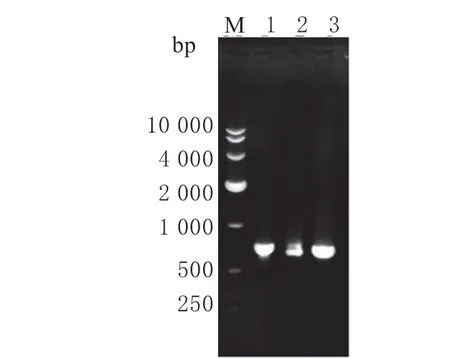
图2 3 个目的基因的PCR 产物Fig.2 PCR products of three target genes
泳道1、2、3 分别为PCR 扩增获得的GFP、RBD、Usp45+3LysM基因片段,与预期大小为742、675 和694 bp 的目的基因片段一致,说明成功克隆目的基因。
2.2 表达载体的构建和验证
利用融合PCR 和酶切连接方式构建的pNZ8149-GFP、pNZ8149-2RBD 和pNZ8149-3RBD载体,通过限制性内切酶NcoI/SacI 进行双酶切验证。由图3 可知,泳道1 为NcoI/SacI 双酶切pNZ8149-3RBD 载体,由于其双酶切后的载体和连接片段大小相近,所以呈现1 条带。泳道2 为NcoI/SacI 双酶切pNZ8149-2RBD 载体,条带大小分别为2 020 和2 507 bp。泳道3 为NcoI/SacI双酶切pNZ8149-GFP,条带大小分别为1 393 和2 507 bp,条带大小与理论预期值一致,表明已成功构建表达载体pNZ8149-GFP,pNZ8149-2RBD 和pNZ8149-3RBD。
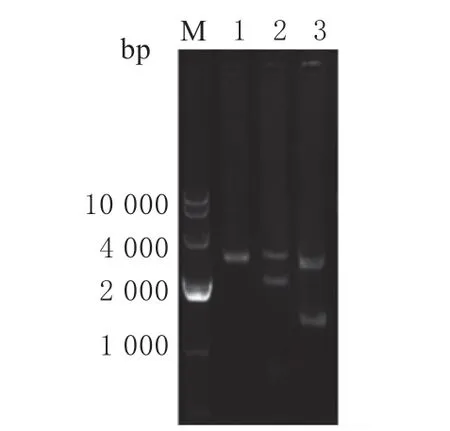
图3 重组质粒PCR 及酶切验证Fig.3 Verification of the recombinant plasmid by PCR and restriction enzyme digestion
2.3 乳酸乳球菌阳性转化子的获得
将上述重组表达载体电击转化入乳酸乳球菌后涂布于GM17 平板,经30 ℃培养24 h 后挑取菌落进行PCR 验证,结果如图4 所示。
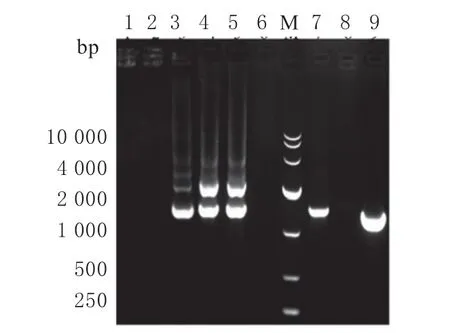
图4 阳性转化子的PCR 验证Fig.4 PCR verification of the positive transformants
泳道3、4、5、7、9 显示目的条带,初步鉴定为阳性重组菌株(泳道3:L.lactisNZ3900-3RBD菌株;泳道4、5:L.lactisNZ3900-2RBD 菌株;泳道7、9:L.lactisNZ3900-GFP 菌株),挑选条带明亮的阳性转化子进行后续的试验。
2.4 Nisin 诱导剂最佳诱导浓度和诱导时间的确定
通过实时荧光定量PCR 测定GFP 的mRNA 转录水平,以评估Nisin 的最佳诱导时间和浓度(图5),结果表明不同浓度的Nisin 对GFP 的诱导表达效果影响明显,1 ~20 ng/mL 浓度区间时,随Nisin 浓度提高,诱导效果明显增加,在20 ~100 ng/mL 浓度区间,随着Nisin 浓度提高,诱导效果逐渐减弱,20 ng/mL 时表达效果最佳。以摸索出的最适诱导浓度(20 ng/mL)为基础,通过诱导不同时间观察GFP 荧光相对表达量,结果显示,5 ~20 h 表达量逐渐增高,随后下降,表明20 h 为最佳诱导时间。因此,最终选定20 ng/mL 诱导20 h 为最佳诱导条件。
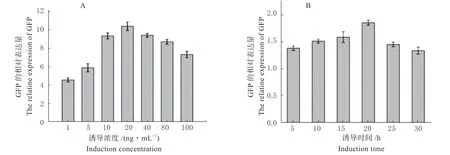
图5 Nisin 诱导剂的最佳诱导浓度(A)及时间(B)Fig.5 The optimum induction concentration (A) and induction time (B) of Nisin
2.5 重组蛋白的Western blot 鉴定
于30 ℃培养乳酸乳球菌至 OD600≈0.4 时加入诱导剂Nisin,使其终浓度为20.00 ng/mL,20 h 后离心取菌体进行超声破碎,通过Western blot 检测重组菌株是否表达目的蛋白(图6)。结果表明泳道1、2、3 中Western blot 显色条带相对分子质量大小分别为47.2 、71.3 和96.3 kD,分别与表面展示目的蛋白3LysM-GFP、3LysM-2RBD、3LysM-3RBD 的 理 论分子量大小一致,表明重组菌株成功表达目的蛋白。
图6 3 种目的重组蛋白的Western blot 鉴定Fig.6 Identification of three target recombinant proteins using western blot
2.6 重组乳酸乳球菌表达产物的间接免疫荧光鉴定
将表达目的蛋白和空载体的乳酸乳球菌进行间接免疫荧光试验,如图7 所示,(1)、(2)、(3)分 别 为L.lactisNZ3900-GFP、NZ3900-2RBD、NZ3900 -3RBD 菌株,有可见的绿色荧光产生,且(2)较(3)的绿色荧光信号更强一些。(4)阴性对照(L.lactisNZ3900-pNZ8149 菌株)中未观察到绿色荧光信号亮点,说明3 个重组乳酸乳球菌菌株都分别表达了外源蛋白,并成功展示于细胞壁上。

图7 重组乳酸乳球菌工程菌间接免疫荧光结果Fig.7 Indirect immunofluorescence results of recombinant L.lactis engineerred strains
3 结论与讨论
本试验尝试构建了2 种RBD 串联重复表达载体,并成功地在工程菌中获得表达,表明RBD 的二聚体和三聚体形式具有模拟S1 蛋白中RBD 天然构象并获得高效免疫原性的可能性。本试验应用基因工程技术成功构建了表达2RBD 和3RBD 的乳酸乳球菌工程菌株,Western blot 检测显示表达2RBD 和3RBD 的工程菌分别在71.3 和96.3 kD 处有明显的蛋白条带,且在荧光显微镜观察到绿色荧光信号,证明这2 种蛋白成功展示在乳酸菌表面。但3RBD较2RBD 荧光信号更弱一些,可能是因3RBD 肽链较2RBD 更长而导致展示效率降低所致,这与Quigley BR[21]的结论一致,说明外源蛋白越大越不容易穿过细胞膜和细胞壁结构而展示在细胞壁上,进而影响其在L.lactis的表面展示效果。
相比于传统疫苗,口服疫苗具有成本低廉、给药方便,可以诱导黏膜免疫,从而刺激全身和粘膜部位的体液和细胞免疫反应,激活更加广泛和持久的免疫效果。乳酸菌能以活菌的形式到达肠道并在其表面定植,可以作为口服疫苗递送的载体,在发挥其益生功能的同时稳定表达外源抗原,因此成为口服疫苗递送载体的首选。目前常用的乳酸菌表达系统主要分为诱导型和组成型,组成型系统会持续表达蛋白,但持续表达会导致细胞内蛋白质蓄积、聚集,增加宿主菌的代谢负荷或损伤,而诱导型表达载体中目标基因的表达受诱导物控制,可实现目标蛋白高效诱导表达,避免了组成型表达对细胞的持续伤害。现在常用的是人们所开发的由乳链菌肽(Nisin)控制的基因表达(NICE)系统,也是常用的系统[22],所以本试验采用此系统进行诱导表达。乳酸乳球菌常被用作基因工程的宿主菌[23],采用乳酸乳球菌作为受体菌实现了外源蛋白的成功展示,证明乳酸乳球菌是植物乳杆菌外的第2 种可成功展示SARS-CoV-2 的刺突蛋白并表现出高抗原性的乳酸菌[24]。构建乳酸菌食品级表面展示系统,可为表达展示酶分子、细胞因子、细菌或病毒的抗原、抗体和药物分子等提供素材,所得工程菌可用于生产菌制剂、酶制剂、疫苗、抗体和蛋白药物等产品,对乳酸菌在食品、发酵、医药等多领域的开发应用具有重要意义[25]。
本试验将乳酸菌的生物学特征和食用安全性相结合,成功构建了展示GFP 和新冠病毒omicron 变种抗原RBD 的乳酸乳球菌工程菌。这种方法克服了亚单位疫苗免疫原性弱的缺点,具有不需占用大量医疗资源,让人们在日常生活中也能实现预防接种,为未来疫苗研发提供依据和新思路。

