赤藓糖醇的生物学功能及临床应用研究进展
张译尹,邢晓蕊,王茹
(上海体育学院 运动健康学院,上海,200438)
饮食不健康、体力活动不足、空气污染等因素严重威胁着人类的健康。其中,《全球疾病负担研究2017》报道全球有1 100万人因不健康饮食而死亡,过多摄入含糖饮料是重要的饮食危险因素[1]。在许多慢性疾病的预防与治疗中,控制糖的摄入也尤为重要。《中国2型糖尿病防治指南》中提出,对于糖尿病患者而言,适量摄入糖醇和非营养性甜味剂(non-nutritive sweeteners, NNSs)是较为安全的日常糖摄入模式[2]。同时,《国民营养计划(2017—2030年)》、《食品甜味剂科学共识》等政策也指出了适量食用甜味剂代替蔗糖、果葡糖浆等添加糖,以实现国民健康生活方式中的“减糖”行动[3-4]。因此,近年来糖醇和NNSs作为糖替代品受到学者们的关注。针对NNSs,有研究显示其会影响体重、糖耐量、食欲和味觉敏感性,导致代谢功能障碍,甚至增加癌症风险[5-6],NNSs似乎不是最佳的糖替代品。
糖醇是含有2个以上羟基的多元醇,在食品工业中常被用作甜味剂、冷却剂、保湿剂和增稠剂[7]。其中,赤藓糖醇是一种C4多元醇,已由美国食品药品管理局批准用作甜味剂[8]。以往研究显示赤藓糖醇不仅可以改善过量摄入糖分所导致的肥胖及其引发的一系列代谢性疾病,还可以作为疾病预测的生物标志物[9]。因此,为清楚地了解赤藓糖醇的生物学效应,本文从其基本特征、代谢途径、毒副作用、生物学功能及疾病预测方面入手,全面梳理并归纳了现有研究结果,以指导其在大众健康人群及肥胖和代谢功能障碍人群中的应用。
1 赤藓糖醇概述
1.1 结构与性质
赤藓糖醇为白色结晶的C4多元醇类化合物,化学名称为1,2,3,4-丁四醇,分子式为C4H10O4(图1),具有热量低、甜味纯正、口感清爽等独特优点。与蔗糖相比,赤藓糖醇的热量仅有0.4 kcal/g,但甜度则达蔗糖的60~80%[10]。其较高的溶解热带来的降温效果也赋予其独特的清爽口感[11]。与人工甜味剂相比,赤藓糖醇没有后苦感,风味更佳[12]。同时,在酸性和碱性pH下也很稳定,不会发生影响食品色泽的美拉德反应[13]。因此,赤藓糖醇作为一种能量低、口感佳的天然甜味剂广受大众欢迎。

图1 赤藓糖醇的分子式Fig.1 Molecular formula for erythritol
1.2 来源与合成
人体内的赤藓糖醇一方面来自外源性食物摄入,另一方面也可由内源性葡萄糖代谢途径产生。赤藓糖醇天然存在于水果(如葡萄和西瓜)、真菌(如海藻和蘑菇)以及发酵食品(如清酒和酱油)等食物中[12]。目前,赤藓糖醇的生产方法主要有3种,即生物提取法、化学合成法和微生物发酵法。相较而言,微生物发酵法因其生产条件温和、产品质量稳定、食品安全性高而成为最理想的赤藓糖醇生产方法,并主要通过酵母菌或酵母样真菌生物转化富含葡萄糖底物的生物工艺技术实现[13-14]。
作为一种内源性葡萄糖代谢物,赤藓糖醇的表达具有一定的时空特征。首先,赤藓糖醇主要在肝脏和肾脏处产生[15],存在于动物体液中,如人体眼球、血清、尿液、胎液等[11,14]。人体稳定同位素示踪试验揭示了赤藓糖醇是由葡萄糖通过磷酸戊糖途径(pentose phosphate pathway, PPP)产生的中间代谢物-赤藓糖-4-磷酸(erythrose-4-phosphate, E4P)还原而成(图2),具体途径为:E4P生成赤藓糖,赤藓糖通过乙醇脱氢酶1和山梨醇脱氢酶生成赤藓糖醇,烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)为赤藓糖醇还原提供辅助因子,其中,催化E4P生成赤藓糖的酶还未确定[16]。在全生命周期过程中,胎儿时期的PPP非常活跃[17]。研究发现包括赤藓糖醇在内的大多数多元醇在羊水和体腔液内的浓度显著高于母体血清,而出生后赤藓糖醇的浓度则开始下降,并在第一年达到相对较低的稳定状态[18-20]。这提示PPP相关的赤藓糖醇可能在胎儿发育过程中具有重要的代谢功能。
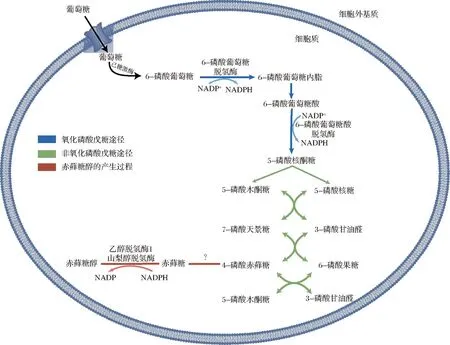
图2 赤藓糖醇的内源性产生过程[15]Fig.2 Endogenous production of erythritol[15]
1.3 吸收与代谢
赤藓糖醇是一种4碳化合物,分子质量小、亲水性强[21]。当人体摄入赤藓糖醇后,约80%~90%通过被动扩散被小肠吸收,剩余的10%则进入大肠作为碳源发酵(图3)。并且随着赤藓糖醇摄入剂量的增加,进入到大肠的赤藓糖醇比率也会增加[22]。其中,经小肠被人体吸收的赤藓糖醇在组织中广泛分布,约5%~10%的赤藓糖醇在血液中被氧化成赤藓糖,随后迅速地被进一步氧化生成赤藓糖酯,最后从尿液中排出[9, 15, 23-25]。其余未被氧化的赤藓糖醇因不能被机体内的酶系统所分解,只能透过肾脏从血液中滤过,经尿液排出体外[23-24,26]。而进入大肠的赤藓糖醇则会经过肠道菌群的发酵转化为短链脂肪酸(short-chain fatty acids, SCFAs)[22, 27],SCFAs被吸收入肠道后可以通过其抗炎效应改善饮食诱导代谢紊乱,对肥胖和炎症性肠道疾病具有保护作用[22, 28-29]。
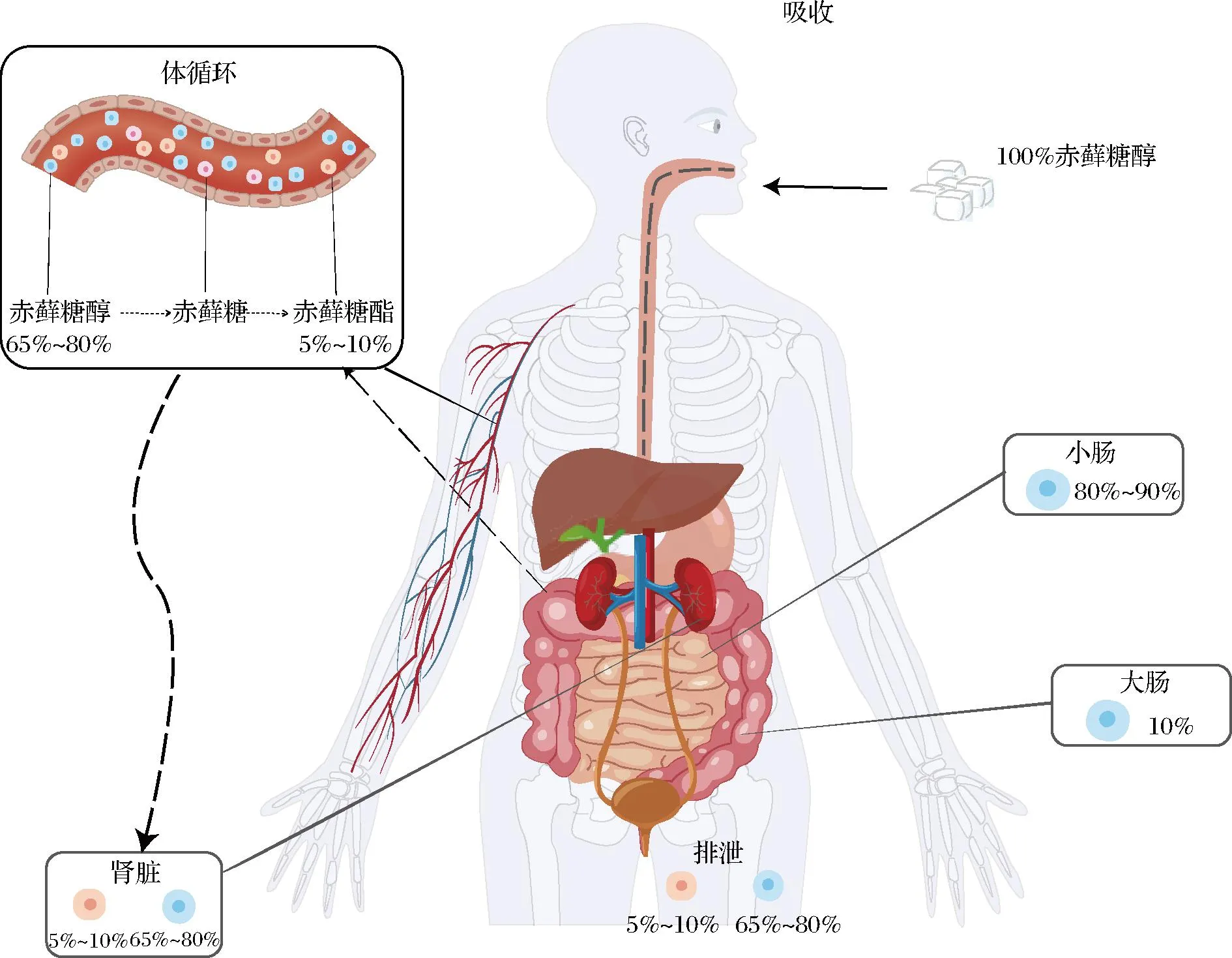
图3 赤藓糖醇的吸收与代谢过程Fig.3 Absorption and metabolism of erythritol
1.4 推荐剂量与毒副作用
许多研究证明0.6~0.8 g/kg是赤藓糖醇的安全剂量范围[30-33],建议单次服用剂量不宜超过35 g,否则会出现恶心、腹鸣等不良反应[30, 32-35]。若要补充大剂量的赤藓糖醇,逐步增加剂量的长期适应性摄入模式可减少胃肠道不耐受的症状[36]。在补充赤藓糖醇时,还应注意尽量避免与等浓度的果糖同时摄入,否则会导致肠道对于碳水化合物的吸收不良[37]。此外,在以人、鼠和犬为研究对象的口服毒性实验中,赤藓糖醇的推荐摄入量不会造成任何器官的功能受损或组织病理学变化,对血液学和临床化学参数也没有任何与治疗相关的不良影响,因此推荐剂量范围内的赤藓糖醇无致畸毒性[38-43]。此外,赤藓糖醇也不会诱导或促进肿瘤恶化[39]。但是,目前研究报道有5例因口服含赤藓糖醇的食物、饮料后出现过敏反应的事件,而这可能是由免疫球蛋白E和血浆中的某些物质(如血清白蛋白)所介导的嗜碱粒细胞活化而引起[44-48]。口服免疫治疗可作为赤藓糖醇过敏治疗的一种选择[49]。有研究发现赤藓糖醇可能会加重由于内皮祖细胞损害和缺血脑中血管生成减少所导致的脑缺血损伤[50]。因此赤藓糖醇的摄入剂量、频率及模式还需要进一步深入的研究,以确定赤藓糖醇对于机体各系统的安全剂量范围。
2 外源性赤藓糖醇补充的生物学功能
2.1 赤藓糖醇与糖脂代谢
糖脂代谢是细胞及机体能量与物质来源的重要生命过程,糖脂代谢失衡会引起多种疾病,影响人类健康[51]。目前已在不同模型中开展广泛研究,探讨赤藓糖醇对糖脂代谢的影响及可能机制。
在健康人群中,不论是单次还是多次摄入赤藓糖醇,血糖血脂和糖耐量都不会受到影响。具体有单次口服推荐剂量的赤藓糖醇(0.3~0.8 g/kg)不会影响人体血糖、血脂、胰岛素和胰高血糖素水平[10,32-33]。即使较高剂量的赤藓糖醇(1 g/kg)也没有引起血浆胰岛素和血糖水平的上升[25,35]。在动物实验中开展的长期研究也发现,连续8周、每天摄入含40 g/kg赤藓糖醇的低脂饮食或高脂饮食对小鼠的葡萄糖耐量、身体成分没有影响[52]。但是在与糖尿病相关的研究中却发现赤藓糖醇不仅能够维持2型糖尿病(type 2 diabetes mellitus, T2DM)患者、糖耐量异常患者的血糖、血脂稳态,还具有降血糖的潜力。糖尿病患者单次服用20 g赤藓糖醇后血糖和胰岛素水平没有显著变化,但是随着摄入次数的增加,空腹血糖和糖化血红蛋白(hemoglobin A1c, HbA1C)下降[53]。在动物实验中,YOKOZAWA等[54]连续10 d、每天给予糖尿病大鼠100、200或400 mg/kg的赤藓糖醇,其血清、肝脏和肾脏的葡萄糖水平下降,且具有剂量效应。然而有一项研究显示摄入赤藓糖醇会导致游离脂肪酸和3-羟基丁酸水平增加,但是在进食后上述指标出现下降,这个现象可能是因为赤藓糖醇几乎不为机体提供能量,测试中的受试者处于饥饿状态所致[53]。
针对赤藓糖醇上述的降糖效应,研究人员进一步利用动物和细胞实验开展了大量机制研究。研究人员在对T2DM大鼠注射葡萄糖加赤藓糖醇和苯酚红或只注射葡萄糖和苯酚红后,测定其血清和胃肠道组织中葡萄糖和酚红的含量,结果显示赤藓糖醇显著减少了正常和T2DM动物小肠前1/4段对葡萄糖的吸收[55]。然而,BORDIER等[56]的研究表明长期摄入赤藓糖醇不会影响肥胖人群的肠道葡萄糖吸收。结论的不一致可能与摄入频率、实验对象的不同有关。在细胞实验中,CHUKWUMA等[55]证明赤藓糖醇能使离体肌细胞的葡萄糖摄取呈剂量依赖性地增加,并且这种效应不依赖于胰岛素。值得注意的是,该团队还在一项体内研究中发现赤藓糖醇可显著改善糖尿病动物的糖耐量,明显增加由于糖尿病引起的血清胰岛素耗竭,尤其是在摄入葡萄糖后30和60 min,但对正常动物的血清胰岛素水平没有显著影响。此外,赤藓糖醇还可增加糖尿病引起的肌肉己糖激酶和肝葡萄糖激酶活力的降低,降低糖尿病引起的肝葡萄糖-6-磷酸酶活力的升高,上调糖尿病大鼠肌肉葡萄糖转运体4(glucose transporter type 4, GLUT-4)和胰岛素受体底物1(insulin receptor substrate 1, IRS-1)表达[55]。与此同时,WEN等[57]发现赤藓糖醇的降糖机制也可能是通过竞争性抑制α-葡萄糖苷酶,进而阻止多糖水解来实现。
综上所述,赤藓糖醇具有降糖的生物学效应,其机制可能与机体葡萄糖吸收减少、肌细胞葡萄糖摄取增加和胰岛素信号通路上调有关。
2.2 赤藓糖醇与氧化应激
氧化应激是细胞与组织中氧化和抗氧化系统之间不平衡的结果,主要原因为机体内活性氧(reactive oxygen species, ROS)的生成增加和(或)清除能力降低[58],许多疾病的发生与机体抗氧化系统紊乱密切相关。研究显示赤藓糖醇是一种具有抗氧化特性的物质。YOKOZAWA等[54]采用糖尿病动物模型来检测赤藓糖醇的抗氧化作用,结果显示连续10 d补充100、200或400 mg/kg的赤藓糖醇在显著降低血糖水平的同时,呈剂量依赖性地降低了血清、肝脏和肾脏中的肌酐、硫代巴比妥酸活性物质和5-羟甲基呋喃甲醛的水平。这表明赤藓糖醇可以影响葡萄糖代谢,减少脂质过氧化,改善机体氧化应激[54]。在细胞实验中,DEN HARTOG等[59]以红细胞为模型的研究显示赤藓糖醇与羟自由基反应转化为赤藓糖和赤藓酮糖,在喂食赤藓糖醇的糖尿病大鼠尿液中检测出了赤藓糖,提示羟自由基已经被赤藓糖醇清除。
赤藓糖醇不仅是一种极好的自由基清除剂和抑制剂,还具有内皮保护功能。赤藓糖醇可以抑制2,20-偶氮-2-氨基丙烷二盐酸盐引起的溶血,对减轻高血糖症引起的血管损伤起到积极作用[59]。BOESTEN等[60]通过对内皮细胞的研究发现赤藓糖醇在高血糖条件下有很强的血管保护作用,这很可能是由于它的抗氧化特性。此外,赤藓糖醇的内皮保护作用也进一步在人体试验中得到验证[61]。然而,ALAMRI等[62]在细胞实验中研究了赤藓糖醇对THP-1巨噬细胞的生理作用,发现在赤藓糖醇干预后促炎症的M1型巨噬细胞丰度增加,而抗炎的M2型巨噬细胞丰度减少。同时,赤藓糖醇增加ROS生成,激活Akt通路,使细胞内钙超载和细胞周期停滞在G1期,导致了氧化平衡、钙稳态和细胞周期进程的失调,从而造成坏死性巨噬细胞的数量增加。
综上所述,赤藓糖醇是一种具有抗氧化活性的生物分子,对生物膜氧化损伤具有保护作用,同时还可以保护血管,显著改善小血管内皮功能,降低中央主动脉僵硬。但是赤藓糖醇诱导了THP-1来源的巨噬细胞致炎表型的极化,干扰巨噬细胞氧化还原动态平衡和增殖能力。因此,未来还需要对不同细胞类型开展全面的体内(外)研究,以确定赤藓糖醇对机体氧化应激的影响。
2.3 赤藓糖醇与胃肠激素
胃肠激素是一类由存在于胃肠道黏膜层及胰腺内的内分泌细胞和旁分泌细胞分泌、由胃肠壁的神经末梢所释放的一组小分子高效能生物活性物质[63]。除了对消化系统的生理功能起着重要的调节作用外,胃肠激素对肿瘤、免疫与炎症以及某些神经系统疾病的发生也起着重要的调节作用[64]。
大量研究证实摄入赤藓糖醇可以促进胃肠激素中胆囊收缩素(cholecystokinin, CCK)、酪酪肽(peptide tyrosine tyrosine, PYY)、胰高血糖素样肽1(glucagon-like peptide-1, GLP-1)的分泌,延缓胃排空。在人体实验中,WÖLNERHANSSEN等[35]研究了单次口服75 g赤藓糖醇对健康的受试者胃肠道影响,结果表明赤藓糖醇可显著增加CCK和GLP-1的释放,延缓胃排空。低剂量的赤藓糖醇(10、25或50 g)同样可以诱导GLP-1、PPY和CCK的释放,并延缓胃排空[32]。研究显示赤藓糖醇导致的胃排空延缓可能是由胰岛素刺激,特别是CCK介导的[35]。此外,与蔗糖相比,赤藓糖醇对胃肠激素分泌以及能量摄入和能量偏好的影响无显著差异[65]。这提示赤藓糖醇可以作为蔗糖的有效替代剂。谈及其激素分泌的机制,最近研究证明赤藓糖醇刺激人体CCK、GLP-1和PYY胃肠激素释放的机制与糖类和NNSs不同,并不是通过肠道中的1型味觉受体2和1型味觉受体3介导[66-67]。因此,赤藓糖醇刺激胃肠激素释放的具体作用机制还有待进一步研究。
2.4 赤藓糖醇与其他生物学功能
目前也有部分研究探讨了赤藓糖醇与骨代谢、食欲和心血管系统的关系。在骨骼系统中,饮食中的赤藓糖醇不会对骨吸收产生影响[68]。摄入赤藓糖醇可剂量依赖性地增加空肠、回肠、盲肠和结肠的钙转运,提高钙吸收[69]。此外,摄入赤藓糖醇还可以加强大脑内食欲调节稳态和奖赏相关区域网络中功能连接,不改变下丘脑正常活动,增加了满足感,对食欲也不会造成负面的影响[70]。还有研究显示,包括赤藓糖醇在内的营养甜味剂对餐后血压的影响很小,甚至没有影响。因此,将葡萄糖、果糖和蔗糖等添加糖替换为赤藓糖醇,可能是一种简单而有效的餐后低血压治疗策略[71]。有关赤藓糖醇在人体中生物学功能的文献资料详见表1,在动物中生物学功能的文献资料详见表2。
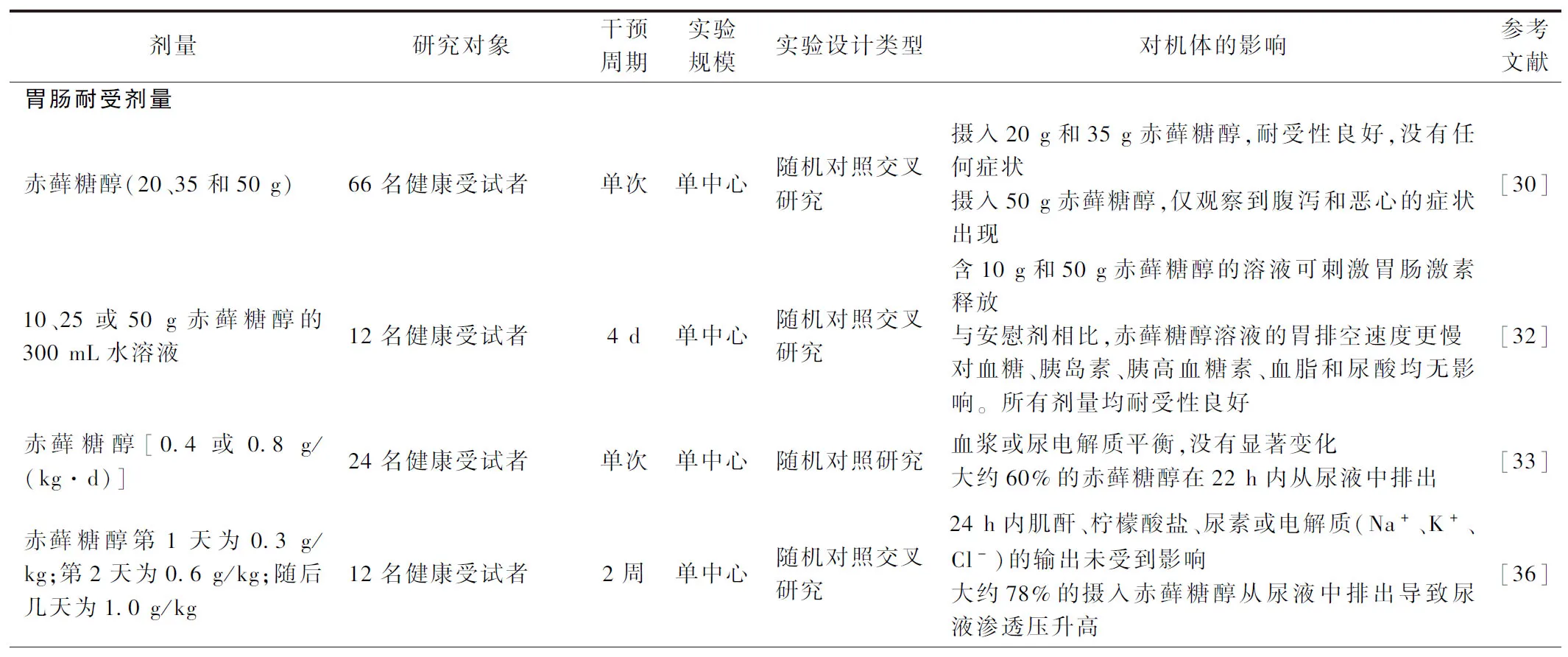
表1 赤藓糖醇在人体中的生物学功能Table 1 Biological functions of erythritol in humans
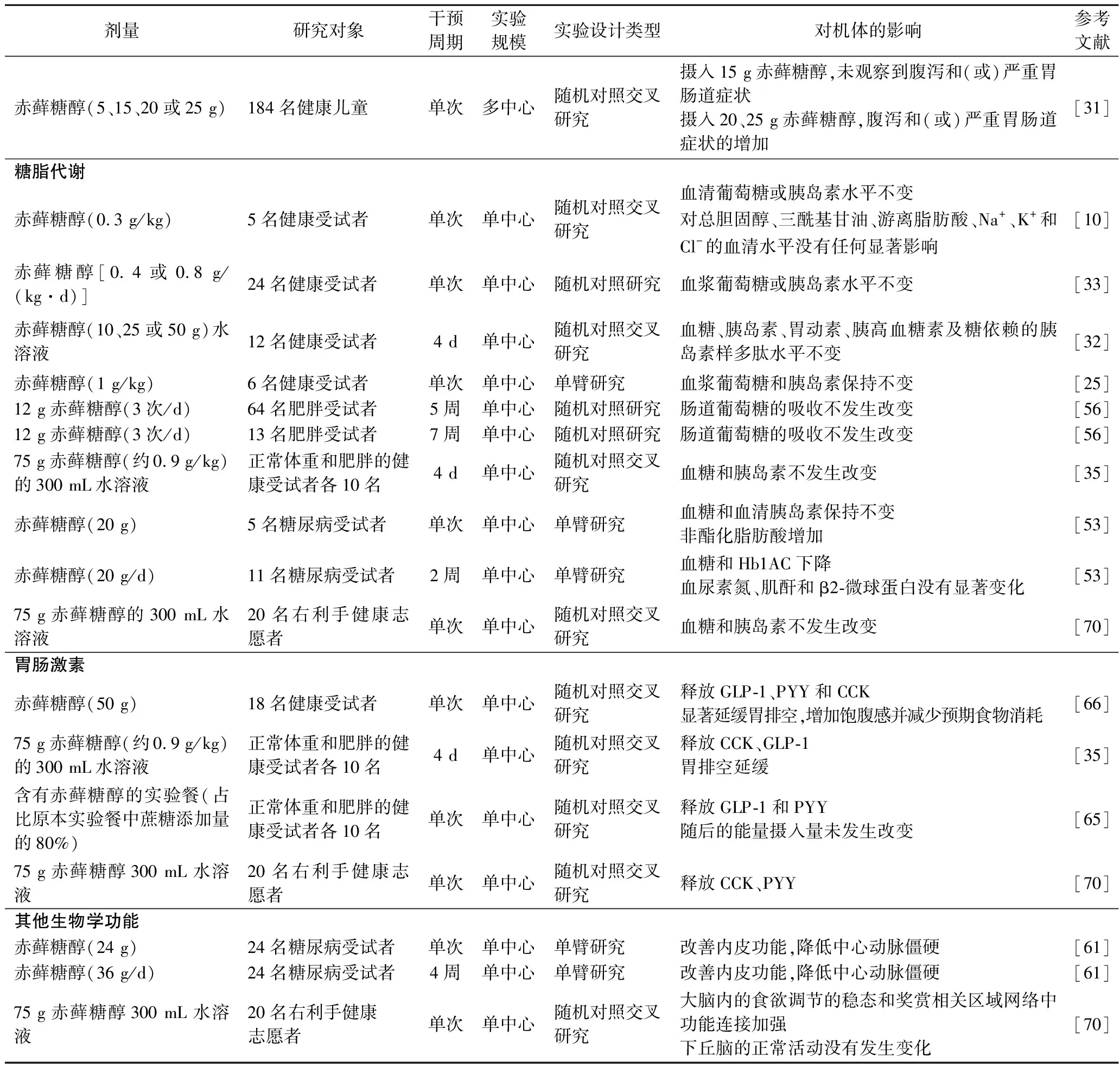
续表1

表2 赤藓糖醇在动物中的生物学功能Table 2 Biological functions of erythritol in animals

续表2
3 赤藓糖醇作为一种新型的疾病生物标志物
随着高通量代谢组学研究手段的普及,多项研究证实赤藓糖醇可以作为内源性生物标志物预测转醛醇酶(transaldolase, TALDO)缺陷病、代谢性疾病、心血管疾病和癌症的发生。
TALDO缺陷病是一种罕见的先天性PPP缺陷累及多系统的常染色体隐性遗传病[17]。临床表现为严重的、早期发病的多系统疾病,受累机体的体液尤其是尿液中多元醇浓度异常[72]。TALDO是非氧化PPP途径中第二个酶,与PPP和糖酵解途径紧密联系。研究推测TALDO缺乏导致的7-磷酸景天庚酮糖堆积会作为毒性产物降低体内糖磷酸化水平,从而导致细胞毒性反应,如赤藓糖醇水平升高[72]。在临床上,采集新生儿尿样,检测其中赤藓糖醇的浓度是预测TALDO缺陷病的标志之一。
在代谢性疾病领域,HOOTMAN等[15]首次证实血清赤藓糖醇升高先于人类中心性肥胖的发生。通过9个月的前瞻性队列研究,发现在同一时间段内,中心性肥胖增加的参与者基线血清赤藓糖醇水平是稳定肥胖者的15倍,并且在样本HbA1C值的前25%范围内,参与者的血清赤藓糖醇水平也要高出21倍,这提示赤藓糖醇有可能在肥胖发生发展的某一阶段发挥重要作用。同时也有研究证明,血清赤藓糖醇极大地提高了传统危险因素对糖尿病发生的预测能力[73]。此外,血清赤藓糖醇还可以预测糖尿病肾病的风险。与临床标记物相比,血清赤藓糖醇水平与2种额外的代谢物相结合,显著提高了微量白蛋白尿发生的预测[74]。此外,在进行代谢组范围冠心病风险分析的研究中,发现血清赤藓糖醇与冠心病发生的风险呈显著相关性[75]。在癌症领域,肺癌患者血清样本中赤藓糖醇水平显著增加[76],并且血浆中的赤藓糖醇与小细胞肺癌患者的预期寿命相关[77]。利用气相色谱-质谱法筛选肺癌患者中差异表达的代谢物,并通过结合代谢组学和转录组学图谱,确定了赤藓糖醇为重要的代谢物,可以作为肺癌的生物标志物[76]。
综上所述,血清和尿液中的赤藓糖醇水平在一定程度上与TALDO缺陷病、代谢性疾病、心血管疾病和癌症发生呈明显的相关性,可提示疾病发病前的早期代谢变化。赤藓糖醇生物效应及疾病预测功能如图4。
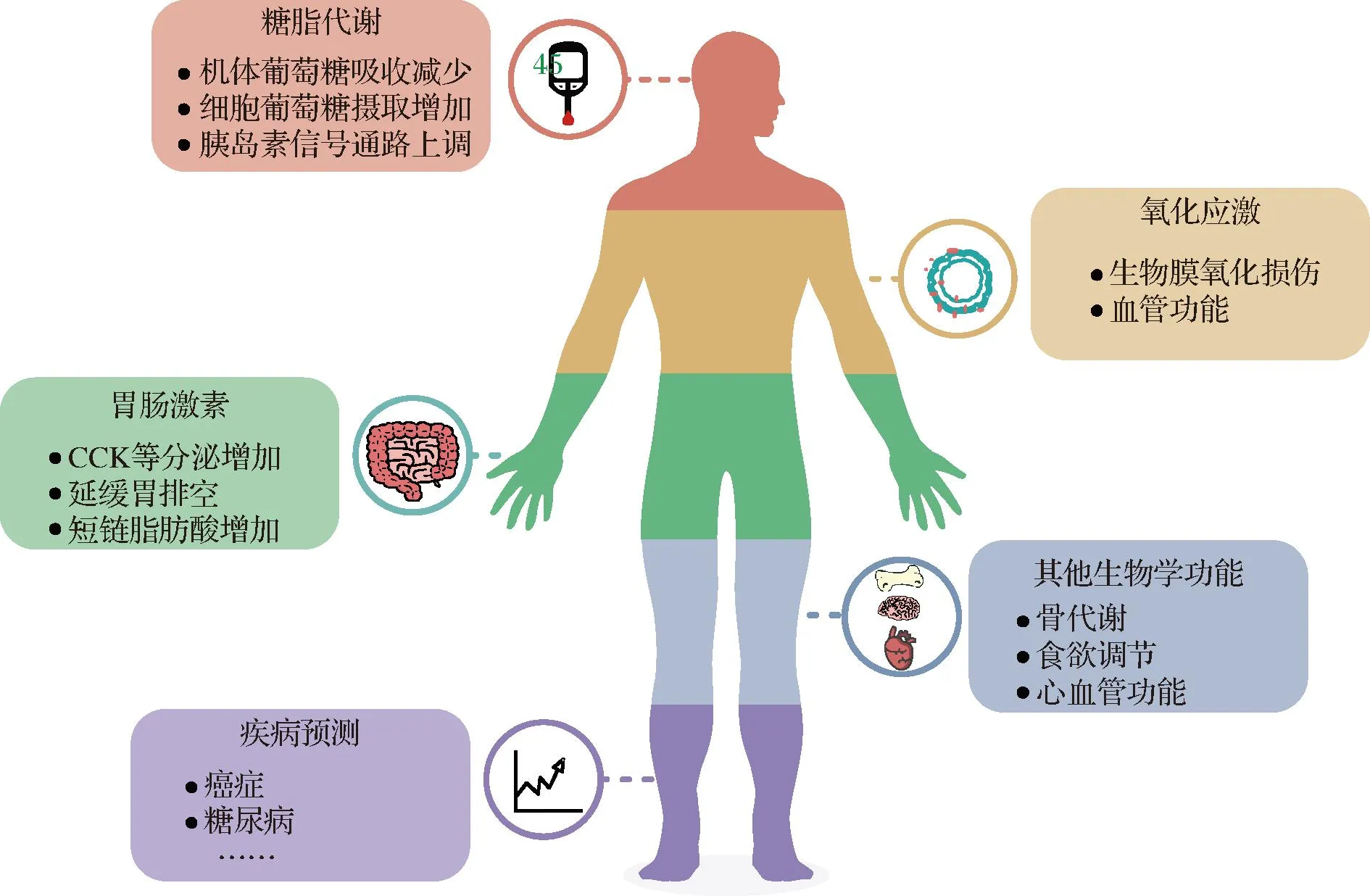
图4 赤藓糖醇的生物效应及疾病预测功能Fig.4 Biological effects and disease prediction functions of erythritol
4 总结与展望
综上所述,外源性的赤藓糖醇在糖脂代谢、氧化应激、胃肠激素等方面有多种生物学功能,并具有潜在的预防糖尿病和肥胖作用。此外,内源性的赤藓糖醇也可以预测代谢性疾病、心血管疾病、癌症等多种疾病,且对于胎儿时期的发育具有生理意义。
虽然赤藓糖醇作为日常生活中的糖替代品已经得到了广泛认可。但目前其对机体影响机制尚不清楚,对于机体整体和各组织器官的健康效应还有待进一步完善。此领域目前还存在以下问题有待进一步研究:(1)对于赤藓糖醇的最适口服剂量与频次还需进行进一步研究,以确保其对于机体心血管系统及其他器官系统的安全性;(2)赤藓糖醇虽然可以维持机体血糖、血脂稳态,还具有潜在的降血糖特性并减轻由于高血糖症引起的血管损伤,但是赤藓糖醇对于机体的脂质代谢障碍和氧化应激的影响需要进一步研究,以便它们作为更加安全的食品添加剂;(3)赤藓糖醇作为一种新型疾病生物标志物,需要进一步的研究证明饮食和内源性赤藓糖醇之间的关系,并需进一步对内源性赤藓糖醇生物合成调控进行更全面的研究以作为生物标志物。因此,开发赤藓糖醇为主要功能成分的糖尿病营养制剂,深入探索赤藓糖醇的生物学功能和对于各疾病预测作用具有广泛的社会价值和科学意义。