1344吡啶羧酸配体构筑的Cu(Ⅱ)-MOFs及其染料吸附降解性能
巫云龙,唐鹏飞,范 江,燕阳天
(1.西安工程大学 材料工程学院,陕西 西安 710048;2.陕西工业职业技术学院 化工与纺织服装学院,陕西 咸阳 712000)
0 引 言
有机染料是日常使用的化合物,在许多领域都有着广泛的应用,是纺织品、纸张、橡胶、皮革、印刷等产品的着色剂。大多数染料为有机化合物,在加工过程中被释放到废水中,造成环境污染。工业废水由各种有机和无机化合物组成,其中包括重金属离子、农药、化肥、有机染料等[1],这些染料大多有毒,能致癌和致基因突变性。最为关键的是,由于它们具有复杂、稳定的芳香结构[2],在阳光下不能降解。传统的废水处理方法有沉淀法、混凝法、化学膜法和混凝法[3-4]。对于废水中的有机污染物,主要有2种处理方法:一是使用合适的吸附剂来吸附废水中的有机污染物[5],如聚合树脂、生物材料、活性炭、黏土矿物、沸石、MOFs材料等[6]。吸附过程非常简单,成本效益高。在这一应用中,活性炭因其在吸附过程中的有效性而被广泛使用。但由于其成本高,操作难度大,实际应用受到很大的限制。因而人们开发了许多新的材料来取代传统活性炭进行染料吸附[7]。二是通过氧化过程降解有机污染物。降解过程是将有毒的有机化合物氧化成毒性较小的简单化合物或将其完全降解成CO2和水[8]。
金属-有机框架材料(metal-organic frameworks, MOFs)在不同应用领域中取得了巨大的成果,比如离子交换、气体储存、分离、催化和染料吸附等[9]。在染料去除方面,已有使用MOFs分析去除染料和含硫成分等危险有害物质[10]。目前的文献研究还表明,基于Cu(Ⅱ)的MOFs在不同的染料选择性吸附和光催化降解下效率较高[11]。迄今为止报道的具有新颖结构MOFs能够进行分离或吸附或催化降解或同时进行吸附和分离,可以作为多功能系统来实现阳离子/阴离子或阳离子/中性染料的混合物的2种不同类型的有机染料的吸附、分离和降解[12]。合成具有新颖结构和特定功能的MOFs可以通过改变其自组装过程中的核心因素来完成。主要包括:设计不同尺寸的有机配体、选择不同的中心金属离子、控制反应温度、调节溶剂体系的摩尔比以及溶液体系的pH值等。这些因素中合理地设计和选择有机配体是构筑配合物的关键因素[13],配体的柔韧性、结构、溶解度、尺寸和配位模式共同决定配合物的最终结构。在对配体进行设计的过程中,由于氮杂环多元羧酸配体上羧基氧原子和吡啶环上的氮原子与金属离子有较强的配位能力,且配体上羧基氧原子与金属离子可以形成灵活多样的配位模式,使其骨架更为稳固,从而使晶体在应用方面更为广泛,其在金属-有机框架材料的合成方面也受到普遍关注[14]。
为此,本文选择了V型刚性线型两羧酸配体6-(吡啶-3′-基)间苯二甲酸(H2L)和Cu(Ⅱ)作为构筑单元,在不同的溶液体系中反应得到了2种不同性能和结构的MOFs:{[Cu2(L)2·C2H3N]}n(1)、 {[Cu(HL)2]}n(2)。单晶测试结果表明,在不同的溶液体系中H2L的质子化程度不同,在配合物1中H2L配体完全质子化形成3D高维结构,而在配合物2中H2L部分质子化形成了低维的二维层状结构。由于H2L配体中羧基的不同质子化和与中心金属Cu(II)离子不同的配位模式,导致配合物1和2空间结构有差异,从而使配合物在实际应用方面具有不同的性质。
1 实 验
1.1 试剂与仪器
硫酸铜(CuSO4,AR,上海阿拉丁生化科技股份有限公司); 6-(吡啶-3′-基)间苯二甲酸(AR,济南恒化科技有限公司);乙腈(CH3CN,AR,国药集团化学试剂有限公司);溴化钾(AR,上海阿拉丁生化科技股份有限公司);甲基橙、刚果红等染料(AR,百灵威科技);水(自制)。所用试剂均为市售,没有经过进一步纯化。
烘箱(SF88-DHG-9075AD,上海一恒仪器);电子分析天平(AL-204,梅特勒-托利多);X射线单晶衍射仪(Bruker SMART APEX-Ⅱ,德国Bruker公司);X射线粉末衍射仪(Bruker D8 ADVANVE,德国Bruker公司);热失重分析仪(NETZSCHTG 209 F3,德国Elementar公司);紫外-可见光谱仪(Shimadzu UV-2450,巩义市予华仪器有限公司);红外光谱仪(Tensor 27 OPUS,德国Bruker公司);元素分析仪(VarioEL III,德国Elementar公司)。
1.2 配位聚合物1和2的合成
1.2.1 {[Cu2(L)2·C2H3N]}n(1)的合成
将CuSO4(24.9 mg,0.1 mmol)、H2L (48.6 mg,0.2 mmol)、8 mL的溶剂(CH3CN∶H2O=1∶1)混入20 mL的烧杯中,放置15 min。将静置后的溶液用滤纸过滤,上层清液加入到8 mL的聚四氟乙烯反应釜中,再向乙腈溶液中添加0.1 mL、浓度为1 mol· L-1的NaOH,然后将聚四氟乙烯反应釜放置在不锈钢外衬中。随后将反应釜放入预先设置好的升降温的烘箱中(升温阶段:4 h升至105 ℃,恒温72 h;降温阶段:10 ℃/h降至室温),烘箱运行结束后得到蓝绿色发射状晶体,再用乙腈溶液清洗。以H2L为标准估算所得晶体的产率约为52%。元素分析测定表明,计算值:C 48.3%, H 30%, N 5.2%; 实验值:C 48.5%, H 29.8%, N 5.1%。 对合成的晶体进行红外光谱测试(KBr,cm-1),其特征峰:3 458(w),2 758(vs),1 595(v),1 477(s),1 421(s),1 354(w),1 288(w),1 197(w),1 137(w), 897(w),858(w),715(s)(注:s:strong; m:medium; w:weak; vs:very strong)。
1.2.2 {[Cu(HL)2]}n(2)的合成
将CuSO4(24.9 mg,0.1 mmol)、H2L(48.6 mg,0.2 mmol)、8 mL的溶剂(CH3CN∶H2O=1∶1)混入20 mL的烧杯中,放置15 min。然后将静置后的混合溶液在滤纸中过滤,把得到的上层清液加入到8 mL的聚四氟乙烯反应釜中,再将聚四氟乙烯反应釜放置在不锈钢外衬中。随后将反应釜放入预先设置好的程序升降温的烘箱中(升温阶段:4 h升至105 ℃,恒温72 h;缓慢降温:10 ℃/h降至室温),反应结束后得到蓝色块状晶体,用乙腈溶液清洗得到的晶体,以H2L为标准对晶体的产率估算,产率约为59%。元素分析测定表明,计算值:C 49%,H 30.2%,N 3.8%; 实验值:C 48.9%,H 30.1%,N 3.79%。对合成的晶体进行红外光谱测试(KBr,cm-1),特征峰值:3 458(w),2 758(vs),1 595(v),1 477(s),1 421(s),1 354(w),1 288(w),1 197(w),1 137(w), 897(w),858(w),715(s)。
1.3 染料吸附降解
采用3种不同电性的染料进行吸附降解实验。将配合物1和2 (15 mg)分别加入到各有机染料的水溶液中(有机染料摩尔浓度为4×10-5mol· L-1),在室温下(未用任何光照射)进行吸附降解实验,并利用紫外可见光谱法进行吸附检测。实验中,将染料与水在室温下搅拌20 min,取7 mL染料于比色皿中,然后加入配合物进行紫外可见光实验,每隔15 min检测一次。
1.4 晶体数据及结构解析
常温下用Bruker APEX-Ⅱ衍射仪(Cu Kα辐射,λ=1.540 6))测试其衍射强度,并采用多次扫描法进行吸收校正。根据SHELXL中的全矩阵最小二乘法在F2中进行配合物1和2结构的细化。依赖于相关的其他原子,所有氢原子都在理论上添加,并用固定的热参数进行精简。配合物1和2各项参数见表1。配合物1和2的部分键长键角见表2、3。

表 1 配合物1和2的晶体结构数据
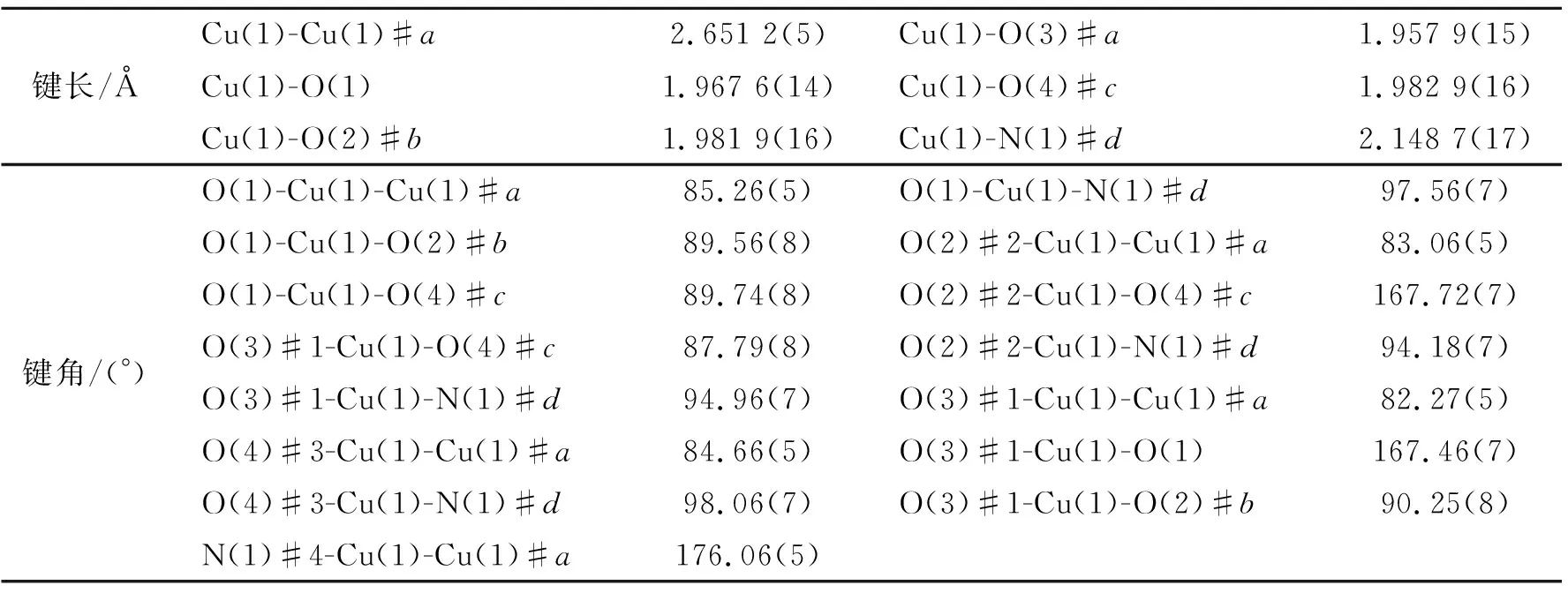
表 2 配合物1的部分键长和键角
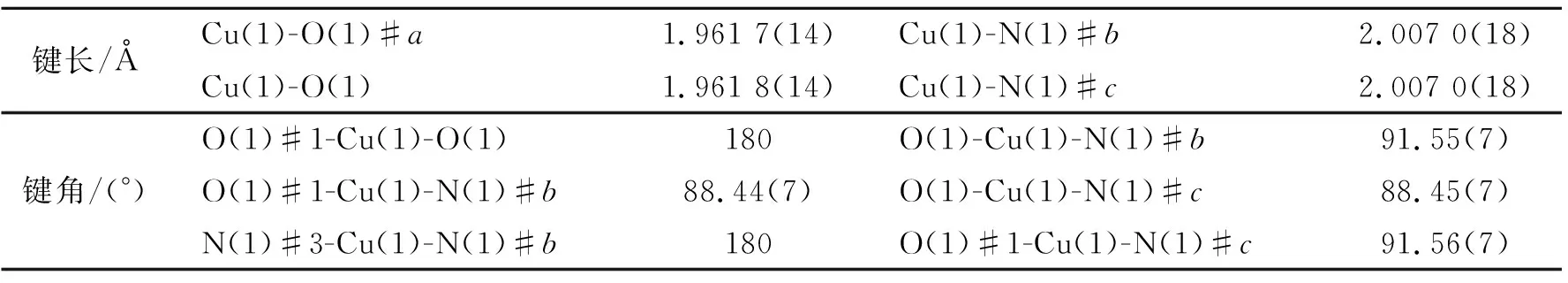
表 3 配合物2的部分键长和键角
2 结果与讨论
2.1 配合物的晶体结构
2.1.1 {[Cu2(L)2·C2H3N]}n(1)的结构分析
配合物1属单斜晶系,P21/c空间群,是由完全质子化的L2-构成的紧密堆积的三维结构。每个最小不对称单元中由2个Cu(Ⅱ)离子(2Cu1)、2个完全质子化的L2-配体、1个游离的乙腈分子组成。图1(a)表明,配合物1中每个中心Cu(Ⅱ)离子与4个氧原子和1个氮原子配位,构成五配位的四方锥几何构型。其中4个氧原子来自于4个不同的L2-配体,氮原子则来自于L2-配体上的吡啶环。对称代码为:#1:-x, -0.5+y, 0.5-z; #2:-x, 1-y, -z; #3:x, 1.5-y, -0.5+z:#4:-1+x,1.5-y,-0.5+z; #5:1-x,-0.5+y, 0.5-z。在配合物1中,Cu—O键长在1.957 9(15)~1.982 9(16) Å之间, O—Cu—O键角在89.56°(8)~89.74°(8)之间,见表2。
配合物1中L2-配体上的羧基氧原子均以双齿桥连配位连接2个金属Cu(Ⅱ)离子,配位模式为(η2μ2χ2)。如图1(b)所示,2个Cu1(Ⅱ)离子通过4个L2-配体的羧基连接构成一个双核轮桨的次级构筑单元[Cu2(COO)4]SBU。双核轮桨次级构筑单元[Cu2(COO)4]由L2-刚性配体连接延伸形成3D框架,见图1(c)结构[15]。对晶体结构进行拓扑简化更加清楚地了解配合物1的微观结构。拓扑简化结果表明,[Cu2(COO)4]次级构筑单元可以简化为六连接的节点,L2-配体则可以被看作三连接的节点。所以配合物1的3D结构可以被简化成二节点的(6,3)连接的rtl拓扑网络结构,见图1(d),它的拓扑符号为(42.610.83)。

(a) 配合物1的中心金属Cu(Ⅱ)离子配位环境图
2.1.2 {[Cu(HL)2]}n(2)的结构分析
单晶X射线数据解析表明配合物2是一例基于2D层状结构由氢键连接而成的3D密堆积结构,其具有单斜晶系,P21/c空间群。配合物2的每个独立单元由1个Cu(Ⅱ)离子,2个部分质子化的HL-1配体组成,见图2(a)。结构中的中心金属Cu(Ⅱ)离子采用四配位的配位模式,形成四面体几何构型,四面体的顶点是2个氧原子和2个氮原子,与中心金属Cu(Ⅱ)离子配位的氧原子来自于2个不同的HL-1配体,氮原子来自于配体上的吡啶环。对称代码为#1:-x, 0.5+y, 0.5-z; #2:x, 0.5-y, 0.5+z; #3:-x,1-y,1-z。在配合物2中,Cu—O键长在1.961 7(14)~1.961 8(14) Å之间,O—Cu—N的键角在88.45°(7)~91.56°(7)之间,见表3。如图2(b)所示,HL-1配体中的羧基氧原子均以单齿桥连的配位模式(η1μ1χ1)连接Cu(Ⅱ)离子形成2D层状结构。由于配合物2中存在大量羧基未脱去氢原子,在配合物2的结构中存在层与层之间的氢键,见图2(c)。O3-H…O4将2D层状结构连接成3D结构[16],见图2(d)。对其2D层状结构进行拓扑简化可知,中心金属Cu(Ⅱ)离子被看作四节点的连接点,而HL-1配体则被简化为一条直线,所以,配合物2被简化为单节点四连接的拥有sql拓扑类型的结构,拓扑符号为(44.62),见图2(e)。

(a) 配合物2的中心金属Cu(Ⅱ)离子的配位环境图
2.2 配合物1和2结构多样性分析
在合成过程中,反应温度、金属离子、溶剂体系、升降温速率和溶液pH值等对配合物的合成具有很大影响。本文使用相同的溶剂体系、不同的pH值来充当配合物中的变量,成功合成了2例结构性质不同的配合物。在配合物1和2的合成过程中,在1中加入了0.1 mL的浓度为 1 mol/ L的NaOH。实验中除了溶液pH值不同外,其他反应条件均相同,这一反应可以明确地表明溶液pH值对晶体结构的影响。显然,高pH值有利于配体脱去质子,参与配位[17]。在配合物1中配体上的2个羧酸均脱质子,金属离子与其采取五配位的四方锥几何构型形成了高维的三维结构;在配合物2中配体上的羧酸部分脱质子,金属离子与其采取四配位四面体几何构型形成了低维的二维结构。
2.3 热重分析
为了分析配合物1和2晶体结构的热稳定性,在N2惰性气体的保护下以10 ℃/min的升温速率进行热失重分析实验(TGA),结果如图3所示。
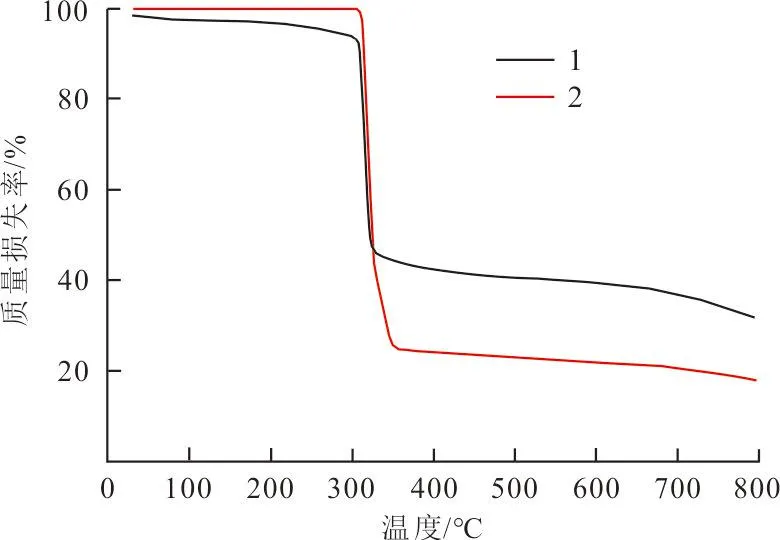
图 3 配合物的热重曲线图Fig.3 TG curve of the compounds
从图3可以看出:配合物1从80~330 ℃连续发生2次失重。随着温度的增加,当温度达到80~90 ℃时配合物1表现出第1次失重,质量损失率约为6.45%.通过分析配合物的晶体结构可知第一步失去的是结构中的乙腈分子[18],乙腈分子在配合物1中所占的比率是6.3%。随着温度的进一步升高,当温度超过320 ℃时,配合物表现出第2次失重,这是由于配合物1主体骨架的坍塌,才发生较大的失重。由于实验测试仪器的误差,实验值与理论值存在些许偏差,但数据基本吻合。
配合物2随着温度的升高,在0~300 ℃阶段保持着较好的框架稳定性。当温度超过300 ℃时,配合物2的骨架开始出现较快的坍塌。当温度升高到430 ℃左右时配合物1和2的晶体结构完全破坏,加热后剩余的物质可能是碳化物或金属氧化物[19]。
2.4 红外光谱分析
分别取2种晶体1~3 mg与160 mg左右干燥纯净的KBr晶体混合后放入玛瑙研钵中研磨成1.5~2.5 mg的细粉,将研磨好的细粉放进洁净的压片机中,在压片机25 MPa的压力下压制3~5 min,压成透明薄片。再将压制好的薄片放入红外光谱仪中,设置频率范围为4 000~500 cm-1,得到红外光谱图,见图4。重点观察3 500~1 000 cm-1区域的特征峰变化。
(a) 配合物1

2.5 配合物1和2的粉末衍射测试及其水稳定性
为了检验合成样品的纯度,用粉末衍射实验PXRD对配合物1和2进行测试,结果如图5(a)所示。可以看出:实验图谱与单晶数据拟合的图谱的出峰位置一致,说明得到的样品是较纯的单相,为后续配合物1和2的实际应用提供了保障。为了检验合成样品的水稳定性,将配合物2在水中浸泡24 h后过滤,再次进行粉末衍射实验,结果如图5(b)所示。可以看出:浸泡过后的PXRD图谱与未处理样品的图谱一致,说明合成的配合物具有良好的水稳定性。同时,为了检查配合物2的可重复利用性,在配合物2染料吸附实验后,对样品再次进行PXRD实验。可以看出:实验后的峰值与之前样品峰完全一致,证明配合物2具有良好的可重复利用性。

(a) 配合物1
2.6 配合物2对染料的吸附降解性
由于MOFs具有多样性的结构,被广泛用于染料吸附降解研究[23]。本文选择了3种不同电性的有机染料大分子:甲基橙(MO-)、孔雀石绿(MGO+)、罗丹明B(RhB+),测试配合物2降解3种有机染料的能力。实验中,分别将15 mg晶体浸泡在7 mL浓度为4×10-5mol /L的甲基橙、孔雀石绿、罗丹明B水溶液中,随着静置时间的不同观察溶液的颜色是否变化,并根据紫外/可见分光分度法(UV)检测有机染料的浓度变化,并对溶液浓度的变化进行定量分析,结果如图6所示。可以看出:3种溶液中,只有孔雀石绿水溶液的颜色出现了较为明显的变化,在90 min内,配合物2对孔雀石绿的吸收速率高达62 %,说明配合物2对水溶液中的阳离子型染料孔雀石绿(MGO+)表现出较好的降解能力,原因可能是由于配合物2能与孔雀石绿(MGO+)发生很强的静电作用[24]。

(a) 甲基橙
为进一步研究吸附动力学,采取以下模型来描述吸附过程:
准一级动力学模型:
ln(qe-qt)=lnqe-k1t
(1)
准二级动力学模型:
(2)
式中:qt为t时刻的吸附容量,mg/g;qe为平衡吸附容量;k1为一级吸附速率常数,min-1;k2为二级吸附速率常数,g/(mg·min)。
根据式(1)、(2),将实验中所得数据进行拟合,得到配合物2对孔雀石绿的准一级吸附动力学和准二级吸附动力学模型,见图7。由图7(a)可知:准一级动力学模型相关系数R2=0.965,高于准二级动力学相关系数R2=0.847,见图7(b),更接近于1。因此,准一级吸附动力学拟合曲线更符合配合物2对孔雀石绿降解的模型[25]。说明配合物2对孔雀石绿的降解过程为化学吸附[26]。
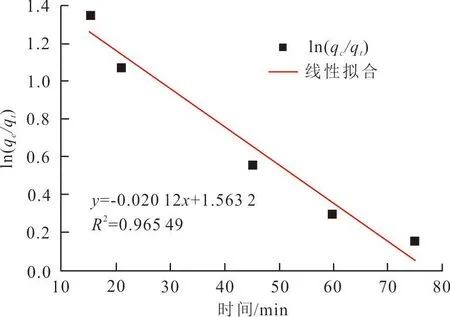
(a) 准一级动力学模型
3 结 论
1) 以6-(吡啶-3′-基)间苯二甲酸(H2L)在不同的溶剂体系中合成了2例不同结构的配位聚合物{[Cu2(L)2·C2H3N]}n(1)和{[Cu(HL)2]}n(2)。晶体结构分析表明,由于配合物1和2中H2L的质子化程度不同,配体上的羧基氧原子采取了不同的配位模式,配合物1中心Cu(Ⅱ)离子采取五配位四方锥几何构型,而配合物2中金属Cu(Ⅱ)离子是四配位四面体几何构型。
2) 在其他条件相同的情况下,溶液pH值大小是造成H2L不同质子化的原因,配合物1在高pH值溶液中完全质子化,配合物2在较低pH值溶液中部分质子化。由于配合物2部分质子化,存在于层与层之间的氢键[O3-H…O4]将二维层状网络结构连接形成高维结构。
3) 配合物2对水溶液中的孔雀石绿有良好的降解能力。动力学拟合表明,其过程更加符合准一级吸附动力学模型。
4) 合成的高效降解染料的材料可应用于染整工业中的污水处理。

