半抗原直接包被的四环素酶联免疫吸附分析法的建立
张玉超,刘良禹,朱思洁,刘旭东*
(1.茅台学院酿酒工程系,贵州仁怀 564507;2.中国海洋大学食品科学与工程学院,山东青岛 266071;3.茅台学院食品科学与工程系,贵州仁怀 564507;4.贵州特色食品开发及综合利用工程研究中心,贵州仁怀 564507)
四环素类(tetracyclines,TCs)抗生素主要包括四环素(tetracycline,TC)、金霉素(chlortetracycline,CTC)、土霉素(oxytetracycline,OTC)、环霉素(cyclamicin,DC)等类型,作为一种常见的广谱类抗生素,TCs 常被应用于人畜的各类疾病治疗,也被加入饲料用于促进动物生长[1]。TCs 在全球不同地区均有广泛使用,在欧盟国家每年使用的抗生素中TCs 占有一半的份额;在美国TCs 也占据了抗生素市场1/5 左右的份额;我国是抗生素生成和使用的大国,每年TCs 的使用量可达6 000 t[2]。TCs 可以通过生产到消费的各环节进入环境水样、土壤、动物源性食品中,残留的抗生素会导致耐药基因的产生、改变微生物生态环境;同时由于食物链积累,也会对人体造成不可预计的危害[3⁃4]。因此欧盟标准委员会、美国食品与药品管理局及我国农业部对于TCs 的残留量都作了一定的限制。以我国动物性食品中兽药最高残留限量(农业部235 号公告)规定为例,TCs 在动物奶、肌肉、肝脏、肾脏的残留限量分别为100µg/L、100、300、600µg/kg[5⁃6]。因此,建立TCs 的检测方法尤为重要。
目前对于TCs 的检测方法主要有微生物法、仪器分析法、免疫分析法。微生物法可大批量的进行样本筛查,但耗时长、灵敏度低;仪器分析法准确性好,但样品前处理复杂、设备昂贵、需要专业人员进行操作,并且难以做到高通量筛查[7⁃8]。免疫分析法利用抗原⁃抗体特异性反应为基础,很好地弥补了其它两种方法的不足,其中以酶联免疫吸附分析法(enzyme⁃linked im⁃munosorbent assay,ELISA)为主导[9]。虽然对于TCs 的ELISA 检测方法已有报道,但相关研究多采用TCs 多克隆抗体(polyclonal antibody,PAb)为检测抗体,采用人工抗原作为包被抗原,通过疏水相互作用与酶标板结合[10⁃11]。PAb 的均一性差、特异性较低;疏水相互作用可引起人工包被抗原的构象改变,进而影响半抗原的呈现和识别,这些均会导致检测灵敏度下降、标准化难度增大[12⁃13]。因此建立均一性好、特异性高的TCs ELISA 检测方法非常必要。
以TCs 最主要类型TC 为研究对象,制备TC 人工完全抗原,免疫BALB/c 小鼠,进而制备抗TC 的单克隆抗体(monoclonal antibody,MAb),并采用酸性高锰酸钾羧化酶标板,将TC 直接包被在酶标板上,并对ELISA 反应体系条件进行优化,构建一种半抗原直接包被的TC ELISA 检测方法,以期为TC 的检测提供参考。
1 材料与方法
1.1 材料与试剂
无特定病原体(specific pathogen free,SPF)级6~8 周龄雌性BALB/c 小鼠:湖北省疾病预防控制中心实验动物中心;SP2/0 细胞:武汉大学保藏中心。
TC、CTC、OTC、DC 标准品(纯度≥98%)、血清蛋白(bovine serum albumin,BSA)、卵清蛋白(ovalbumin,OVA)、福氏完全佐剂(freund′s complete adjuvant,FCA)、福氏不完全佐剂(freund′s incomplete adjuvant,FICA):美国Sigma⁃Aldrich 公司;二氧六环、HCl、NaNO2、H2SO4、明胶:国药集团化学试剂有限公司;脱脂奶粉:市售。0.01 mol/L pH7.4 磷酸盐缓冲液(phosphate buff⁃ered saline,PBS):南京建成生物工程研究所。其他试剂均为分析纯。
DMEM(dulbecco′s modified eagle medium)培养基、HAT(hypoxanthine⁃aminopterin⁃thymidine medium)培养基、HT(hypoxanthine ⁃thymidine medium)培养基:美国Thermo 公司。
环境水样随机取自遵义市3 条河流近岸处;检验合格的牛奶、鸡肉样品:市售;未经合格检验牛奶、鸡肉样品取自遵义市某养殖场。
1.2 仪器与设备
S⁃3100 紫外分光光度计:韩国Scinco 公司;ELX800 全波长酶标仪:美国Bio⁃tek 公司;5415R 低温冷冻离心机:德国Eppendorf 公司;Forma 311 型CO2恒温培养箱:美国Thermo 公司;TS2 型倒置显微镜:日本Nikon 公司。
1.3 方法
1.3.1 ELISA 检测相关试剂配制
利用1.1 中的PBS 溶液配制1%的BSA 溶液作为抗体稀释液,配制0.05%的吐温⁃20 溶液作为洗涤液;利用蒸馏水配制1%BSA、1%OVA、1%明胶、3%脱脂奶粉溶液作为封闭剂;配制2 mol/L H2SO4作为终止液。
1.3.2 TC 完全抗原的合成
TC 结构中含有活性-NH2,可直接作为半抗原,利用TC 结构中的-NH2将TC 与载体蛋白(BSA、OVA)连接即可形成大分子完全抗原。取444 mg TC 加入10 mL 二氧六环中,混合均匀后滴加10 mL 1mol/L HCl,待放热完全冷却后滴加1 mL 7%的NaNO2溶液,室温搅拌反应30 min,得溶液A;取0.2 mol/L pH9 的硼酸盐缓冲液50 mL,加入300 mg BSA/OVA 制备蛋白质溶液,得溶液B;将溶液B 加入溶液A 中,继续搅拌反应3 h 后,将反应液6 000 r/min 离心5 min,将上清液置于透析袋中,于PBS(pH7.4,0.01 mol/L)中4 ℃透析72 h,每隔12 h 换液[14]。对所得的人工完全抗原(TC⁃BSA、TC⁃OVA)进行紫外扫描,对蛋白质含量进行测定。
1.3.3 动物免疫
取人工完全抗原100µg,溶于100µL PBS(pH7.4,0.01 mol/L)中,混合均匀后,加入等体积的FCA/FICA,混合均匀供免疫使用,参考文献[15⁃16]对小鼠进行多次颈背部皮下注射免疫。
1.3.4 抗血清效价和灵敏度的测定
免疫周期完成7 d 后,对小鼠断尾取血,离心取抗血清,采用间接ELISA 对抗血清效价进行测定,采用间接竞争ELISA 对抗血清灵敏度进行测定[17],选择抗血清效价和灵敏度最高的小鼠作为脾细胞供体进行杂交瘤细胞制备。
1.3.5 杂交瘤细胞的筛选及MAb 的制备
对小鼠进行200 µg 的人工完全抗原腹腔注射免疫,3 d 后无菌条件下取小鼠脾细胞,利用聚乙二醇促进脾细胞与SP2/0 细胞融合,融合后对融合细胞进行HAT 培养基培养,随后进行特异性筛选,选取特异性最好的细胞孔进行有限稀释,再采用HT 培养基进行克隆化,待阳性率达100%后用DMEM 培养基扩大培养建立细胞株。收集长势良好的杂交瘤细胞注射进入小鼠腹腔,12 d 后无菌操作收集小鼠腹水,对腹水进行辛酸⁃硫酸铵法纯化[17⁃18]。
1.3.6 TC 的包被
向酶标板的孔中加入150 µL 5% 酸性KMnO4溶液,60 ℃放置1 h,对酶标板进行羧化;弃去孔内溶液,加入200 µL 6 mol/L HCl,室温振荡清洗酶标板5 min,重复3 次;最后再用纯水洗板3 次;将TC 标准品用蒸馏水稀释到一定浓度,每孔100 µL 4 ℃包被过夜[19]。
1.3.7 包被原的浓度和抗体稀释倍数的确定
分别将浓度为1.000、0.500、0.250、0.125µg/mL 的TC 标准品溶液加入羧化后的酶标板中包被过夜。将MAb 用抗体稀释液分别稀释8 000、16 000、32 000、64 000、128 000、256 000、512 000 倍,进行方阵滴定[20]。选取OD450值为1 左右的组合进行灵敏度测定[17],选取IC50值最小的组合为最佳组合。
1.3.8 ELISA 反应条件优化
在包被原浓度和抗体稀释比已确定的条件下,对TC 检测ELISA 竞争反应体系其他主要影响因素[反应体系温度(4、25、30、35、40 ℃)、反应体系pH 值(6.4、7.4、8.4、9.4)、反应体系封闭剂种类(1% BSA、1%OVA、1% 明胶、3% 脱脂奶粉)]进行优化,选取IC50值最小的条件作为TC 检测ELISA 竞争反应体系的最佳条件。采用相同方法确定人工完全抗原包被ELISA竞争反应体系条件[17]。
1.3.9 ELISA 检测TC 标准曲线的建立
将TC 标准品稀释至0.5、1.0、2.5、5.0、10.0、25.0、50.0 ng/mL,采用构建的半抗原包被和人工完全抗原包被的竞争反应体系与TC MAb 进行竞争反应,以竞争反应抑制率为纵坐标,lg(10×TC 标准溶液浓度)为横坐标,建立标准曲线。
1.3.10 交叉反应率的测定
利用TC 结构类似物CTC、OTC、DC 标准品与TC MAb 进行半抗原包被的竞争反应,进行IC50值的测定,交叉反应率(R,%)的计算公式如下。
R=(A/B)× 100
式中:A为TC 与TC MAb 进行竞争反应的IC50值,ng/mL;B为TC 结构类似物与TC MAb 进行竞争反应的IC50值,ng/mL。
1.3.11 加标回收率的测定
制作TC 含量为2.5、5.0、10.0、25.0、50.0、100.0 ng/mL的加标水样,利用已构建的半抗原包被和人工完全抗原包被的ELISA 检测方法测定加标样品中TC 含量;将牛奶样品8 000 r/min 离心10 min,去除上层脂肪层,再利用PBS 稀释5 倍,消除基质干扰后再添加TC[21],制备TC 含量为2.5、5.0、10.0、25.0、50.0、100.0 ng/mL 的加标牛奶样品,用已构建的半抗原包被和人工完全抗原包被的ELISA 检测方法测定加标样品中TC 含量,加标回收率(M,%)的计算公式如下。
M=C1/C2× 100
式中:C1为TC 的检测浓度,ng/mL;C2为TC 的加标浓度,ng/mL。
1.3.12 实际样品中TC 含量的测定
选择不同环境水样,检验合格的市售不同品牌牛奶、鸡肉样品,未经合格检验的牛奶、鸡肉样品;牛奶样品的前处理按照1.3.10 进行,鸡肉样品前处理参照文献[22]进行,对所有样品按所建立的半抗原包被的ELISA 法进行TC 含量的检测。
1.4 统计分析
采用单因素方差分析结合Duncan 检验分析差异性,差异显著水平为P<0.05,数据统计图使用Graph⁃Pad Prism 8.0 生成。
2 结果与分析
2.1 TC 人工完全抗原紫外扫描鉴定
TC、BSA、OVA、TC⁃BSA、TC⁃OVA 紫外扫描图见图1。
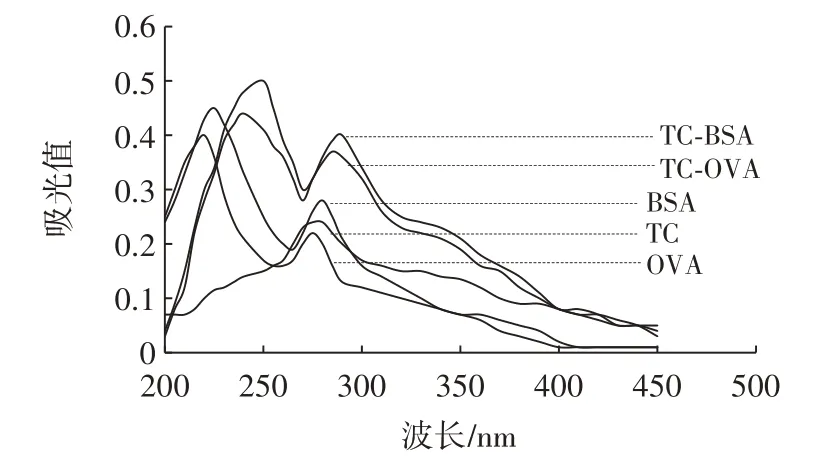
图1 TC、BSA、OVA、TC⁃BSA、TC⁃OVA 紫外扫描图Fig.1 Ultraviolet absorbance spectra of TC,BSA,OVA,TC⁃BSA and TC⁃OVA
由图1 可知,TC 的最大吸收峰位于275 nm 处,BSA 在225 nm 和280 nm 处有特征吸收峰,TC⁃BSA 的特征吸收峰处于240 nm 和285 nm 处,可见TC⁃BSA同时具有了TC 和BSA 类似的光吸收特性,同时最大吸收峰又有一定的偏移,出现了一定自身特性;OVA 在220 nm 和275 nm 处有特征吸收峰,TC⁃OVA 的特征吸收峰处于235 nm 和285 nm 处,偶联情况与TC⁃BSA 类似,因此可判断TC 与BSA、OVA 偶联成功。
2.2 TC 抗血清效价和灵敏度的测定结果
不同小鼠抗血清效价和灵敏度见表1。
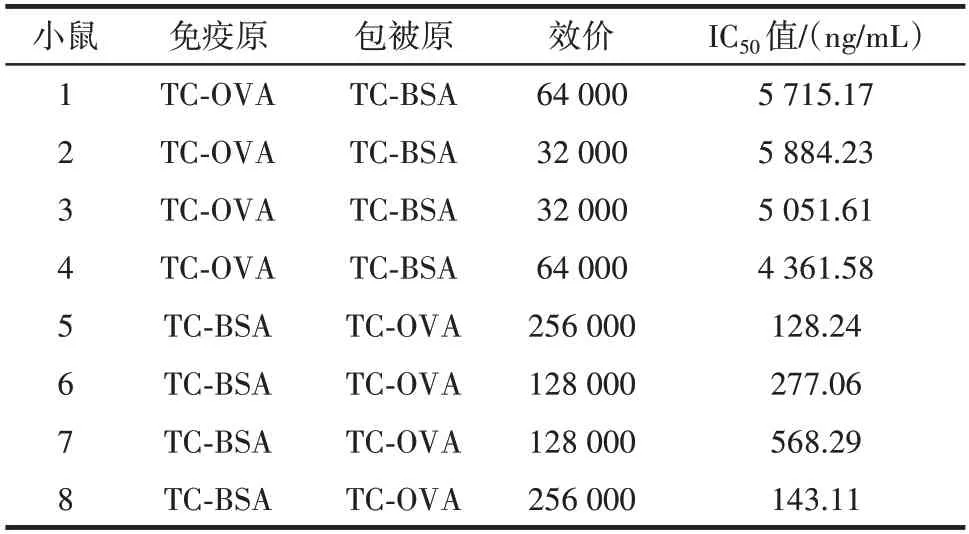
表1 TC 抗血清效价及灵敏度Table 1 Titers and sensitivity of antisera
由表1 可知,免疫周期完成后各只小鼠均产生了对TC 有一定特异性的抗血清,且以TC⁃BSA 作为免疫原、TC⁃OVA 作为包被原时,抗血清的效价和灵敏度普遍优于TC⁃OVA 作为免疫原、TC⁃BSA 作为包被原的情况。其中5 号小鼠的TC 抗血清效价可达256 000,IC50值为128.24 ng/mL,相比于其它小鼠,该小鼠TC 抗血清的效价和灵敏度均为最优,因此选择该小鼠的脾细胞制备杂交瘤细胞。
2.3 杂交瘤细胞的选择
通过初步筛选,选择5 株阳性杂交瘤细胞(1D3、4C11、5H9、6B11、8A10)进行ELISA 竞争反应,结果见图2。
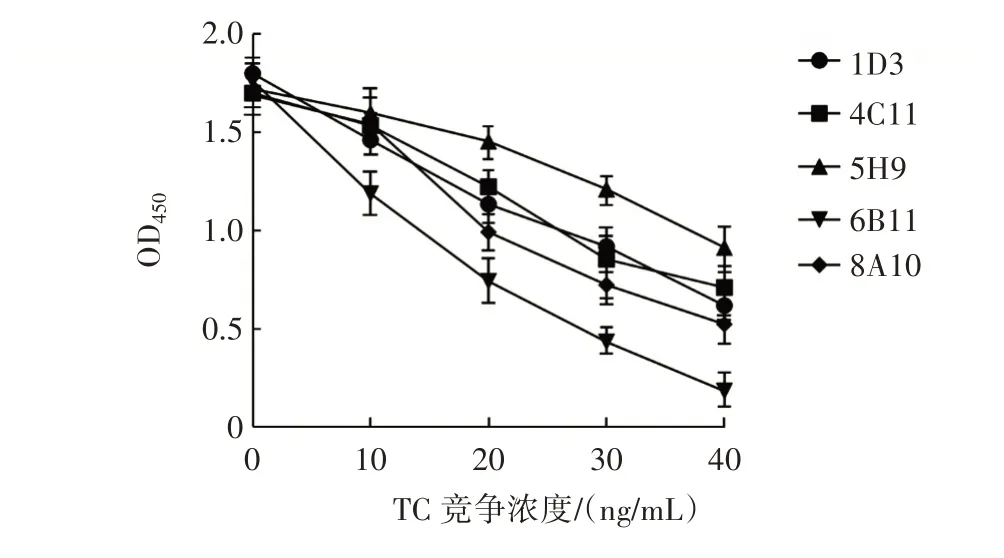
图2 杂交瘤细胞竞争反应显色变化Fig.2 Color changes in competitive reaction of hybridoma cells
由图2 可知,随TC 竞争浓度的不断提高,6B11 细胞株的OD450显色下降变化最为明显,说明该细胞株产生的MAb 对TC 的特异性最高。所以选择该细胞株进行扩大培养后用于小鼠腹水的制备。
2.4 包被原浓度和抗体稀释倍数筛选
通过方阵滴定选择出的包被原浓度和抗体稀释倍数组合分别为0.125µg/mL、64 000,0.25µg/mL、128 000,0.250µg/mL、256 000,0.500µg/mL、128 000,1.000µg/mL、128 000,1.000µg/mL、256 000。以上述6 个组合作为待筛选的组合进行ELISA 竞争反应,测定各组合条件下的IC50。包被原浓度和抗体稀释倍数筛选结果见图3。
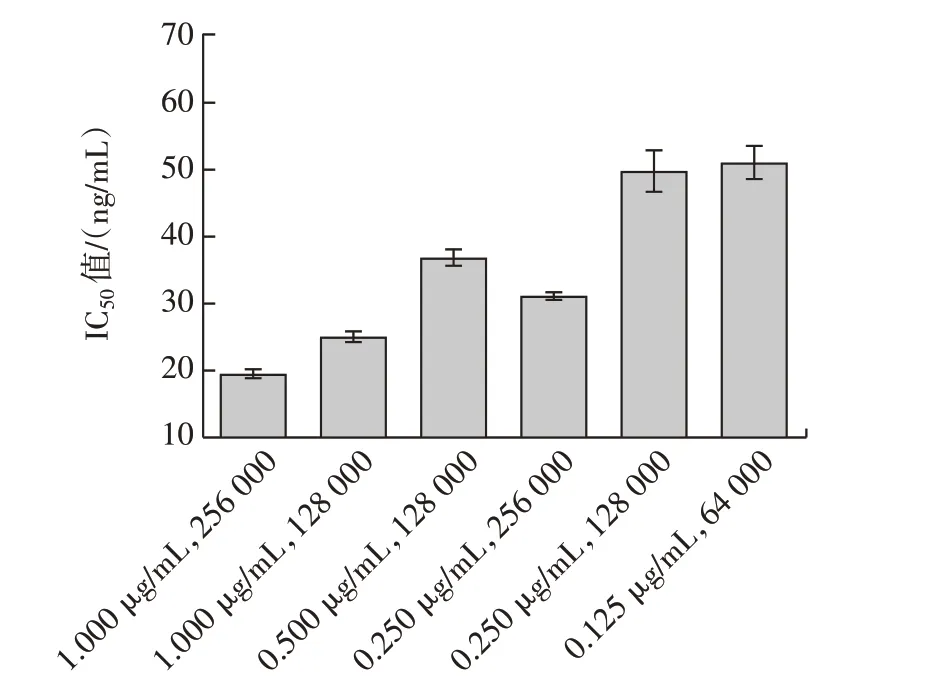
图3 包被原浓度和抗体稀释倍数筛选Fig.3 Screening of hapten coating concentration and antibody di⁃lution ratio
由图3 可知,在半抗原包被浓度为1.000 µg/mL,抗体稀释比256 000 时进行ELISA 竞争反应的IC50值最低,说明在此组合条件下的ELISA 反应体系灵敏度最高,因此选择该组合条件作为竞争反应体系的最适包被原浓度和抗体稀释倍数。
2.5 竞争反应体系条件优化
竞争反应体系最适反应温度、pH 值、封闭剂的筛选结果见图4、图5、图6。
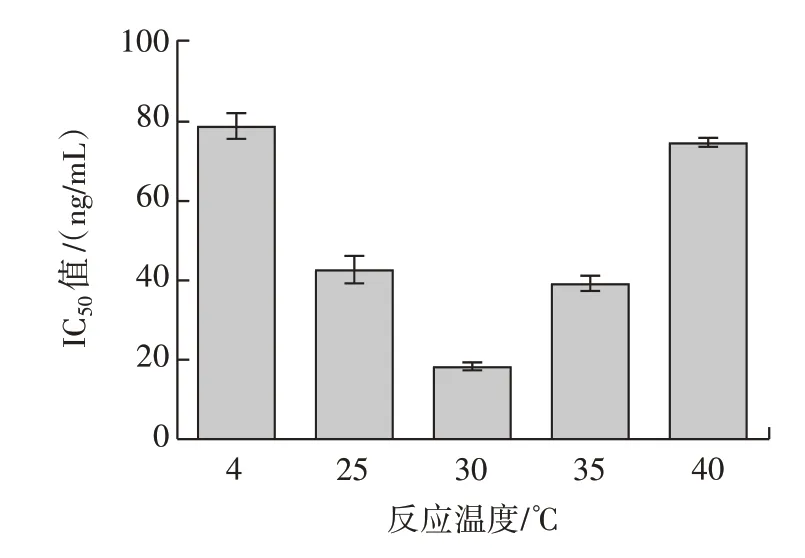
图4 最适反应温度筛选Fig.4 Screening of optimum reaction temperature
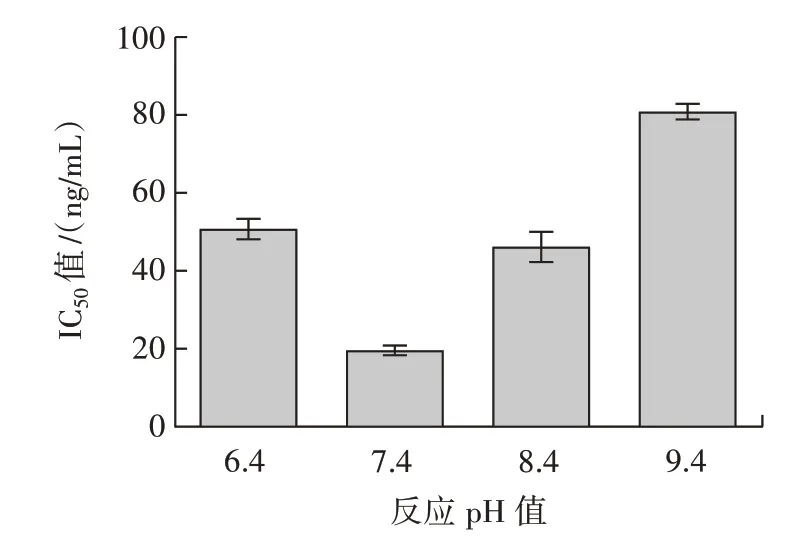
图5 最适反应pH 值筛选Fig.5 Screening of optimum reaction pH
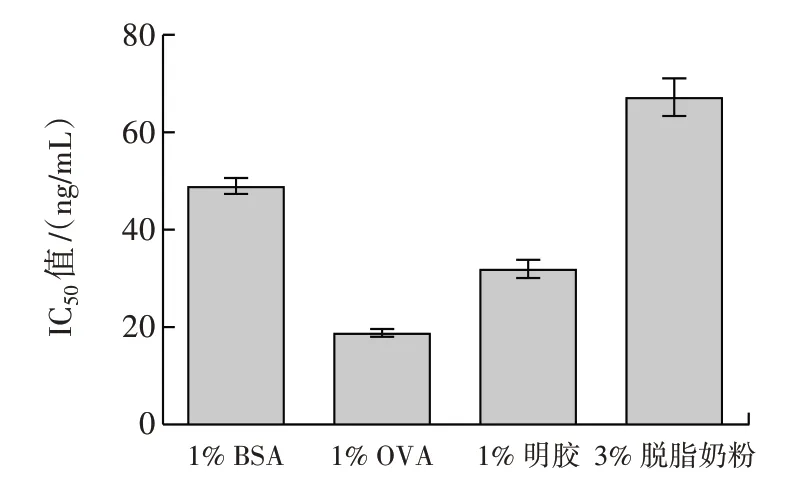
图6 最适反应封闭剂筛选Fig.6 Screening of optimum reaction blocking agents
由图4 可知,当竞争反应温度为30 ℃时进行反应体系的IC50值最低,说明在此反应温度下竞争反应体系灵敏度最高,因此选择30 ℃作为竞争反应体系的最佳反应温度。同理可得,pH7.4、1% OVA 溶液作为封闭剂为竞争反应体系最适pH 值及最优封闭剂(图5、图6)。因此综合以上试验结果可知,半抗原包被的竞争反应体系条件为包被原浓度1.000µg/mL、抗体稀释倍数256 000、竞争反应温度为30 ℃、pH7.4、以1%OVA 溶液作为封闭剂。
人工完全抗原包被构建竞争反应体系可能会存在导致检测灵敏度下降的可能。因此,为了对比TC 半抗原直接包被与TC 人工完全抗原包被对检测灵敏度的影响,本文利用所制备的TC MAb,采用同样的竞争反应体系构建方法,确定TC 人工完全抗原TC⁃OVA包被的竞争反应体系条件为人工完全抗原包被浓度为1.000µg/mL、抗体稀释倍数256 000、竞争反应体系温度25 ℃、pH7.4、以3%脱脂奶粉溶液作为封闭剂。
2.6 竞争反应体系标准曲线的构建
按照2.5 中所构建的半抗原包被和人工完全抗原包被的竞争反应体系,利用不同浓度TC 标准品与TC MAb 进行竞争反应构建标准曲线,结果见表2。
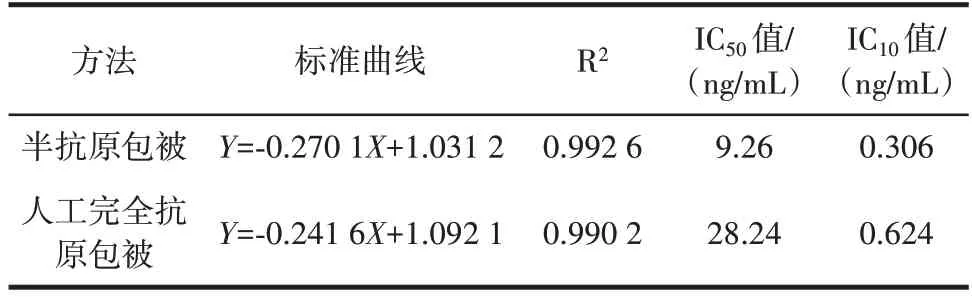
表2 竞争反应标准曲线Table 2 Standard curve of competitive reaction
由表2 可知,两种竞争反应体系均显示出了良好的线性效果,半抗原包被和人工完全抗原包被的竞争反应体系IC50值分别为9.26、28.24 ng/mL,检测下限IC10值分别为0.306、0.624 ng/mL。在TC ELISA 检测方法构建研究中,虽然利用TC 直接进行包被的研究还鲜有报道,但是在其它小分子化合物的检测研究中,采用半抗原直接包被构建竞争反应体系可以提高竞争反应灵敏度的情况已被逐渐证实[13,15,23⁃24]。本研究的结果同样表明,在检测抗体完全相同的情况下,TC 包被的竞争反应体系与TC⁃OVA 包被的竞争反应体系相比检测灵敏度有了明显的提高。
2.7 TC 结构类似物交叉反应率测定
按照2.5 中所构建的半抗原包被竞争反应体系,利用CTC、OTC、DC 标准品代替TC 标准品进行竞争反应,测定交叉反应率,结果见表3。
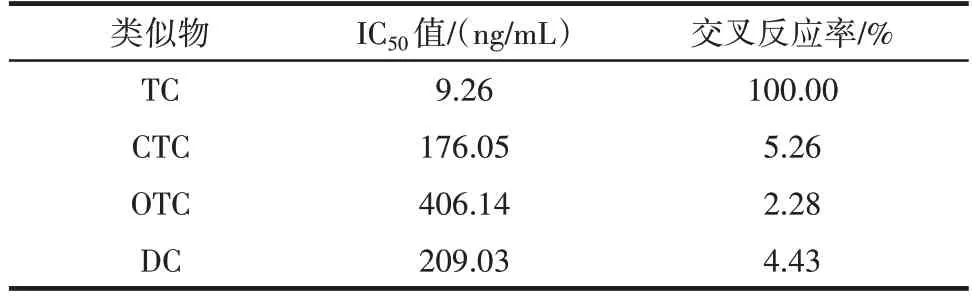
表3 交叉反应率测定Table 3 Cross⁃reaction rate
由表3 可知,所制备的TC MAb 与3 种TC 结构类似物的交叉反应率均较小,说明本研究所制备的MAb对TC 特异性良好。
2.8 水和牛奶中加标回收率测定
TC 残留问题常出现在环境水样和动物源食品中,因此本文选择水和牛奶进行TC 加标回收率测定,结果见表4 和表5。
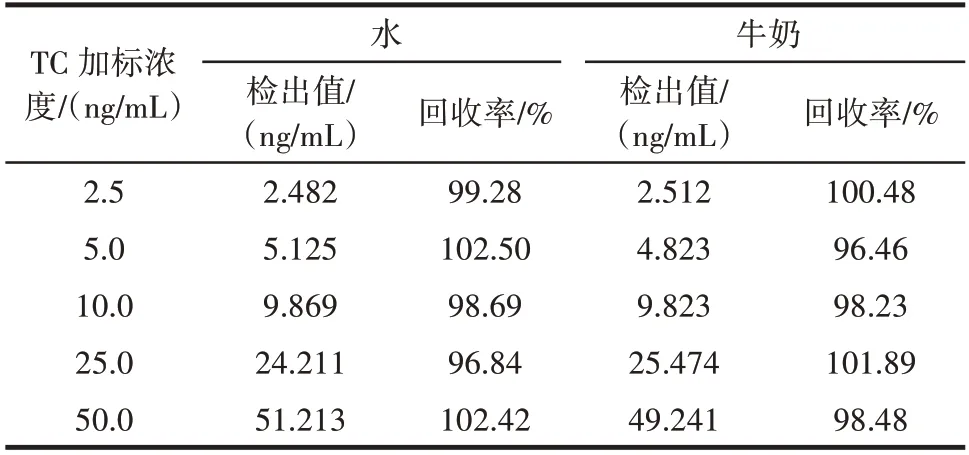
表4 水和牛奶中加标回收率(半抗原包被)Table 4 Recovery of tetracycline in water and milk(hapten coated)
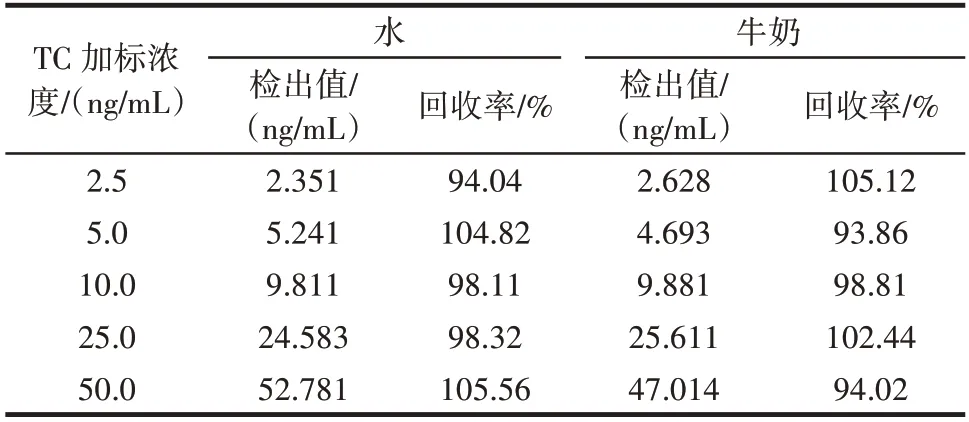
表5 水和牛奶中加标回收率(人工完全抗原包被)Table 5 Recovery of tetracycline in water and milk(artificial complete antigen coated)
由表4 和表5 可知,半抗原包被竞争反应体系水中TC 加标回收率范围为96.84%~102.50%,牛奶中TC加标回收率范围为96.46%~101.89%。人工完全抗原包被竞争反应体系水中TC 加标回收率范围为94.04%~105.56%,牛奶中TC 加标回收率范围为93.86%~105.12%。结果表明,半抗原包被竞争反应体系加标回收率范围窄于人工完全抗原包被竞争反应体系,说明TC 包被的竞争反应体系检测灵敏度高于TC⁃OVA 包被的竞争反应体系。
2.9 实际样品中TC 含量检测
利用构建的半抗原竞争反应体系对环境水样、牛奶、鸡肉中TC 含量进行检测,结果见表6。
由表6 可知,环境水样样品3、未检验牛奶样品1和未检验鸡肉样品3 中有TC 检出,其它样品均未检出TC,说明本方法可以用于实际样品中TC 的检测。
3 结论
为建立一种基于MAb 的半抗原直接包被的TC ELISA 检测方法,本研究合成TC 完全人工抗原,并制备抗TC 的MAb,该MAb 对TC 特异性良好,与TC 结构类似物交叉反应率低;并将TC 直接包被于修饰后的酶标板上,进行半抗原的直接包被,对ELISA 检测体系反应温度、pH 值、封闭剂种类进行优化,建立的竞争反应体系条件为半抗原包被浓度为1.000µg/mL,抗体稀释比256 000,竞争反应体系温度为30 ℃,pH7.4,以1%OVA 溶液作为封闭剂。该检测方法最低检测限IC10值为0.306 ng/mL,半数抑制率IC50值为9.26 ng/mL,牛奶和水中加标回收率分别为96.46%~101.89%、96.84%~102.50%。与同等条件下建立的人工抗原包被的检测方法(IC10值:0.624 ng/mL,IC50值:28.24 ng/mL,牛奶和水中加标回收率分别为93.86%~105.12%、94.04%~105.56%)相比,检测灵敏度有明显的提高,并可用于实际样品中TC 含量的检测。

