食品中黄曲霉毒素M1的间接竞争酶联免疫法的建立
侯悦,陈瑞鹏,芦然,高志贤,周焕英*,杨仕平
(1.上海师范大学化学与材料科学学院,上海 200000;2.军事科学院军事医学研究院环境医学与作业医学研究所,天津 300050)
霉菌毒素作为霉菌的次级代谢物,具有高毒性,常常污染食品和农产品[1⁃2]。霉菌毒素对人和动物的健康会产生严重影响[3⁃5],如免疫抑制、肾毒性、致畸性、致癌性和诱变作用[6⁃8]。黄曲霉毒素B1(aflatoxin B1,AFB1)被认为是毒性最强的霉菌毒素,黄曲霉毒素M1(aflatoxin M1,AFM1)是AFB1在动物体内经2 次反应产生的羟基化代谢物[9⁃10],对人体有致癌突变作用[11⁃12]。
欧盟食品和牛奶中AFM1的最大残留限量(maxi⁃mum residue limit,MRL)为50 ng/L[11,13]。我国对牛奶中AFM1的限量标准为不高于0.5 µg/kg。AFM1具有耐热特性,能够残留在灭菌牛奶和巴氏杀菌牛奶中[14⁃15]。除了牛奶,AFM1还能存在于其他食品中,包括各种乳制品[16⁃17]、婴儿配方奶粉食品(infant formula food,IFM)[18]、谷物基婴儿食品[19]、母乳[20⁃22]、鸡蛋和动物肉组织[23]。目前我国检测食品中AFM1的国家标准方法有液相色谱⁃串联质谱分析法、免疫亲和层析净化高效液相色谱分析法、免疫层析净化荧光分光光度分析法和双流向酶联免疫分析法等。
目前AFM1的高通量快速检测方法主要基于酶联免疫吸附(enzyme⁃linked immunosorbent assay,ELISA)方法,包括直接竞争酶联免疫吸附法(direct competi⁃tive enzyme⁃linked immunosorbent assay,dc⁃ELISA)、间接竞争酶联免疫吸附法(indirect competitive enzyme⁃linked immunosorbent assay,ic⁃ELISA)等。其中,ic⁃ELISA 方法操作复杂,整体试验耗时较长[24],但其检测灵敏度较高。国内外检测试剂盒检测AFM1的ELISA法多基于直接竞争原理,检测限往往为ng/mL 级别。目前,缺少基于间接竞争的AFM1检测方法研究,为填补空白,本研究建立一种基于间接竞争酶联免疫吸附检测AFM1的方法,通过优化试验条件,检出限可达pg/mL 级别,大大提高了检测灵敏度,本方法适用于食品中AFM1的现场高灵敏检测,对于保障食品安全具有重要意义。
1 材料与方法
1.1 材料与试剂
牛乳粉、玉米面、坚果棒:市售;AFM1标准物质:北京坛墨质检科技股份有限公司;AFM1单克隆抗体、羊抗小鼠辣根过氧化物酶标记二抗(immunoglobulin G horseradish peroxidase,IgG⁃HRP):北京艾旗斯德科技有限公司;磷酸盐缓冲液(phosphate buffer saline,PBS):美国海克隆实验室公司;牛血清白蛋白(bovine serum albumin,BSA)、蔗糖、三正丁胺、氯甲酸异丁酯(均为分析纯):上海源叶生物科技有限公司;单组分3,3′,5,5′⁃四甲基联苯胺(3,3′,5,5′⁃tetramethylbenzi⁃dine,TMB)显色液、吐温⁃20(96%):北京索莱宝科技有限公司;浓硫酸(分析纯):天津渤大硫酸工业有限公司;1,4⁃二氧六环(≥99.0%)、N,N⁃二甲基甲酰胺(N,N⁃dimethyl formamide,DMF)(色谱纯):上海麦克林生化科技有限公司;试验中所用水为超纯水。
主要试剂的配制如下。
PBST(phosphate buffered solution)洗涤液:0.05%吐温⁃20 溶解于PBS 缓冲液中。
碳酸盐缓冲液(carbonate buffer solution,CBS)包被液:称取Na2CO31.59 g、NaHCO32.93 g,用超纯水定容至1 000 mL。
抗体稀释液:1%BSA、5%蔗糖、0.05%吐温⁃20 溶解于PBS 缓冲液中。
终止液(2 mol/L H2SO4):10 mL 98% 浓硫酸加入60 mL 超纯水中,再定容至100 mL。
1.2 仪器与设备
AL240 电子天平:上海梅特勒⁃托利多有限公司;MS3 涡旋震荡仪:德国IKA 公司;MK3 酶标仪:美国赛默飞公司;96 孔酶标板:康宁公司;DHG⁃9245A 恒温培养箱:上海恒科仪器有限公司。
1.3 试验方法
1.3.1 AFM1全抗原的制备
采用琥珀酸酐法合成AFM1⁃BSA 免疫抗原。A 液:称取1.5 mg AFM1溶于100µL DMF 与1,4⁃二氧六环的溶液(体积比为1∶1)中,加入0.5µL 三正丁胺,冰浴下搅拌反应10 min;加入0.35µL 氯甲酸异丁酯,室温下搅拌1 h。B 液:将3 mg BSA 溶于100µL 50%DMF 溶液中。按起始摩尔比30∶1,将A 液加入B 液中,并保持pH 值为8.5,冰浴下搅拌反应4 h;取出于0.01 mol/L、pH7.4 的PBS 中4 ℃透析3 d,每天更换4 次透析液,样品取出后冻干,于-20 ℃保存备用。
1.3.2 ic⁃ELISA 检测方法
1)包被:用CBS 包被液按一定比例稀释AFM1全抗原,每孔100µL 置于96 孔酶标板中,将包被稀释液加入空白孔中,然后将其置于4 ℃包被12 h。
2)洗涤:取出涂有AFM1全抗原的酶标板,一次性用力摇出孔中的液体,在方巾纸上拍打数次,注意避免孔内液体因串孔导致的样品污染,拍完后快速将96 孔酶标板翻转过来,向每孔中加入220µL PBST 洗涤液,计时3 min,清洗3 次。
3)封闭:每孔加入150 µL 封闭溶液,溶剂为PBS缓冲液,该封闭液需要现配现用,37 ℃孵育1 h。
4)洗涤:向酶标板的样品孔内加220 µL PBST 洗涤液,计时3 min,清洗3 次,具体操作与(2)相同。
5)加入单抗:用抗体稀释液按照一定比例稀释AFM1单克隆抗体后,每孔加入100µL,在37 ℃下孵育1 h,并向阴性对照和空白对照孔中加入100 µL 抗体稀释液。
6)洗涤:向酶标板的样品孔内加220 µL PBST 洗涤液,计时3 min,清洗3 次,具体操作与(2)相同。
7)加入二抗:将IgG⁃HRP 二抗用抗体稀释液稀释一定比例后,每孔加入100 µL,37 ℃下孵育1 h,向空白孔中加入100µL 抗体稀释液。
8)洗涤:向酶标板的样品孔内加220 µL PBST 洗涤液,计时3 min,清洗3 次,具体操作与(2)相同。
9)TMB 显色:向每孔内加入单组分TMB 显色液100µL,37 ℃下孵育显色。
10)终止:样品孔内每孔加50µL 2 mol/L 浓硫酸,以停止显色。加入浓硫酸后可通过肉眼发现孔内溶液由蓝变黄。
11)检测:利用酶标仪在波长450 nm 处进行检测。
1.3.3 试验条件的优化
在ic⁃ELISA 试验中,目标物全抗原及单抗的浓度、包被温度及时间、封闭溶液的种类、二抗IgG⁃HRP 的浓度、TMB 孵育时间等均会不同程度改变体系灵敏度,从而改变体系的检测范围、检测限[25]。本研究通过阳性值、阴性对照和空白对照等参数结果选择最适条件。
1.3.3.1 AFM1全抗原和AFM1单克隆抗体浓度的优化
使用棋盘法对AFM1全抗原和AFM1单克隆抗体稀释比例进行优化,其中AFM1全抗原包被浓度按照1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000、1∶256 000 倍稀释。AFM1单抗按照同样比例稀释,其余步骤同1.3.2,观察不同稀释比例的全抗原和单抗对吸光度OD 值的影响,优化出最佳全抗原、单抗的稀释比例。阴性对照不加单抗,空白对照不加单抗和IgG⁃HRP。
1.3.3.2 包被条件的优化
在CBS 包被液稀释抗原的条件下,抗原因为含有正电荷易于附在酶标板上[26]。为确定最佳包被条件,将其在4 ℃冰箱中包被12 h,并在37 ℃的恒温培养箱中包被1 h 或2 h。根据最大P/N值确定最佳的包被条件,其中,P为阳性值,N为阴性值。
1.3.3.3 最佳封闭液的优化
封闭液会影响检测环境的背景信号,对结果有直接的影响,故优化封闭液的种类十分必要。在最优AFM1全抗原浓度、AFM1单抗浓度和最优包被条件的基础上,选择5% 脱脂奶粉(skimmed milk powdero,SMP)、1% 牛血清白蛋白(BSA)和1% 卵白蛋白(oval⁃bumin,OVA)作为封闭溶液,空白对照孔中仅加入PBS 缓冲液,并按照1.3.2 进行试验,根据最大P/N值确定最佳封闭溶液。
1.3.3.4 最佳酶标二抗浓度的优化
影响ic⁃ELISA 灵敏度的重要因素还包括IgG⁃HRP 的浓度。为了提高体系的灵敏度,利用抗体稀释液按照1∶500、1∶1 000、1∶2 000、1∶3 000 和1∶4 000 5 种不同浓度,对羊抗小鼠辣根过氧化物酶标记二抗(IgG⁃HRP)进行稀释,并按照1.3.2 进行试验,根据最大P/N值确定最合适的IgG⁃HRP 浓度。
1.3.3.5 TMB 显色时间的优化
在最优AFM1全抗原和AFM1单抗浓度、包被条件、最优封闭溶液种类和最优IgG⁃HRP 稀释比例的基础上,优化TMB 显色时间,设置5 个时间长度,分别为10、15、20、25 min 和30 min,步骤与1.3.2 相同,TMB显色的最佳时间由最大P/N值确定。
1.3.4 ic⁃ELISA 方法的建立
AFM1标准品用甲醇溶液稀释至1 mg/mL,储存在-20 ℃条件下,根据试验需求用PBS 缓冲液配制梯度浓度的标准品溶液。在确定最佳试验条件的基础上,按照步骤1.3.2 进行操作,建立ic⁃ELISA 试验体系。加入单抗的同时需要加入AFM1标准品进行竞争,其中AFM1标准品竞争浓度设置为0.05、0.10、0.50、1.00、5.00、10.00 ng/mL,按照浓度分别加50 µL AFM1标准品,再加入50µL AFM1单克隆抗体,浓度为方法1.3.3.1 中确定的AFM1单克隆抗体最佳浓度的2 倍。空白对照中加入100µL 抗体稀释液代替标准品;阴性对照不加AFM1标准品,加入100 µL 最佳浓度的AFM1单克隆抗体,37 ℃竞争反应1 h。抑制率(A,%)公式如下。
A=[(R0-R)/R0]×100
式中:R0为AFM1标准品浓度为0 时的吸光度;R为一定浓度AFM1的吸光度。
以AFM1浓度的对数值为横坐标,抑制率为纵坐标,绘制ic⁃ELISA 抑制曲线和抑制回归曲线,IC10代表抑制率为10% 时所对应的抑制AFM1浓度,规定IC20~IC80为检测范围,最低检测限为IC10[25]。
1.3.5 实际样品检测
1.3.5.1 样品预处理
称取10 g 待测样品(精确到0.1 g)于200 mL 烧杯中,加水溶解,转移到100 mL 容量瓶中,用超纯水定容至刻度线。摇匀后,取10 g 样品6 000 r/min 离心10 min。取下层液体约1 g 于另一试管内,用于检测。
1.3.5.2 加标回收试验
将不同浓度的AFM1标准品(1 000、500、100 ng/mL)添加到实际样品中,测定样品回收率,每个样品重复3 次[26]。加标回收率(B,%)的计算公式如下。
B=[(C加标后-C样品)/C标准品]×100
式中:C加标后为实际样加入AFM1后的测定浓度,pg/mL;C样品为实际样加入AFM1前的检测浓度,pg/mL;C标准品为AFM1的浓度,pg/mL。
1.4 数据分析
使用Origin 软件对试验数据进行分析。所有分析测定均为3 次重复试验,结果用平均值±标准差表示。
2 结果与分析
2.1 AFM1 全抗原及单克隆抗体浓度优化
当AFM1全抗原浓度过低时,板内全抗原包被量不足,则全抗原与AFM1单抗的结合较少,由于单抗空余位点较多,增加了其与其他物质非特异性结合的概率,直接影响了体系的准确性;而AFM1全抗原浓度过高又会导致空间位阻,降低抗原抗体结合效率,造成成本的增加。本研究采用棋盘法对AFM1全抗原和单抗的稀释比例进行优化,结果如图1所示。
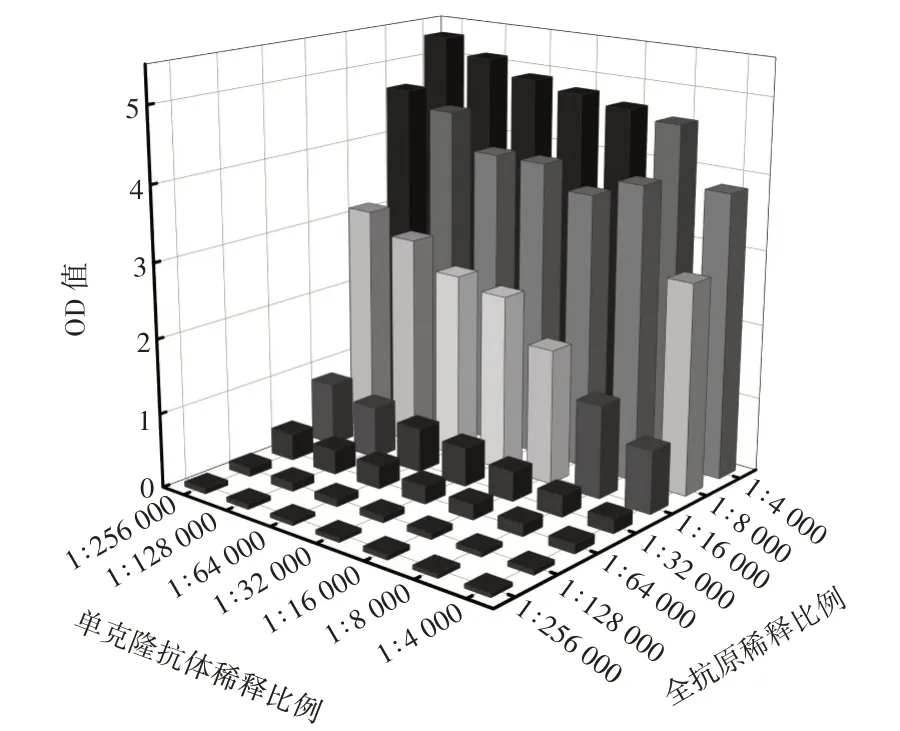
图1 最佳AFM1 全抗原和单克隆抗体稀释比例的选择Fig.1 Selection of optimal AFM1 whole antigen and monoclonal antibody dilution ratios
由图1 可知,当OD 值小于1 时,抗原抗体结合不够充分,造成该方法灵敏度不理想;当OD 值大于1时,抗原抗体结合较多,可能引起空间位阻,降低二者结合效率,增加试验成本。综合考虑,OD 值约为1 时,全抗原和单抗的工作浓度最佳,即最佳的AFM1全抗原和AFM1单抗的最合适稀释比分别为1∶32 000 和1∶2560000。
2.2 最佳包被条件优化
利用不同包被时间及温度下的P/N值确定最优包被条件,结果如表1所示。
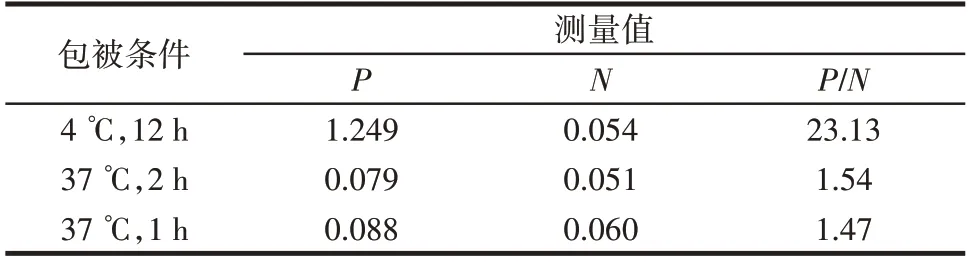
表1 最佳包被条件的选择Table 1 Selection of optimum coating conditions
由表1 可知,4 ℃下测得的12 h 阳性值和P/N值明显高于其他两组对照,因此选择在4 ℃下孵育12 h作为最合适的包被条件。
2.3 最佳封闭液优化
全抗原被包被在酶标板后用一定浓度的不相关蛋白质溶液重新包裹的过程称为封闭,即用无关蛋白质填补酶标板上未被包被的缝隙,避免杂物在随后ELISA 步骤中再吸附[27]。将3 种封闭剂和仅加入PBS缓冲液的4 种封闭方式作比较,根据最大P/N值,选择最合适的封闭溶液种类,结果如图2所示。
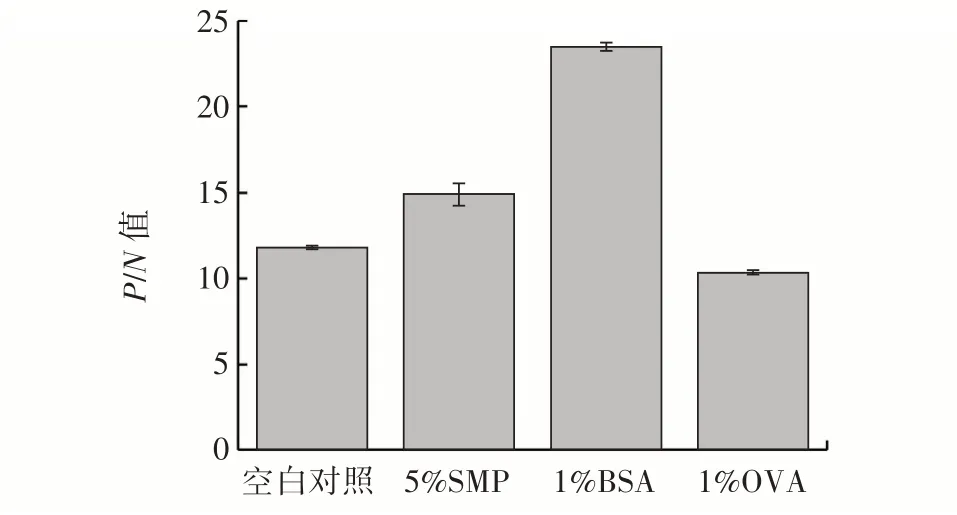
图2 最佳封闭液的选择Fig.2 Selection of the best blocking solution
由图2 可知,空白对照、5%SMP、1%OVA 组的P/N值均较小,这是因为背景信号值较高,N值较大,导致P/N值小,均低于15,说明背景信号在这3 种封闭条件下对检测结果产生较大的环境影响。当封闭溶液为1%BSA 时,吸光度OD 值显示P/N值最大,表明1%BSA作为封闭溶液对检测条件的背景信号干扰不大,因此,在试验中选择1%BSA 为最合适的封闭溶液。
2.4 二抗浓度优化
为获得检测体系的最大灵敏度,需要优化最佳的二抗工作浓度[28]。最优浓度是指当IgG⁃HRP 稀释到该浓度时,ic⁃ELISA 产生最低的背景吸光度,从而获得最高灵敏度。在先前优化条件的基础上,IgG⁃HRP 用抗体稀释液以1∶500、1∶1 000、1∶2 000、1∶3 000、1∶4 000的比例梯度稀释,最大P/N值对应的稀释比例即为IgG⁃HRP 的最优浓度,结果如图3所示。
由图3 可知,P/N值在稀释比为1∶3 000 时最大。因此,选择IgG⁃HRP 的最佳稀释比例为1∶3 000。
2.5 最佳显色时间优化
ELISA 信号值的大小由TMB 显色液的颜色深度决定,而颜色深度与显色孵育时间有关,因此操作步骤中显色反应的优化对于保证ic⁃ELISA 最终的测定结果非常重要[29]。TMB 显色时间的长短是影响ic⁃ELISA灵敏度的重要因素之一,为提高ic⁃ELISA 检测的稳定性,优化TMB 显色时间,设置5 个显色时间,分别为l0、15、20、25 min 以及30 min,结果如图4所示。
由图4 可知,显色时间为25 min 时,对应P/N值最大,为22.36,因此确定TMB 最优显色时间为25 min。
2.6 ic⁃ELISA 试验结果分析
根据之前所有的优化结果,确定完整的ic⁃ELISA试验条件:AFM1全抗原的稀释比为1∶32 000,单抗的稀释比为1∶256 000,在4 ℃条件下包被12 h,封闭溶液选择1% BSA,酶标二抗的稀释比是1∶3 000,显色时间为25 min。之后采用PBS 缓冲液制备梯度浓度(0.05、0.10、0.50、1.00、5.00、10.00 ng/mL)的AFM1标准品,进行ic⁃ELISA 试验,结果如图5所示。
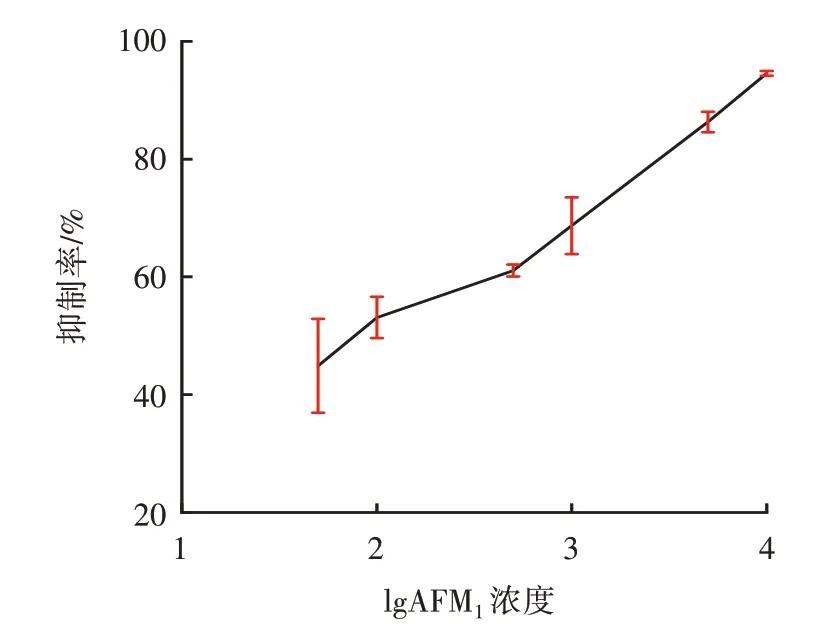
图5 AFM1 间接竞争试验结果Fig.5 AFM1 indirect competition experiment results
由图5 可知,随着AFM1标准品浓度的不断提高,对应的抑制率不断提高,表明竞争明显。
2.7 AFM1 标准曲线
通过ic⁃ELISA 试验体系测得的AFM1的标准拟合曲线、线性回归方程分别如图6、图7所示。
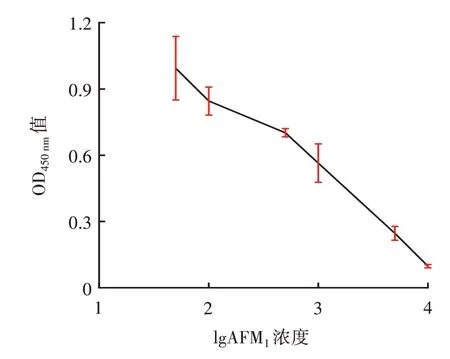
图6 AFM1 标准拟合曲线Fig.6 Standard fitted curve of AFM1
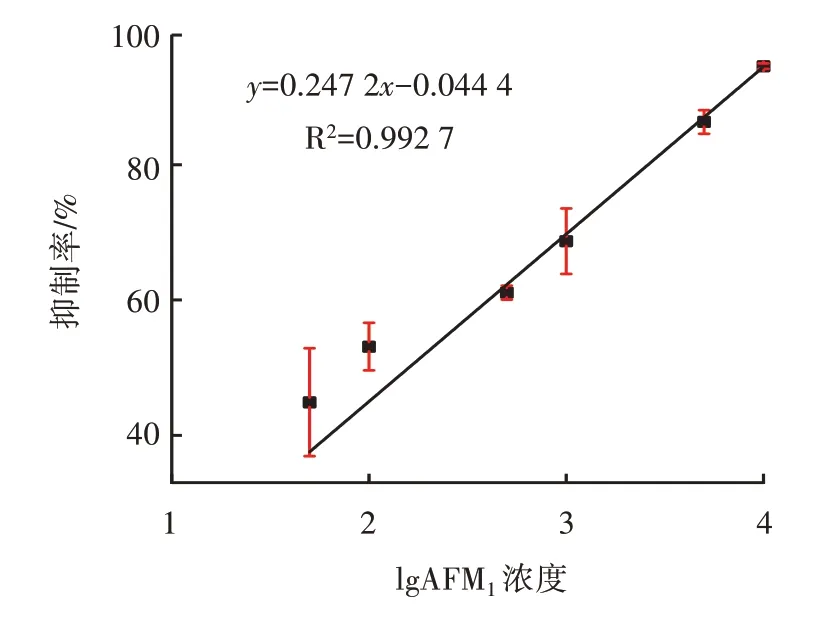
图7 AFM1 线性回归方程Fig.7 Linear regression equation of AFM1
由图6 可知,AFM1浓度在50~10 000 pg/mL 时,其吸光度整体逐渐下降,说明当AFM1浓度较低时,仅有较少的AFM1标准品与全抗原竞争结合AFM1单抗的位点,竞争率较低;当AFM1浓度增加时,出现更多的AFM1标准品与全抗原竞争结合AFM1单抗的位点,竞争率明显增加。由图7 可知,AFM1在9.743~2.605×103pg/mL 的浓度范围内存在良好的线性关系,线性方程为y=0.247 2x-0.044 4,R2=0.992 7,经计算,检出限IC10为3.84 pg/mL。
2.8 实际样品测定
使用ic⁃ELISA 方法检测实际样品中AFM1含量,以验证该体系在食品分析中的实际应用稳定性,结果见表2。
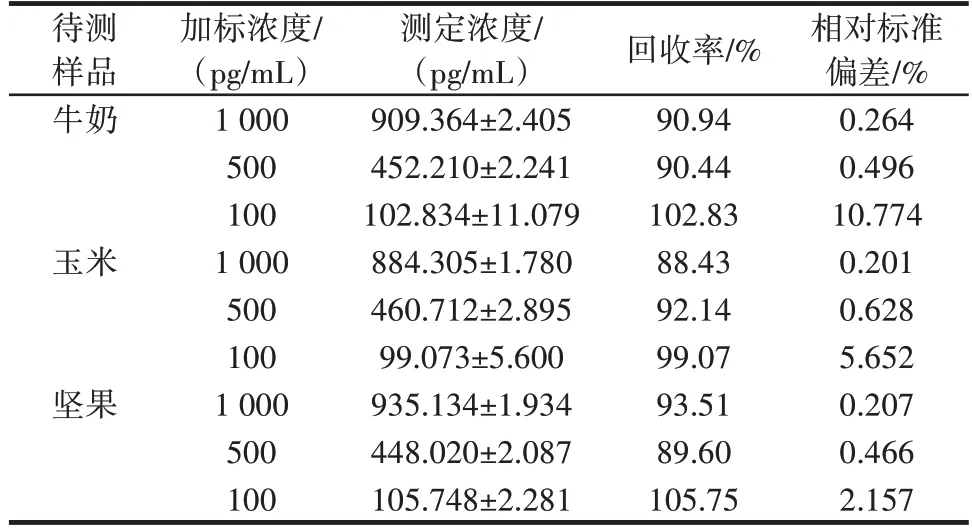
表2 基于ic⁃ELISA 方法的AFM1 实际样品检测结果Table 2 AFM1 actual sample detection results based on ic⁃ELISA
由表2 可知,将不同浓度的AFM1标准品添加到不同的样品中,加标浓度分别为1 000、500 pg/mL 和100 pg/mL。采用该免疫法测定的AFM1的回收率为88.43%~105.75%,表明该方法满足食品中AFM1分析和检测的需要。
3 结论
AFM1存在极大的食品安全隐患,且该毒素在人类生活环境中随处可见,对公众健康和饮食安全造成严重的危害。本研究在合成AFM1全抗原的基础上,建立了AFM1的ic⁃ELISA 检测方法,方法线性范围为9.743~2.605×103pg/mL,检出限为3.84 pg/mL,加标回收率为88.43%~105.75%。本方法大大提升了检测灵敏度,具有适用性好、操作简单、灵敏度高等优点,可为食品质量监管提供技术支撑。

