欧洲医药保健网分类系统在甲氨蝶呤个体化用药相关问题的应用
蔺婷婷 马 静 孙绍伟 董宁霞 魏传梅 吕文文 满玉清
滨州医学院附属医院药学部 山东 滨州 256603
甲氨蝶呤(methotrexate,MTX)是一种抗叶酸代谢药物,临床上主要用于急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)等各种恶性肿瘤疾病的治疗[1],但是静脉持续输注大剂量MTX可引起不可逆的不良反应,甚至导致死亡[2]。2019年中国临床肿瘤学会编写的《大剂量MTX-亚叶酸钙解救疗法治疗恶性肿瘤指南》中指出,大剂量MTX(high-dose methotrexate,HD-MTX)的应用对治疗ALL具有重要意义[3],但是ALL患者HD-MTX用药后,随着MTX剂量的增大所产生的相关严重器官毒性和剂量限制性不良事件是目前临床应用的一大挑战[4]。由此可见,MTX的药物相关问题(drug-related problems,DRPs)的发生率相对较高。欧洲医药保健网(pharmaceutical care network Europe,PCNE)建立DRPs分类系统后逐渐更新,目前最新版本为V9.1,用于研究临床上DRPs的性质、流行率和发生率,也可作为研究药学监护成果过程中的一个指标[5]。既往研究者通过PCNE对医院慢病患者进行用药管理,大大提高药学监护工作效率[6-7]。PCNE分类系统对治疗药物监测个体化药学服务中的应用目前没有见于报道。因此,本研究采用PCNE分类系统对应用MTX患者个体化用药中的DRPs进行归纳总结,并对典型案例进行分析,在药物基因组学以及药物治疗学应用于临床的过程中减少DRPs的发生,提高临床药师的药学服务水平。
1 资料与方法
1.1 资料来源 选取2018—2022年在我院使用MTX后进行血药浓度检测、基因检测的患者作为研究对象,临床药师进行干预登记记录作为数据来源。通过医院信息系统调取患者信息,收集患者资料,包括性别、年龄、诊断、血药浓度及基因监测结果,发生和可能发生的DRPs。
1.2 DRPs的分析标准与方法 将确定的DRPs按照PCNE统计表的分类编码对其内容进行记录,构建登记表[8]。PCNE分类系统主要有5部分:①问题(包括潜在的问题);②原因(包括潜在问题的可能原因);③介入方案;④介入方案的接受;⑤DRP状态。临床药师在分析DRPs时,通过PCNE分类系统依次对每一部分进行分析,并进行勾选,实现对DRPs的统计。临床药师在日常个体化药学工作中,首先通过对患者血药浓度和基因检测结果分析并记录,采用PCNE分类系统(9.1版)识别DRPs,然后通过查询指南和文献,与专科临床药师讨论等,向医师和患者提供药学服务建议。
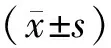
2 结果
2.1 一般资料 本研究共纳入使用MTX患者117例,进行血药浓度监测和基因检测共738例次。其中男性患者69例(58.97%),女性患者48例(41.03%),患者年龄为2~75岁,平均年龄为(43.59±21.82)岁。患者诊断主要涉及“ALL”“骨肉瘤”“软组织肉瘤”“风湿性关节炎”。
2.2 DRPs的分类
2.2.1 DRPs问题分类 进行DRPs干预前,首先明确问题的分类。738例次个体化药学检测中,DRPs共计244条,按照PCNE系统进行分类汇总,排名靠前的问题是P2.1(可能)发生药物不良事件(77.05%),包括基因检测结果提示不良反应风险较高、血药浓度结果高于目标值、联合应用与MTX具有相互作用的药物。P1.2治疗效果不佳(11.07%)包括血药浓度较低等。P3.3不确定的问题或抱怨需要进一步说明(6.97%),包括进行血药浓度监测(therapeutic drug monitoring,TDM)送样的时机以及采血时间不规范等。见表1。总体情况是药物安全性方面占比重较大。

表1 药物相关问题分类(n=244)
2.2.2 DRPs的原因类别分布 本研究中出现288个原因,其中排名靠前的原因是C1.4不适当的组合(27.09%),主要包括联合用药。C9.2其他原因(详细说明)(24.65%)主要包括患者进行亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)与谷胱甘肽转移酶P1(glutathione S-transferase P1, GSTP1)的基因检测,结果发生基因突变可影响叶酸代谢,使MTX在体内积蓄,疗效增加,加重MTX不良反应。C3.2药物剂量过高(19.79%)主要包括MTX出现TDM结果高于目标值,患者基因检测显示MTX在体内代谢较慢,致药物浓度较高。见表2。总体来说药物剂量选择占比最大。
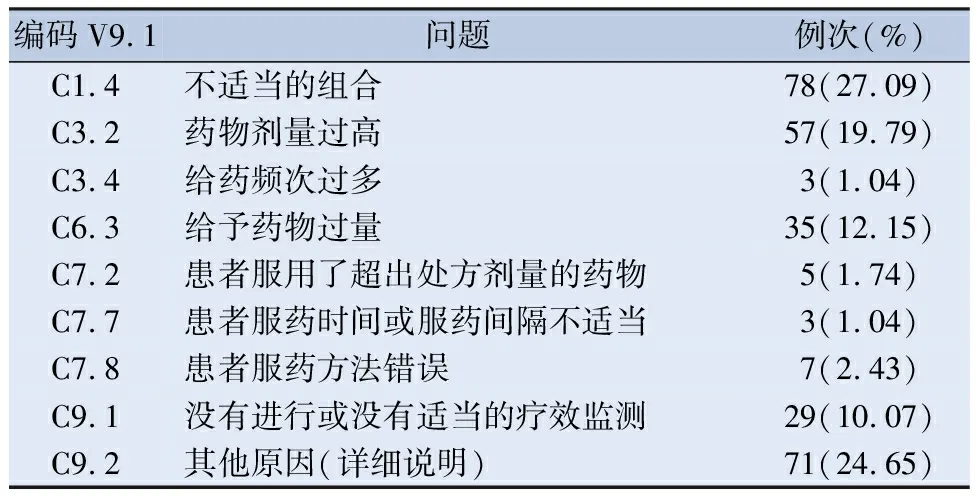
表2 药物相关问题原因类别(n=288)
2.2.3 DRPs的介入类别分布 明确问题出现的原因后,临床药师联系医师进行介入干预,一个问题可能导致多个介入方案。由于本研究未及时联系到临床医生,导致36例未介入,药师介入覆盖率为85.25%。介入部分全是医生层面的介入,主要是告知医生和提供介入方案给医生。见表3。
2.2.4 DRPs的介入方案接受类别以及状态类别 临床药师提供给临床医生的介入干预,接收并完全执行的占73.56%。接受介入方案,但不清楚是否执行的占17.31%。未接受介入方案,不清楚原因的占9.13%,见表4。进行介入方案的患者除了3个问题以外,其余问题全部解决(98.56%)。

表4 药物相关问题介入方案的接受类别(n=208)
2.3 典型案例 患者,男,25岁,身高为169 cm,体质量为92 Kg,诊断为ALL。因腹痛1 h入院,完善相关辅助检查,经灌肠通便后腹痛减轻,持续给予灌肠后排便排气较多,予以注射奥美拉唑钠40 mg,每12 h 1次。鞘内注射阿糖胞苷50 mg,MTX 13 mg预防中枢神经系统白血病,排除化疗禁忌后开始化疗,因出现脑脊液压力增高及蛋白增高,适当增加MTX用量。具体用药方案为:MTX 3 g,持续输注24 h,1 d;阿糖胞苷2g,每12 h 1次,2~3 d。MTX用药结束后给予亚叶酸钙解救,并给予亚叶酸钙漱口,辅以碱化、水化、止吐、护胃、利尿等治疗。化疗第1天夜间出现发热,完善相关细菌学检查,加用哌拉西林他唑巴坦进行抗感染治疗。第2天复查肌酐达225.5 μmol/L,随后监测MTX血药浓度(C48 h)高达15.84 μmol/L,立即进行血液透析及连续血液滤过治疗,降低血液及组织中的药物,并给予亚叶酸钙0.1 g,每6 h 1次。临床药师考虑血药浓度明显升高可能与细胞色素酶P450基因型变性有关,建议检测基因型。临床药师通过分析患者的合并用药情况,考虑抗菌药物哌拉西林他唑巴坦钠可导致急性肾功能损伤,建议暂停使用,医师换用头孢哌酮钠舒巴坦钠抗感染治疗。临床药师考虑注射用奥美拉唑干扰MTX排泄,建议停用。医师采纳临床药师的建议。第7天患者送检的基因检测报告显示:该患者GSTP1(c.313A>G)为AA型,MTHFR(665C>T)是CT型,三磷酸腺苷结合盒转运体B1(ATP-binding cassette sub-family B 1,ABCB1,c.3435T>C)为CC型,氨基咪唑氨甲酰转移酶(aminoimidazole carboxamide ribonucleotide transformylase,ATIC,1503+675T>C)是TT型。这提示,MTX代谢异常,治疗反应较差。应用亚叶酸钙0.03 g,每6 h 1次,第17天MTX血药浓度降至0.1 μmol/L以下,肌酐逐渐好转,肌酐118.6 μmol/L,状况稳定后办理出院。
在本案例中,临床药师发现问题,利用PCNE系统进行分析,明确了问题分类,该患者问题属于治疗安全性中的发生药物不良事件(P2.1)。针对问题寻找原因发现,MTX用量过大(C3.2)致浓度过高,并且药物选择C1中的不适当的组合(C1.4),具体为MTX联合应用奥美拉唑与哌拉西林他唑巴坦,影响MTX排泄,致患者肌酐进行性升高,导致急性肾衰竭。针对该问题,临床药师与医师讨论干预方案,建议检测MTX基因型,进行血液净化,加大亚叶酸钙进行解救(I1.3),患者逐渐病情好转,医生接受干预并完全执行(A1.1),问题得到全部解决(O1.1)。
3 讨论
随着MTX广泛应用于ALL、淋巴瘤、骨肉瘤等恶性肿瘤及类风湿性关节炎等自身免疫性疾病治疗,应用过程中骨髓抑制、黏膜炎、肝肾功能损伤等不良反应的发生率较高[9-10]。临床药师在解读血药浓度结果以及基因检测这个治疗过程中如何更好地给出建议,发现潜在的DRPs,并对其进行药学个体化干预成为目前迫在眉睫需要解决的问题。目前,DRPs分类系统版本诸多,暂无统一标准,研究者常用的分类系统有PCNE分类系统、Granada-Ⅱ 分类系统等[11-12]。PCNE 分类系统可用于研究 DRPs的性质与发生率,是在慢性病药学监护过程中应用成熟的一个工具[13-14]。目前, PCNE分类系统对药物TDM个体化药学服务中的应用较少。随着精准药学的发展,我院自2017年1月开始在临床药学科开展MTX血药浓度检测以及用药基因检测两个项目。临床药师结合药物治疗管理理念,对血液科应用MTX的患者建立个体化精准药学服务的工作模式,以期为患者提供更好的药学服务工作。本研究对近几年个体化药学中MTX血药浓度以及基因检测中的DRPs进行统计归纳,对今后预防此类问题提供帮助,完善临床药师的工作模式,提高药学服务水平。
本研究显示,进行MTX个体化监测的患者中,DRPs的主要问题为“P2.1发生药品不良事件”,此问题位居第一位,所占比例是77.05%,此结果与Kim等[14]的结果相似。针对问题寻找原因,主要原因有以下几个方面。①C1.4不适当的组合,所占比例27.09%,联合应用与MTX具有相互作用的药物是MTX延迟排泄的重要影响因素。常见的药物有质子泵抑制剂(proton pump inhibitor,PPI)、非甾体抗炎药、部分抗菌药物(如阿莫西林、哌拉西林他唑巴坦等)等[15]。PPI可以阻断H+-K+-ATP酶,从而影响MTX转运相关蛋白,进而阻碍MTX的转运导致排泄延迟[16]。因此,临床药师建议避免联合应用此类药物,部分化疗期间出现消化系统问题联合应用PPI的患者尽量停药或用H2受体阻滞剂进行替代。②C9.2 其他原因(详细说明),所占比例24.65%。患者的MTX基因检测报告提示发生不良反应的风险较高。MTX代谢相关转运蛋白以及代谢相关酶基因的单核苷酸多态性影响MTX的血药浓度、治疗效果及不良反应,其中ABCB1、MTHFR、GSTP1等基因影响化疗的不良反应,出现基因位点突变的患者在应用MTX过程中注意减少剂量以及密切检测MTX血药浓度[2]。典型案例中的患者就是多个基因出现突变致MTX排泄延迟,引起急性肾损伤严重不良反应。因此,临床药师建议在患者HD-MTX首次治疗前进行基因监测,预测对MTX的敏感性和耐受性。③C3.2药物剂量过高,所占比例19.79%,主要是患者相应时间的血药浓度结果高于目标范围,出现排泄延迟。多数研究认为,MTX C 24 h≤10.0 μmol/L提示MTXMTX排泄正常,不良反应发生率低,而48 h及72 h血药浓度反映了MTX在体内的排泄情况,与安全性密切相关。临床药师结合患者不同时间点的血药浓度结果为医生提供TDM结果的解读,建议出现不良事件如排泄延迟时,增加监测频率,确保MTX的安全合理应用。
本研究的介入干预方案类别主要是针对医师层面,208例次问题告知管床医师,其中172例次用药建议被管床医师接受并应用,干预接受率为73.56%。本研究显示,针对有明确意义的MTX血药浓度以及基因检测的解读对临床医师调整治疗方案是有意义的。这说明,对MTX个体化治疗的药学服务在患者治疗过程中是必不可少的环节,
综上所述,本研究运用PCNE分类系统对MTX个体化药物问题进行分析,临床药师可以从问题的根源去发现解决办法,提升了临床药师发现和解决DRPs的技能。通过对该药物治疗典型案例的探讨,发现临床药师可对应用MTX的患者的血药浓度及基因检测报告进行解读,并提供个体化给药的建议。

