CDGSH铁硫结构域1在肺纤维化和铁死亡中的作用与机制
庞昕洳 刘乃国
滨州医学院附属医院医学研究中心 山东 滨州 256603
肺纤维化是一种慢性致死性间质性肺疾病,以细胞外基质异常沉积和肺泡结构严重破坏为特征[1]。目前,肺纤维化疾病预后极差,治愈率低。因此,寻找新的治疗靶点及治疗策略具有重要意义。铁死亡是一种铁依赖性程序性细胞死亡[2],在形态方面主要表现为线粒体膜收缩,膜密度增加,线粒体嵴减少,核膜完整[3],在生物化学方面表现为铁超载、活性氧(reactive oxygen species,ROS)水平升高、脂质过氧化产物的积累[4-6]。erastin是公认的铁死亡小分子诱导剂[7]。经博来霉素处理的肺泡II型细胞出现铁积累,铁超载导致线粒体损伤,诱发铁死亡,最终发展为肺纤维化[8]。CDGSH铁硫结构域1(CDGSH iron sulfur domain 1,CISD1)基因位于染色体10q21.1,该基因编码的CISD1蛋白相对分子质量约为12.2×103[9],是锚定在线粒体外膜上的铁硫蛋白[10],调节线粒体的生物学功能以及线粒体中铁和ROS的水平[11]。CISD1的缺失导致线粒体铁超载和氧化损伤[12]。抑制CISD1可增强Fe2+介导的线粒体脂质过氧化,进一步促进铁死亡[13]。稳定CISD1的铁硫簇可能会阻碍线粒体对铁的摄取、脂质过氧化和铁死亡[13]。虽然铁代谢与肺纤维化和铁死亡密切相关,但铁代谢相关基因CISD1在肺纤维化中的作用尚未见报道,肺纤维化与铁死亡的关系也不清楚。本研究旨在以人类非小细胞肺癌细胞(A549细胞)为研究对象,研究CISD1在肺纤维化和铁死亡中的作用及其氧化应激相关机制,为丰富肺纤维化的发病机制和寻找新的治疗策略提供科学依据。
1 材料与方法
1.1 细胞培养 A549 细胞(普诺赛生命科技有限公司,中国),培养于Ham’s F-12K基础培养基(普诺赛生命科技有限公司)+10% FBS(Sigma公司,德国)培养基中。在5% CO2培养箱中,37℃培养。当培养细胞融合度达到80%左右时,用0.25%胰蛋白酶消化细胞,进行传代。
1.2 细胞分组及处理 A549细胞培养24 h后随机分为对照组(C组)、TGF-β1组(T 组)、erastin组(E组)、TGF-β1+erastin组(T+E 组)、TGF-β1+ NL-1组(T+N 组)5组。 本研究所用的药物浓度如下:TGF-β1(Sigma公司,德国)5 ng/mL,erastin (Sigma公司,德国)10 μmol/L,NL-1 (Med Chem Express公司,美国)40 μmol/L。在倒置显微镜下观察细胞形态。分别在处理后6、12、24、36、48 h收集细胞,用于进一步检测。
1.3 荧光定量PCR检测 使用Trizol试剂(赛默飞公司,中国)提取细胞中总RNA,再将提取的总RNA反转录为cDNA。以GAPDH为内参检测α-平滑肌肌动蛋白(α-smoothmuscleactin,α-SMA)、E-钙粘蛋白(E-cadherin,E-Ca)、CISD1的表达,PCR反应条件为:95℃ 5 min,95℃ 15 s,59℃ 30 s,72℃ 30 s,共40个循环。各个基因引物序列见表1。
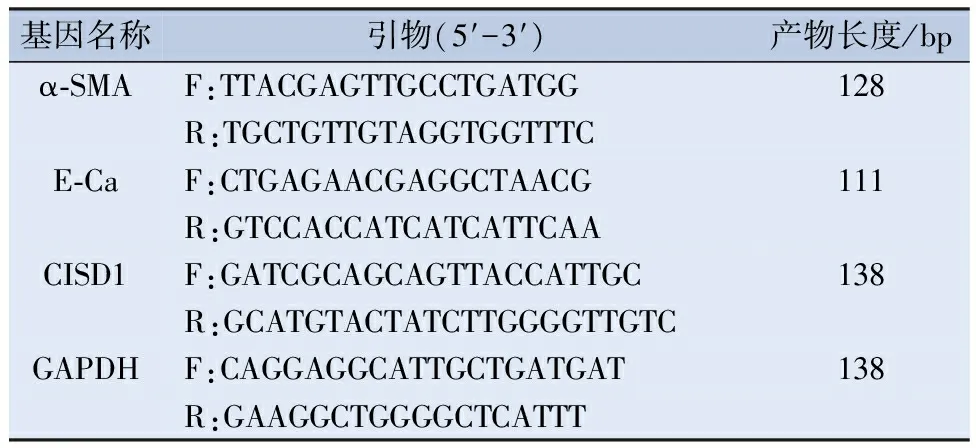
表1 用于实时定量PCR的引物序列
1.4 Western blot测定 收集各组A549细胞,提取总蛋白,蛋白按每孔30 μg进行上样,用12% SDS-PAGE凝胶进行电泳分离,转移到硝酸纤维素膜上,分别用CISD1一抗(稀释比例为1∶2 000)和GAPDH一抗(稀释比例为1∶500)进行4℃孵育过夜,加入羊抗兔或羊抗鼠偶联二抗,室温孵育2 h,使用ECL Plus化学发光系统进行显影,Image J 软件分析条带灰度值,计算目的蛋白相对表达量。
1.5 细胞活力检测 A549细胞接种于96孔培养板,各处理组分别于6、12、24、36、48 h后,将10 μL增强CCK-8溶液(伊莱瑞特生物科技有限公司,中国)依次加入相应的孔中,在37℃、5% CO2条件下孵育1 h,使用酶标仪(Thermo Fisher公司)在450 nm波长处测量吸光度。细胞活力计算公式为:(OD450 sample-OD450 blank)/(OD450 control-OD450 blank)×100%。
1.6 线粒体活性氧(mitoROS)测定 不同组A549细胞用100 μL MitoSOX Red试剂工作液(MedChemExpress公司,美国)在37℃避光孵育15 min,然后用无血清Ham′s F-12K培养基洗涤2~3次。用倒置荧光显微镜拍摄荧光图像(Olympus,日本),平均荧光强度用Image J(NIH)软件量化。
1.7 细胞内Fe2+含量的检测 各组细胞在处理6、12、24、36、48 h后收集1×106细胞,PBS洗涤2次。每个样品加入0.2 mL缓冲液。混合后置于冰上裂解10 min,15 000g离心10 min,收集上清液。按照Elabscience®细胞亚铁检测试剂盒(伊莱瑞特生物科技有限公司,中国)的说明测定Fe2+水平。使用酶标仪(Thermo Fisher公司)在593 nm波长处测量吸光度。测定不同浓度下标准样品的吸光度,绘制标准曲线,进而测定样品中的Fe2+浓度。
1.8 4-羟基壬烯醛(4-HNE)测定 将每组1×106细胞重悬于150 μL PBS中,用超声波处理器破碎。收集上清液,参照4-HNE酶联免疫吸附测定试剂盒(伊莱瑞特生物科技有限公司,中国)的说明测定4-HNE水平。用酶标仪(Thermo Fisher公司)在450 nm处测定反应混合物的光密度(OD值),用OriginPro软件将光密度值转换为4-HNE浓度。
2 结果
2.1 各组细胞中CISD1的表达 在各时间点T组和E组中CISD1 mRNA和蛋白质表达水平均显著低于C组的表达(P<0.01)。T+E组中CISD1 mRNA及蛋白质表达水平均显著低于C组(P<0.01)、T组(P<0.01)和 E组(P<0.01)。在处理后24~48 h,与T组比较,T+N组CISD1 mRNA和蛋白表达量显著降低(P<0.01),见图1。这说明,NL-1处理抑制了CISD1表达,TGF-β1和erastin处理也会抑制CISD1的mRNA和蛋白表达,且呈现协同作用。
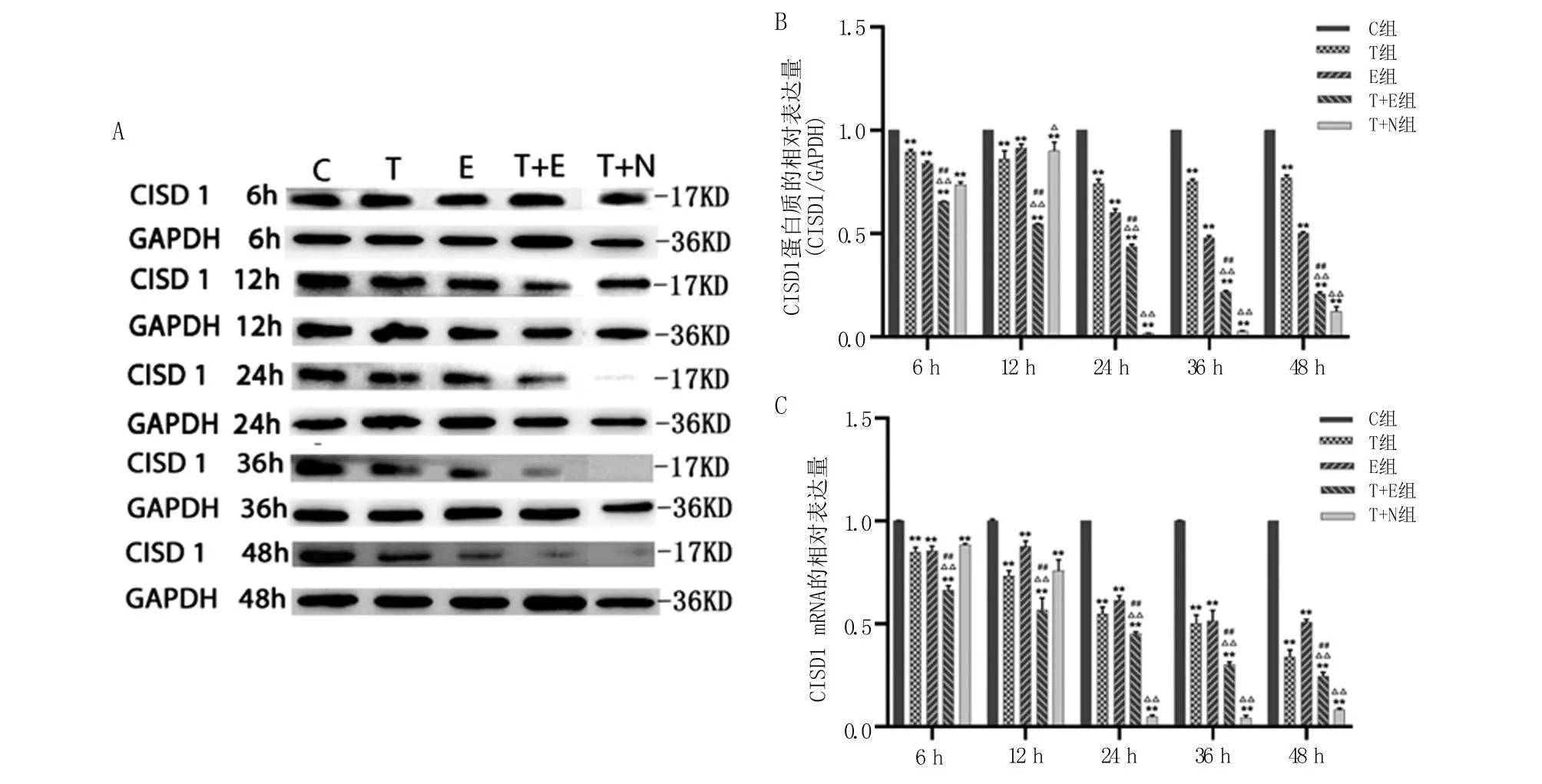
A.Western blot检测得到的不同处理组CISD1的蛋白表达;B.Western blot检测各处理组中CISD1蛋白质表达的结果定量并均一化;C.各组中CISD1 mRNA表达水平。与C组比较,**P<0.01;与T组比较,△P<0.05,△△P<0.01;与E组比较,##P<0.01。
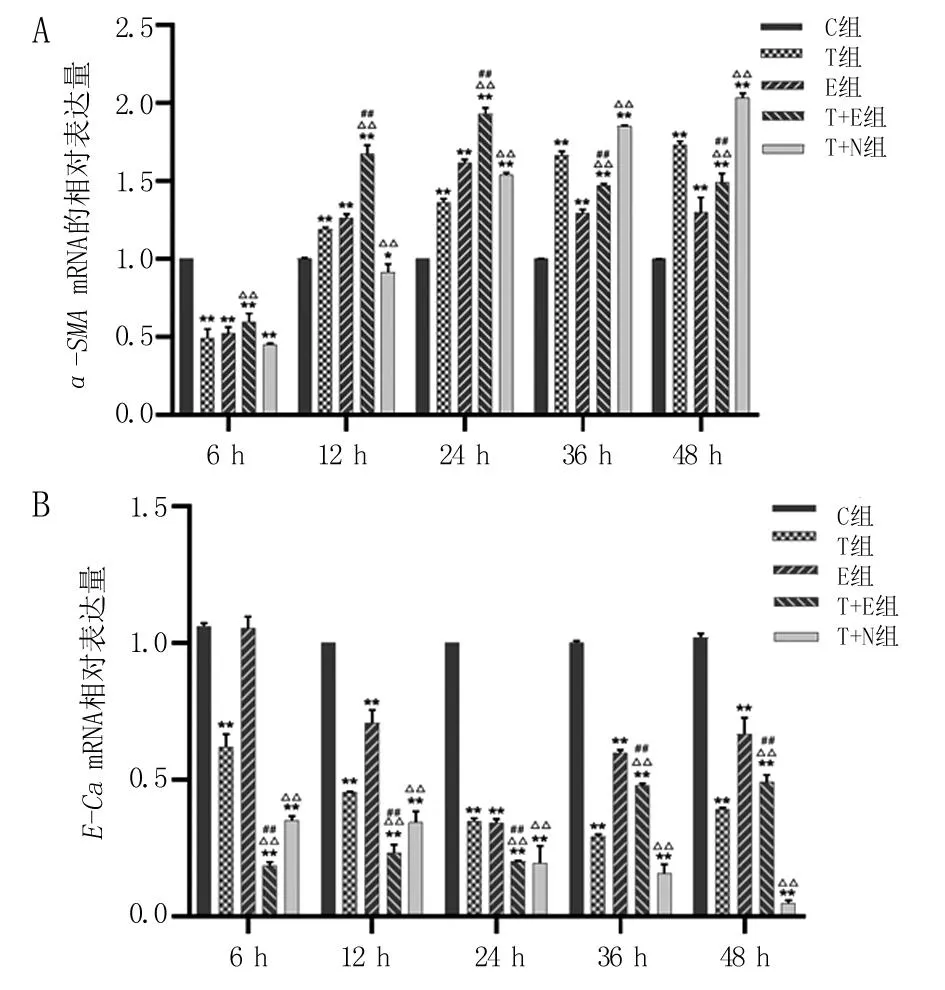
A.α-SMA mRNA表达水平;B.E-Ca mRNA表达水平。与C组比较,*P<0.05,**P<0.01;与T组比较,△△P<0.01;与E组比较,##P<0.01。
2.2 ɑ-SMA和E-CamRNA在各处理组细胞中的表达情况 T组、E组中的α-SMAmRNA表达量在处理后12~48 h高于C组的表达(P<0.01)。与T组比较,T+E组α-SMAmRNA表达量在处理后6~24 h均升高(P<0.01),但处理后36、48 h时均降低(P<0.01)。在处理后24~48 h,T+N组α-SMAmRNA表达量显著高于T组的表达(P<0.01),见图2A。与C组比较,T组E-CamRNA表达量在整个实验过程中均显著降低(P<0.01)。在处理后12~48 h,E组E-Ca mRNA表达量显著低于C组(P<0.01)。在处理后6~24 h,T+E组E-CamRNA表达量显著低于T组(P<0.01),但在处理后36、48 h明显高于T组(P<0.01)。T+N组各时间点E-CamRNA表达水平均显著低于T组,见图2B。
2.3 不同处理后A549细胞的形态学变化 与C组比较,T组、T+ E组和T+N组从处理12 h开始细胞形态发生明显变化。这些细胞由最初的多边形逐渐转变为成纤维细胞样形态,这提示,细胞形态的改变是由TGF-β1引起的。E组和T+E组细胞在处理后24 h开始出现细胞死亡,并呈聚集性细胞死亡现象,细胞死亡数量随着时间的延长逐渐增加,直至48 h。T+N组细胞在处理后24 h后出现一定程度的细胞死亡,未见死亡细胞聚集。见图3。

图3 不同处理组中A549细胞的形态表现
2.4 细胞活力分析 CCK-8检测显示,T组细胞活力与C组比较无明显变化,从处理后12 h开始,E组细胞活力显著低于C组(P<0.01)。处理后12~48 h,T+E组细胞活力显著低于T组(P<0.01),整个时间段细胞活力均低于C组(P<0.01)。从处理后24 h开始,T+N组细胞活力显著低于T组(P<0.01)。见图4。

与C组比较,**P<0.01;与T组比较,△P<0.05,△△P<0.01。
2.5 抑制CISD1表达可增强线粒体活性氧(mitoROS)含量 在各时间点T组、E组和T+E组中的mitoROS水平均显著高于C组(P<0.01)。自处理后6~36 h,T+E组的mitoROS水平明显高于T组(P<0.01)和E组(P<0.01)。从处理后24 h开始,T+N组mitoROS水平显著高于T组,且随时间增加呈上升趋势(P<0.01)。见图5。
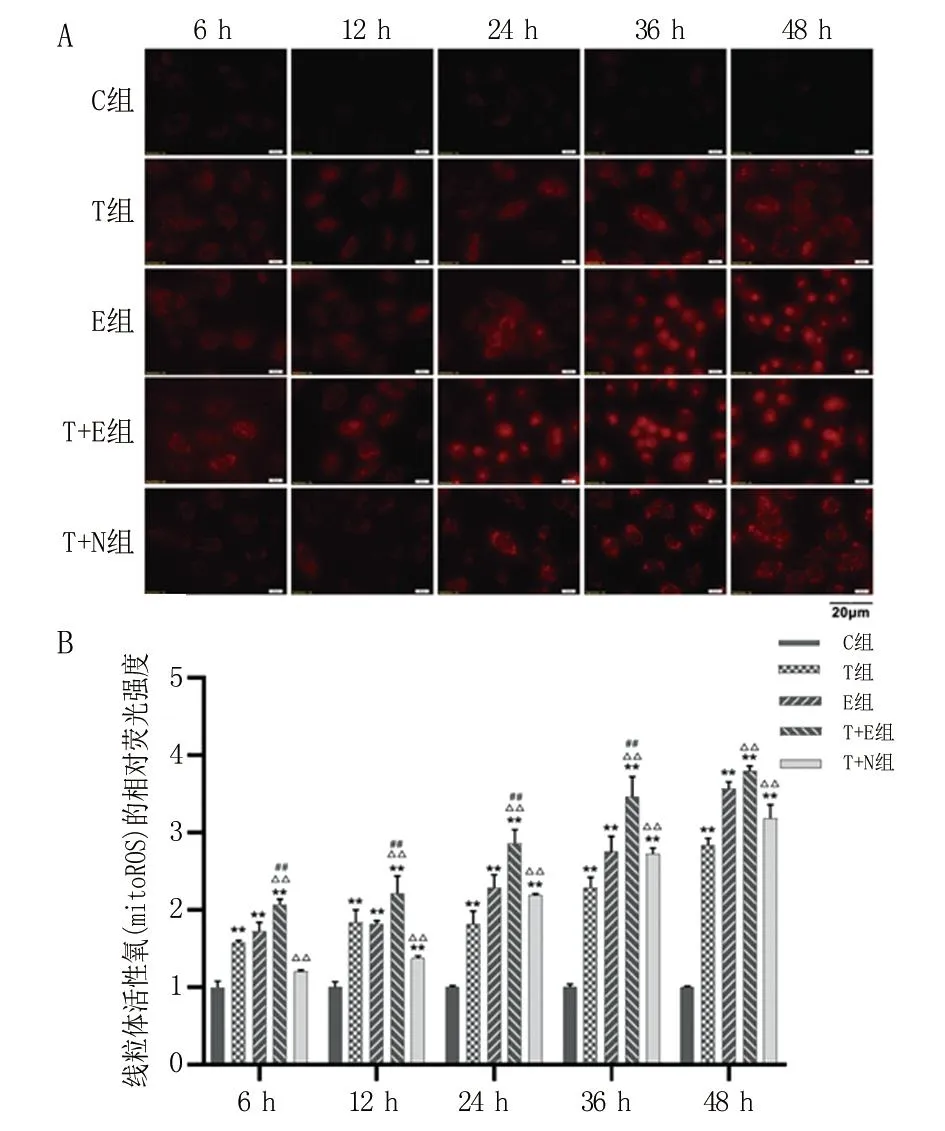
A.不同组线粒体活性氧随时间的荧光图像(400×,Bar = 20 μm);B.各处理组A549细胞中线粒体活性氧的相对定量。与C组比较, **P<0.01;与T组比较,△△P<0.01;与E组比较,##P<0.01。
2.6 抑制CISD1表达可提高细胞内Fe2+和4-HNE水平 与C组比较,T组的Fe2+水平从处理后12 h开始显著升高(P<0.01),从处理后6 h开始,E组的Fe2+水平高于C组(P<0.01)。与T组比较,T+E组Fe2+水平在处理后24 h前升高(P<0.01),处理后24 h后低于T组(P<0.01)。处理后24~48h, T+N组Fe2+水平显著高于T组(P<0.01)。这说明,NL-1抑制CISD1可以导致Fe2+水平升高,见图6A。与C组比较,处理后12~48 h,T组、E组、T+E组、T+N组4-HNE水平显著升高(P<0.01)。自处理后6 h开始,T+E组的4-HNE水平明显高于T组(P<0.01)和 E 组(P<0.01)。从处理后24 h开始,T+N组4-HNE水平显著高于T组(P<0.01),见图6B。
3 讨论
3.1 TGF-β1和erastin分别诱导A549细胞EMT和铁死亡 上皮间质转化(Epithelial-Mesenchymal Transition,EMT)是肺纤维化发展的关键过程[14]。转化生长因子-β1(TGF-β1)诱导A549细胞的EMT通常被用作体外肺纤维化模型[15]。在EMT过程中,间充质标志物如α-SMA的表达上调,上皮标记蛋白如E-ca的表达下调,导致上皮细胞粘附受损,结构改变,最终促进肺纤维化发展[16]。本研究中,T组、T+ E组、T+N组TGF-β1处理12 h后,细胞形态都发生了显著变化,由最初的多角形逐渐变为成纤维细胞样形态。这提示,细胞形态的改变主要是由TGF-β1引起的。此外,TGF-β1处理A549细胞后,α-SMAmRNA表达水平显著升高,E-CamRNA表达水平明显降低。这提示,TGF-β1处理A549细胞后发生EMT,可作为体外肺纤维化模型。erastin是一种公认的铁死亡小分子诱导剂[7,17]。本研究发现,E组和T+E组A549细胞出现聚集性细胞死亡,在形态学上表现为细胞收缩变圆,死亡细胞数量随时间增加。与C组比较,E组和T+E组细胞Fe2+、mitoROS和4-HNE水平显著升高,细胞活力明显降低。这表明,erastin诱导的A549细胞死亡符合铁死亡的形态学和生化特征[3,18-19]。这说明,erastin可诱导A549细胞发生铁死亡。
3.2 铁死亡与TGF-β1诱导EMT的共同机制 TGF-β1诱导EMT时,铁蛋白重链(ferritin heavy chain,FHC)水平显著降低,导致细胞内铁超载,进而促进ROS的产生,导致肺泡上皮细胞损伤[20]。TGF-β1增加4-HNE的产生,4-HNE是氧化应激的标志,是脂质过氧化的产物[21]。4-HNE通过促进ROS生成、抑制抗氧化酶增加氧化应激,促进TGF-β1表达,参与纤维化过程[22]。在铁死亡发生过程中存在铁过载[23],ROS、mitoROS和4-HNE水平增高[24]。本研究中,与C组比较,T组、E组和T+E组的Fe2+、mitoROS和4-HNE水平均明显升高,T+E组中4-HNE和mitoROS水平明显高于T组和E 组。这提示,铁超载、线粒体氧化和脂质过氧化升高是TGF-β1诱导EMT和Erastin诱导铁死亡的共同机制。
3.3CISD1在肺纤维化和铁死亡中的作用及可能机制CISD1是线粒体外膜蛋白,维持细胞内铁和活性氧稳态[25]。CISD1调节细胞内游离铁的水平,细胞内较高水平的游离铁会通过芬顿反应促进4-HNE的生成[26]。抑制CISD1导致铁积累和随后的线粒体氧化损伤,促进erastin诱导的铁死亡[13]。本研究中,经TGF-β1和erastin处理后,CISD1的mRNA和蛋白质表达水平显著降低。与T组比较,T+N组α-SMAmRNA表达水平及细胞内Fe2+、mitoROS、4-HNE水平显著升高,而E-CamRNA表达量明显降低。这说明,抑制CISD1可提高Fe2+、mitoROS和4-HNE水平,增强氧化应激和脂质过氧化,促进肺纤维化和铁死亡,CISD1可能通过降低Fe2+水平、抑制氧化应激和脂质过氧化作用来抑制铁死亡和肺纤维化。此外,与T组和E组比较,T+E组CISD1的表达水平明显降低。这提示,TGF-β1与erastin在抑制CISD1表达方面可能具有协同作用。
综上所述,TGF-β1和erastin分别诱导A549细胞EMT和铁死亡。Fe2+、mitoROS、4-HNE水平升高是TGF-β1诱导A549细胞的EMT和erastin诱导的铁死亡的共同机制。CISD1可通过降低Fe2+水平、抑制氧化应激和脂质过氧化作用抑制肺纤维化和铁死亡。

