热解温度对不同生物炭吸附铅和镉性能的影响
王 敏,杨锟鹏,张 斌,祁 超,金志鹏,张亚平
(1. 江苏省徐州环境监测中心,江苏 徐州 221002;2. 东南大学 能源与环境学院 能源热转换及其过程测控教育部重点实验室,江苏 南京 210096;3. 江苏省地质勘查技术院,江苏 南京 210008)
随着工业生产(如采矿、冶金、造纸等)的发展和人类活动的加剧,导致大量重金属(如Pb和Cd等)释放到环境中,造成严重的环境污染问题[1-2]。生物炭具有比表面积大、孔隙结构发达、含氧官能团丰富等优点,广泛应用于重金属的吸附去除[3]。研究表明,生物炭吸附Pb2+和Cd2+等重金属可通过矿物沉淀作用[4]、离子交换作用[5]、金属阳离子与含氧官能团之间的配位作用(配位作用A)[6]和金属阳离子与π电子之间的配位作用(配位作用B)等[7]。受原料和热解温度的影响,不同生物炭对重金属的吸附性能不同。
本工作以芦苇、花生壳和稻秆为原料,分别在300 ℃和600 ℃下制备生物炭,考察热解温度对不同生物炭理化性质的影响,比较不同生物炭对溶液中Pb2+和Cd2+的吸附性能,并探讨其吸附机制。
1 实验部分
1.1 材料、试剂和仪器
芦苇、花生壳和稻秆购自江苏省南京市勤丰秸杆有限公司,经去离子水洗涤后,干燥、粉碎,过2 mm筛,备用。
Pb(NO3)2、Cd(NO3)2·4H2O:分析纯。
EA3000型元素分析仪:美国利曼公司;SmartLab-9kW型X射线衍射仪(XRD):日本理学公司;JSM6510A型扫描电子显微镜(SEM):日本电子公司; PerkinElmer Spectrum Two型傅里叶变换红外光谱仪(FTIR):美国珀金埃尔默公司;ASAP 2020 HD88型比表面积及孔径分析仪:美国麦克公司;8800型电感耦合等离子体发射光谱仪(ICP-OES):美国安捷伦公司。
1.2 生物炭的制备及表征
取一定量的生物质原料置于石英舟中,将石英舟置于管式炉内,在N2气氛下、以10 ℃/min的速率升温至一定温度(300 ℃或600 ℃),热解1 h,冷却至室温,制得不同热解温度、不同原料的生物炭。将不同温度下,芦苇、花生壳和稻秆3种原料制得的生物炭分别记作LBCt、HBCt和DBCt,其中t代表热解温度值,分别为300或600。
采用元素分析仪测定生物炭中O、H、C和N的含量;采用XRD表征生物炭的晶体结构;采用SEM观察生物炭的表面形貌;采用FTIR表征生物炭的化学组成和官能团;采用比表面积及孔径分析仪表征生物炭的比表面积和孔径分布;采用ICPOES测定生物炭中阳离子K+、Ca2+、Na+和Mg2+的含量。
将生物炭与去离子水以固液比1∶20进行混合,振荡1 h,测定pH。
将生物炭在空气中加热到750 ℃并保持6 h,冷却、称重。生物炭加热前后的质量差即为灰分含量。
1.3 吸附实验
1.3.1 吸附动力学实验
将0.05 g生物炭加入25 mL质量浓度为140 mg/L的 Pb2+(或质量浓度为80 mg/L的Cd2+)溶液中,调节初始溶液pH为5.0,置于恒温振荡箱中,在25℃、180 r/min的条件下振荡12 h,间隔一定时间取样。水样经离心分离后,取上清液,用ICP-OES测定其中Pb2+或Cd2+的质量浓度,计算吸附量。
1.3.2 吸附等温线实验
将0.05 g生物炭加入25 mL不同初始质量浓度(10~400 mg/L)的Pb2+或Cd2+溶液中,置于恒温振荡箱中,在25 ℃、180 r/min的条件下振荡24 h后,取样、离心,取上清液,用ICP-OES测定其中Pb2+或Cd2+的质量浓度,计算吸附量。
1.4 吸附机理研究
生物炭对重金属的吸附主要通过离子交换作用、矿物沉淀作用、配位作用A和配位作用B。不同吸附机理对重金属吸附量的贡献率参考文献[8]的方法进行计算。
1)由离子交换作用产生的吸附量(qexc,mg/g)。可通过生物炭吸附Pb2+或Cd2+前后溶液中阳离子的净释放量进行计算,见式(1)。
式中,qK,qCa,qNa,qMg分别为未经酸洗处理的生物炭在吸附Pb2+或Cd2+过程中由于K+、Ca2+、Na+、Mg2+的净释放而产生的吸附量,mg/g。
2)由沉淀作用产生的吸附量(qpre,mg/g)。依据式(2)~(3)进行计算。
式中:qct表示未经酸洗处理的生物炭对Pb2+或Cd2+的吸附量,mg/g;qca表示酸洗处理后的生物炭对Pb2+或Cd2+的吸附量,mg/g;Y指酸洗后生物炭的得炭率,%;qm表示生物炭中无机矿物对Pb2+或Cd2+的总吸附量,mg/g。
其中,生物炭的酸洗处理方式为:先用1 mol/L的HCl溶液冲洗,再用蒸馏水洗涤至pH恒定。此时,生物炭中的大部分矿物质被去除,但其表面官能团并不会发生变化,得到脱除了矿物质的生物炭。
3)由配位作用A产生的吸附量(qcom,mg/g)。脱除矿物质后的生物炭在吸附Pb2+或Cd2+后,溶液的pH将会降低,这是由于吸附过程中含氧官能团的配位作用所致,其反应方程式见式(4)~(5)。
因此,可以通过溶液中pH的降低程度来计算H+的释放量,进而确定配位作用A的吸附量,见式(6)。
式中,qH表示脱除矿物质后的生物炭中含氧官能团通过配位作用吸附Pb2+或Cd2+的量,mg/g。
4)由配位作用B产生的吸附量(qπ,mg/g)。可通过式(7)进行计算。
2 结果与讨论
2.1 生物炭的表征
2.1.1 元素组成
不同生物炭的元素含量见表1。

表1 不同生物炭的元素含量
由表1可见:热解温度为600 ℃时,生物炭中H与C的摩尔比(H/C)、O与C的摩尔比(O/C)、O和N与C的摩尔比(O+N)/C均较小,表明热解温度越高,生物炭中含氧官能团的数量越少,越容易形成稳定的芳香结构,亲水性减弱;随着热解温度的升高,灰分含量逐渐增大,这是因为高温热解使生物质中的有机成分得到有效分解,Ca、Mg等无机成分进一步浓缩。
2.1.2 孔结构参数
生物炭对重金属的吸附性能与其孔结构参数紧密相关,不同生物炭的孔结构参数见表2。由表2可见:热解温度为600 ℃时,所制得生物炭的平均孔径较小,比表面积较大;3种生物炭相比较,DBC600的比表面积最大,为90.67 m2/g,HBC600次之,为15.98 m2/g,LBC600最小,仅为2.81 m2/g。
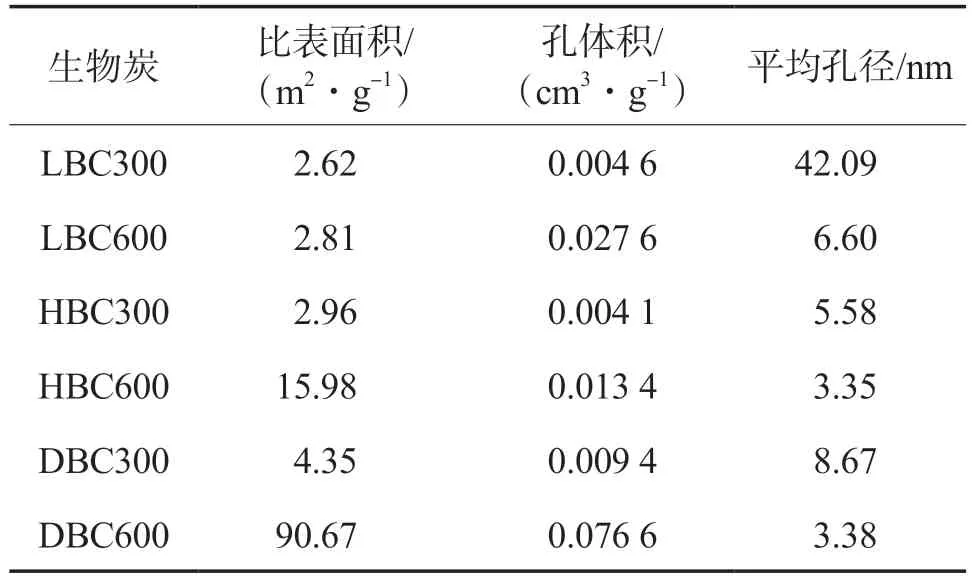
表2 不同生物炭的孔结构参数
2.1.3 SEM
图1为LBC600、HBC600和DBC600吸附Pb2+或Cd2+前后的SEM照片。由图1可见:3种生物炭在吸附重金属前,其表面均呈现不规则的多孔结构;吸附Pb2+或Cd2+后,3种生物炭的表面均附着有白色颗粒状晶体。

图1 60 ℃制备的3种生物炭吸附Pb2+或Cd2+前后的SEM照片
2.1.4 FTIR
图2为LBC600、HBC600和DBC600吸附Pb2+或Cd2+前后的FTIR谱图。由图2可见:波数为3 295,3 301 cm-1处的吸收峰归属于羟基的O—H振动[9],吸附Pb2+或Cd2+后,其强度显著降低,表明羟基参与了对Pb2+或Cd2+的吸附;LBC600、HBC600在波数为2 886,2 896 cm-1处的吸收峰归属于芳香族基团的C—H键[10],在吸附Pb2+或Cd2+后,该特征峰消失,表明芳香族基团的—CH可能参与了对Pb2+或Cd2+的吸附;1 664,1 658 cm-1处的吸收峰归属于羧基中C=O键的拉伸振动[11],在吸附Pb2+或Cd2+后,其强度显著降低,表明生物炭表面的羧基参与了吸附;1 422,1 409 cm-1处的吸收峰为羧基和醛基的特征峰[12],吸附Pb2+或Cd2+后,其强度同样有所减弱;1 102~1 173 cm-1处的吸收峰可能是由于生物炭灰分中所包含的PO43-中的P—O的拉伸振动或表面官能团C—O醚键的拉伸振动引起的[13-14];750~890 cm-1处的吸收峰归属于Si—O—Si的对称拉伸[15],表明吸附过程中形成了金属硅酸盐沉淀。

图2 60 ℃制备的不同生物炭吸附Pb2+或Cd2+前后的FTIR谱图
2.1.5 XRD
图3为LBC600、HBC600和DBC600吸附Pb2+或Cd2+前后的XRD谱图。

图3 60 ℃制备的不同生物炭吸附Pb2+或Cd2+前后的XRD谱图
由图3可见:吸附Pb2+或Cd2+后,3种生物炭的XRD谱图中均出现了多个新的衍射峰,表明有新物质生成;2θ为19.98°、20.98°和24.83°处的衍射峰归属于Pb3(PO4)2或Cd3(PO4)2;2θ为27.31°、34.14°和44.21°处的衍射峰归属于PbCO3或CdCO3;2θ为49.05°处的衍射峰可能归属于Pb2SiO4或Cd2SiO4,也可能归属于Pb(OH)2或Cd(OH)2;2θ为58.38°处的衍射峰归属于PbP2或CdP2;2θ为54.02°和60.38°处的衍射峰归属于铅羟基磷灰石(Pb5(PO4)3OH),这可能是由于生物炭中的矿物质和磷酸盐等参与了吸附过程,与重金属发生表面沉淀或表面配位作用[13,16-17]。
2.2 生物炭对Cd2+和Pb2+的吸附特性
2.2.1 吸附动力学
采用准一级动力学模型和准二级动力学模型分别对不同生物炭吸附Pb2+和Cd2+的动力学过程进行拟合,结果见表3和表4。由表3和表4可见:准二级动力学模型拟合的R2值整体比准一级动力学模型拟合的更高,表明准二级动力学模型能够更好地描述生物炭对Pb2+和Cd2+的吸附动力学过程;与其他生物炭相比,DBC600对Pb2+和Cd2+的实测qe最大,分别为66.86 mg/g和33.99 mg/g,表明DBC600的吸附性能较好。
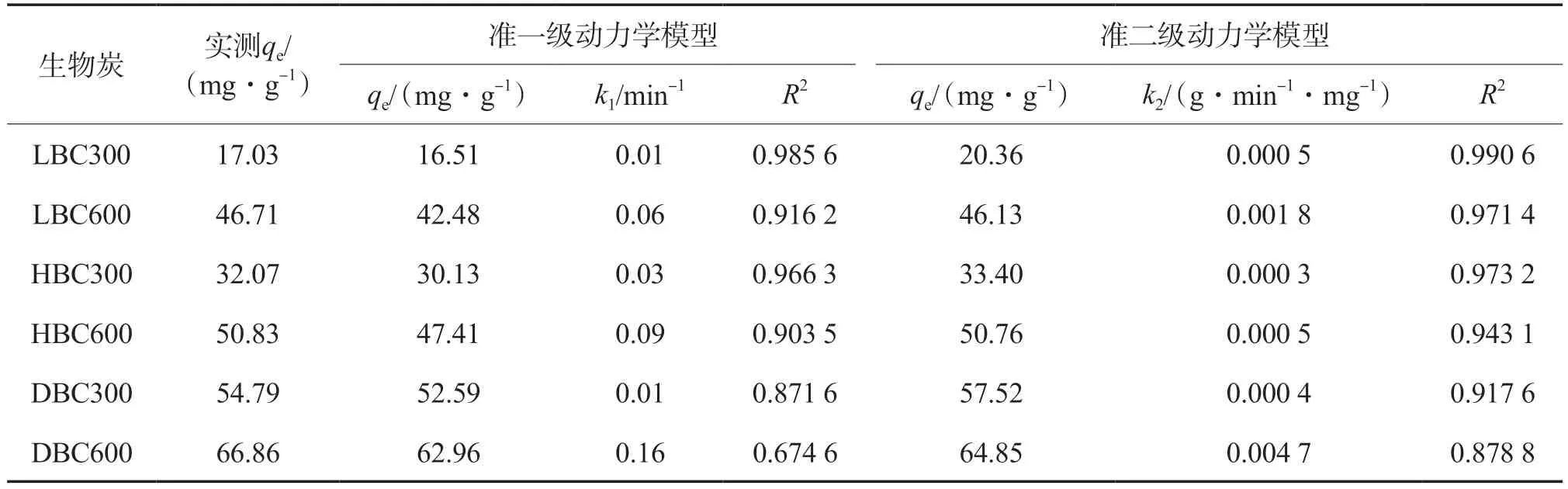
表3 不同生物炭对Pb2+的吸附动力学模型拟合结果
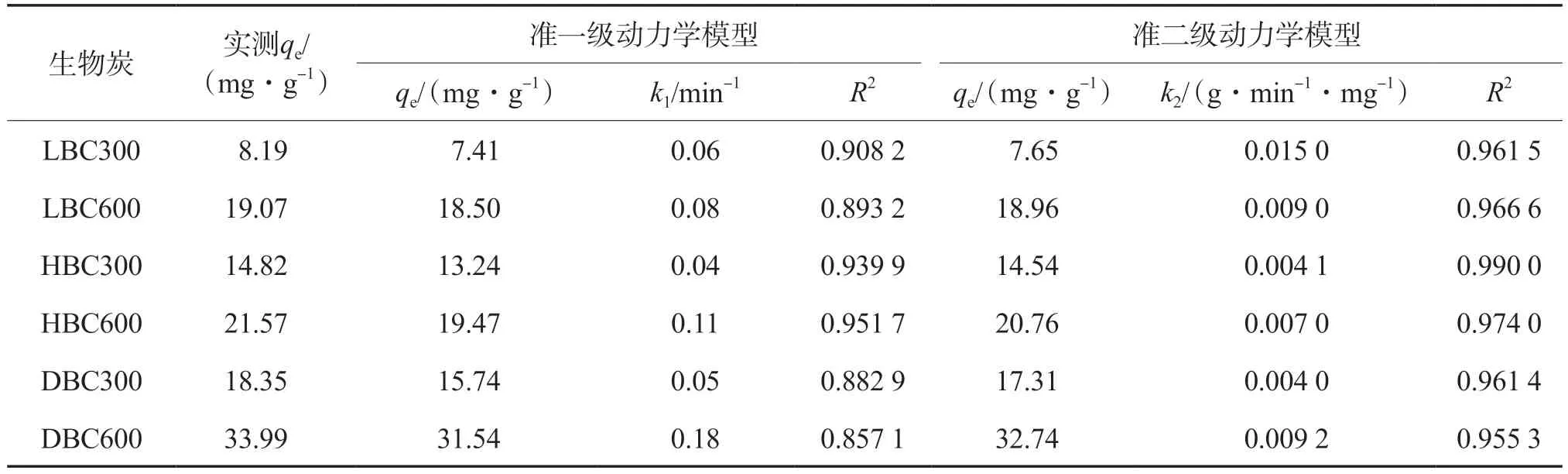
表4 不同生物炭对Cd2+的吸附动力学模型拟合结果
2.2.2 吸附等温线
用Langmuir和Freundlich等温吸附模型分别对不同生物炭吸附Pb2+和Cd2+的过程进行拟合,结果见表5和表6。由表5和表6可见:Langmuir模型拟合的R2值明显高于Freundlich模型,即3种生物炭对Pb2+和Cd2+的吸附更符合Langmuir模型,表明3种生物炭对Pb2+和Cd2+的吸附属于化学吸附,且该吸附为单层吸附;不同热解温度下所制备的生物炭对Pb2+和Cd2+的qsat不同,热解温度越高,qsat越大,如DBC600对Pb2+的qsat为91.06 mg/g,比DBC300(73.04 mg/g)提高了24.7%,DBC600对Cd2+的qsat为44.15 mg/g,比DBC300(19.55 mg/g)提高了125.8%。

表5 不同生物炭对Pb2+的等温吸附模型拟合结果
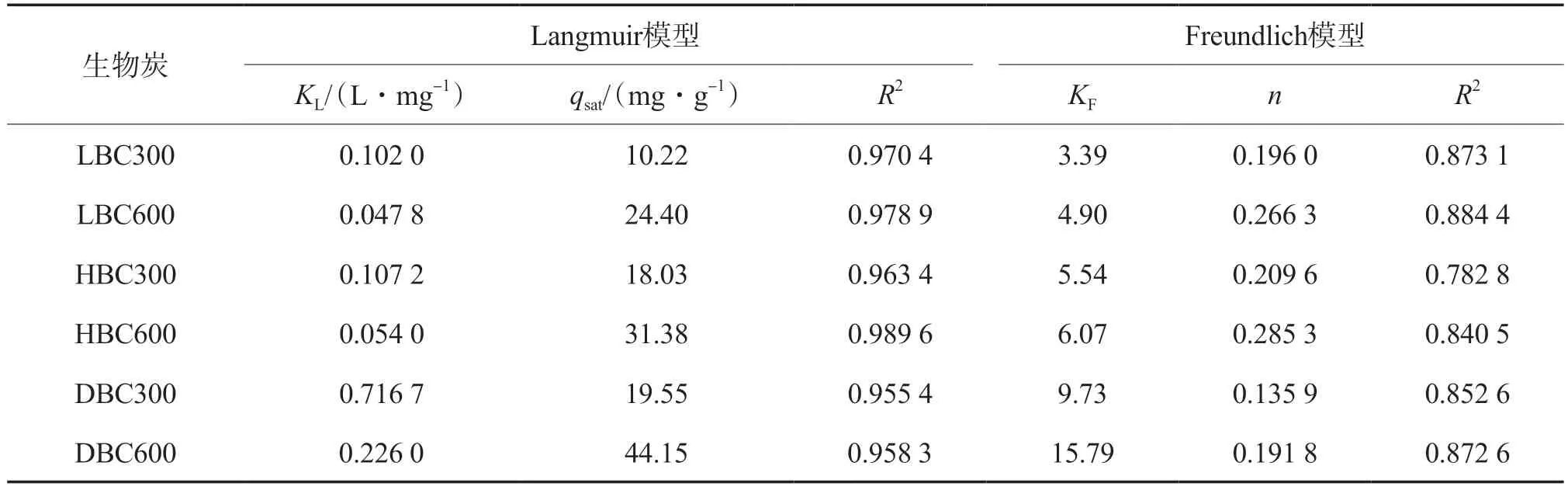
表6 不同生物炭对Cd2+的等温吸附模型拟合结果
2.2.3 吸附热力学
根据式(8)和式(9)[18]计算298.15 K条件下,3种生物炭对Pb2+和Cd2+的吸附热力学参数。
式中:K为标准平衡常数,L/mg;ρ0和ρe分别为Pb2+或Cd2+溶液的初始质量浓度和平衡质量浓度,mg/L;V为溶液体积,L;m是生物炭的质量,g;ΔG为标准吉布斯自由能变,kJ/mol;R为理想气体常数,8.314 J/(mol·K);T为热力学温度,K。
不同生物炭吸附Pb2+和Cd2+的热力学参数见表7。由表7可见:在298.15 K下,不同生物炭吸附Pb2+和Cd2+的ΔG均小于0,表明该吸附过程为自发的;热解温度为600 ℃时,3种生物炭对Pb2+和Cd2+吸附过程的ΔG较热解温度为300 ℃的ΔG有所降低;LBC600、HBC600和DBC600吸附Pb2+过程的ΔG比LBC300、HBC300和DBC300分别降低了4.54,2.83,4.41 kJ/mol;LBC600、HBC600和DBC600吸附Cd2+过程的ΔG比LBC300、HBC300和DBC300分别降低了3.13,1.71,4.71 kJ/mol;此外,在同一热解温度下制备的3种生物炭吸附Pb2+和Cd2+的ΔG均呈LBC>HBC>DBC的趋势,表明与LBC和HBC相比,DBC更易于吸附Pb2+和Cd2+[19]。
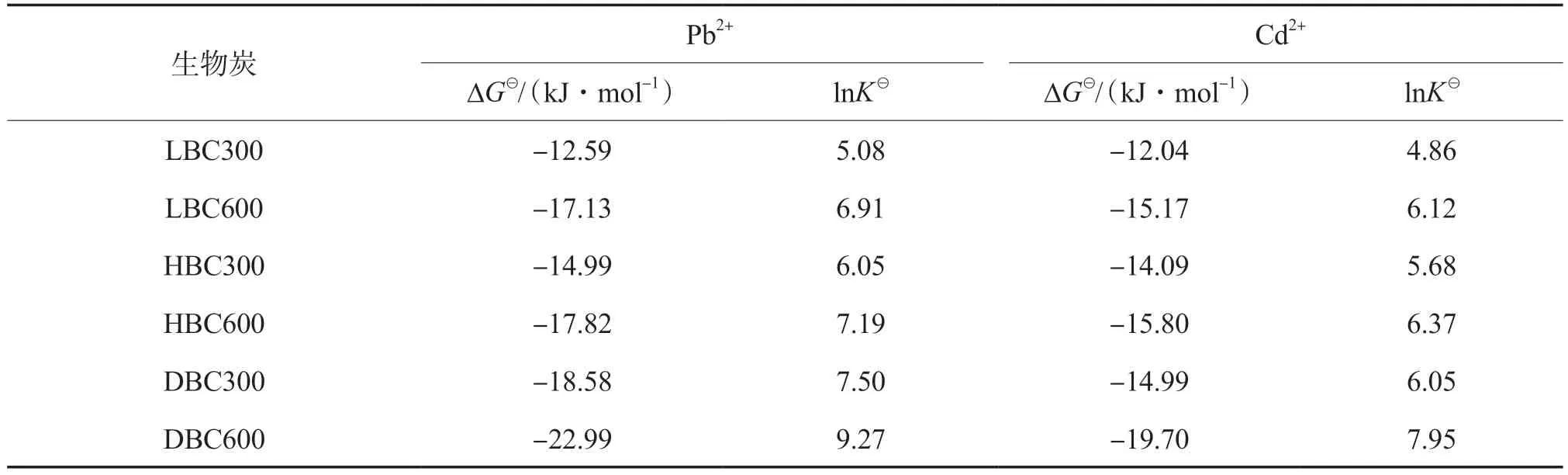
表7 不同生物炭吸附Pb2+和Cd2+热力学参数
2.3 吸附机理分析
离子交换作用、矿物沉淀作用、配位作用A和配位作用B 4种吸附机理对Pb2+和Cd2+吸附量的贡献率见表8和表9。由表8可见:LBC300对Pb2+的吸附以矿物沉淀作用和离子交换作用为主,二者对Pb2+吸附量的贡献率达87.6%,热解温度为600 ℃时,LBC600对Pb2+的吸附以矿物沉淀作用和配位作用B为主,离子交换作用和配位作用A减弱;HBC300对Pb2+吸附量的贡献率依次为离子交换作用>矿物沉淀作用>配位作用A>配位作用B,其中配位作用B的贡献率仅为3.7%,热解温度为600 ℃时,矿物沉淀作用的贡献率最大,为65.6%,离子交换作用和配位作用A减弱,配位作用B加强;DBC300对Pb2+的吸附以矿物沉淀作用和离子交换作用为主,热解温度为600 ℃时,矿物沉淀作用进一步增强,离子交换作用和配位作用A减弱,配位作用B加强。由表9可见:不同生物炭对Cd2+吸附作用机理的变化情况与Pb2+相同。
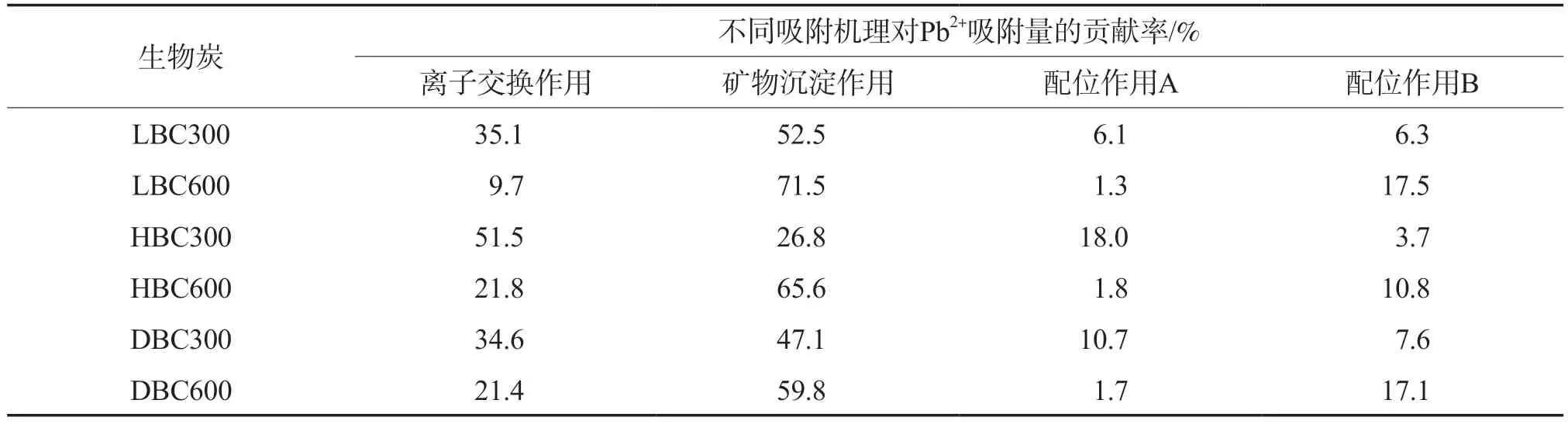
表8 不同吸附机理对Pb2+吸附量的贡献率

表9 不同吸附机理对Cd2+吸附量的贡献率
综上,对LBC600、HBC600 和DBC600 3种高温热解生物炭而言,矿物沉淀作用是吸附Pb2+和Cd2+的主要机理;对LBC300、HBC300和DBC300 3种低温热解生物炭而言,离子交换作用在Pb2+和Cd2+的吸附过程中也起重要作用,特别是对HBC300,离子交换作用占主导地位;随着热解温度的升高,离子交换作用对Pb2+和Cd2+吸附量的贡献率逐渐减小,配位作用B所占的贡献率逐渐增大;配位作用A在3种高温热解生物炭吸附Pb2+和Cd2+过程所占的贡献率均很小,这是因为随着热解温度的升高,生物炭表面的官能团数量逐渐降低。
3 结论
a)准二级动力学模型和Langmuir等温吸附模型能够更好地拟合不同生物炭对Pb2+和Cd2+的吸附过程,3种生物炭对Pb2+和Cd2+的吸附均为化学吸附;生物炭对Pb2+和Cd2+的吸附性能受原料种类和热解温度的影响,3种生物炭对Pb2+和Cd2+吸附能力的大小顺序为DBC>HBC>LBC,相比较而言,高温热解条件下制备的生物炭吸附Pb2+和Cd2+的性能更好;25 ℃时,DBC600对Pb2+和Cd2+的qsat分别达到了91.06 mg/g和44.15 mg/g。
b)不同生物炭吸附Pb2+和Cd2+过程的ΔG均小于0,表明该吸附过程为自发的。
c)3种生物炭吸附Pb2+和Cd2+的主要机理为矿物沉淀作用和离子交换作用,随着热解温度的升高,离子交换作用对Pb2+和Cd2+吸附量的贡献率逐渐减小,配位作用B的贡献率逐渐增大;配位作用A在3种高温热解生物炭吸附Pb2+和Cd2+过程中的贡献率均很小。

