毛竹生物炭磁性材料对孔雀石绿染料的超声吸附
高海荣,田佳文,张贾慧,赵爱娟,荆岩岩,董远芳
(郑州师范学院 化学化工学院,河南 郑州 450044)
随着染料行业规模逐渐扩大,染料污染愈发严重。工业染料主要为三苯甲烷、偶氮和蒽醌类物质,具有毒性强、生物降解难、色度高、COD高等特点[1-2]。孔雀石绿(MG)是一种抗生素类兽药,属于三苯甲基类染料,常被用作杀菌剂、杀虫剂和防腐剂[3]。MG进入人体或动物体内后,具有致突变、致畸和致癌的风险[4-5]。
目前染料废水的处理方法主要有电化学法、化学氧化法、化学混凝法、生物法、吸附法、膜分离法、磁分离法等[6],其中吸附法应用范围较广。近年来,以废弃物为原料制备生物炭,应用于水体染料污染处理引起了广大学者的关注。YU等[7]利用湿法烘烤制备了微藻生物炭用于废水中亚甲基蓝和刚果红的去除,微藻生物炭对亚甲基蓝和刚果红的最大吸附量分别为113.00 mg/g和164.35 mg/g。LOULIDI等[8]采用氢氧化钾化学活化法制备了咖啡渣生物炭,对结晶紫染料的吸附容量远高于对重金属铬的吸附容量。江汝清等[9]通过静态吸附实验对比分析了酸改性前后猪粪生物炭对直接红23染料的吸附效果,发现改性后生物炭脱色性能更优,其对染料的最大吸附量可达111.51 mg/g。但是,传统生物炭吸附剂与染料废水混合后难以分离,通常要通过离心过滤等辅助手段实现分离,大大降低了染料废水的处理效率。而磁化后的生物炭不仅保留了生物炭的高吸附容量,还能磁分离回收。ZHANG等[10]采用热解法以赤泥和柚子皮为原料制备了Fe/Fe氧化物负载生物炭,该磁性生物炭在磁场作用下易从处理过的水中分离出来。LI等[11]以辣木籽壳和Fe3O4为原料制备了磁性辣木籽壳材料,对亚甲基蓝的最大吸附量可达219.60 mg/g。
毛竹在我国多数省份均有生长,但其有效利用率仅有35%~40%[12]。本实验以毛竹为原料制备毛竹生物炭(PEC),采用共沉淀法制备了毛竹生物炭磁性材料(Fe3O4@PEC),考察了Fe3O4@PEC在超声条件下对废水中孔雀石绿染料的吸附去除能力,确定最佳吸附工艺条件,考察循环利用效率,以期为水体染料污染的绿色治理提供新路径。
1 实验部分
1.1 原材料、试剂及仪器
毛竹采自河南信阳,将其劈开,切成小段,用自来水清洗、烘干,用粉碎机粉碎、过筛备用。孔雀石绿、亚甲基蓝、FeCl3·6H2O、FeSO4·7H2O、盐酸、氢氧化钠、磷酸、冰醋酸、甲醇均为分析纯。
T6新世纪型紫外-可见分光光度计(北京普析通用仪器有限责任公司);KQ-500DE型超声仪(昆山市超声仪器有限公司);101-0EBS型电热鼓风干燥箱(北京市永光明医疗仪器有限公司);H1850型高速离心机(湖南湘仪实验室仪器开发有限公司);SX-4-10型马弗炉(北京市永光明医疗仪器有限公司);PHS-3D 型pH计(上海仪电科学仪器股份有限公司);HWJB-2100C型恒温磁力搅拌器(郑州碳邦仪器有限公司)。
1.2 Fe3O4@PEC的制备
1.2.1 PEC的制备
称取2.5 g毛竹粉末,与体积分数50%的磷酸溶液以1∶3(g/mL)的固液比于瓷坩埚内混合,活化24 h后置于500 ℃马弗炉中碳化3 h,得到PEC。洗涤、烘干,过80目筛备用。
1.2.2 Fe3O4@PEC的制备
准确称取1.633 6 g FeCl3·6H2O和1.658 8 g FeSO4·7H2O溶解于30 mL去离子水中,搅拌0.5 h使溶液充分混匀;再加入0.4 g PEC搅拌1 h后,将混合液升温至60 ℃恒温搅拌0.5 h;滴加氢氧化钠溶液至混合液pH为11,将混合液升温至80 ℃恒温搅拌1 h;取出固体物用去离子水淋洗至中性,烘干,即得到Fe3O4@PEC。
1.3 分析表征
采用650S型红外光谱仪(Thermo Nicolet 公司)表征样品的表面官能团;采用Ultima-Ⅳ型X射线衍射分析仪(日本理学株式会社)表征样品的物相结构;采用Gemini300型场发射扫描电子显微镜(牛津仪器上海有限公司)观测样品的表面形貌;采用Autosorb iQ型比表面分析仪(美国康塔仪器公司)测定样品的比表面积和孔径。
1.4 Fe3O4@PEC对孔雀石绿染料的超声吸附实验
取50 mL一定质量浓度的孔雀石绿染料溶液置于250 mL锥形瓶内,用盐酸或氢氧化钠溶液调节溶液pH至一定值,加入一定量的Fe3O4@PEC,在一定温度、一定的超声功率下吸附一段时间后,对溶液进行磁分离,再离心分离;取上清液,在紫外-可见分光光度计下测定残留的孔雀石绿浓度,计算Fe3O4@PEC对孔雀石绿的吸附率及吸附量。
2 结果与讨论
2.1 材料的表征结果
2.1.1 FTIR
PEC、Fe3O4及Fe3O4@PEC的FTIR谱图见图1。由图1可以看出:PEC在3 400 cm-1处的吸收峰归属于—OH的伸缩振动,1 620 cm-1和1 132 cm-1处的吸收峰归属于C=O和C—O—C的伸缩振动;Fe3O4在620 cm-1处的峰归属于Fe—O的伸缩振动;Fe3O4@PEC在3 420,1 620,1 132 cm-1处的峰归属于—OH、C=O和C—O—C的伸缩振动,与PEC特征吸收峰一致,且在620 cm-1处的峰与Fe3O4的Fe—O特征吸收峰一致,说明Fe3O4@PEC制备成功。
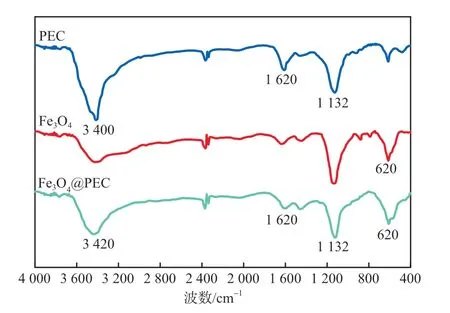
图1 PEC、Fe3O4和Fe3O4@PEC的FTIR谱图
2.1.2 XRD
PEC、Fe3O4和Fe3O4@PEC的XRD谱图见图2。由图2可知,Fe3O4@PEC在2θ为30.30°,35.56°,43.25°,57.16°,62.90°处出现了5个特征峰,与Fe3O4标准谱图的晶面相对应[13],且与Fe3O4特征衍射峰的位置一致,证明Fe3O4被成功负载在PEC上。将Fe3O4@PEC与PEC进行对比发现,Fe3O4@PEC在2θ为23.72°处PEC的特征衍射峰消失,而在此处出现一个小的鼓包峰,这可能是因为Fe3O4的引入使PEC的有效堆积受到破坏而导致衍射峰消失。
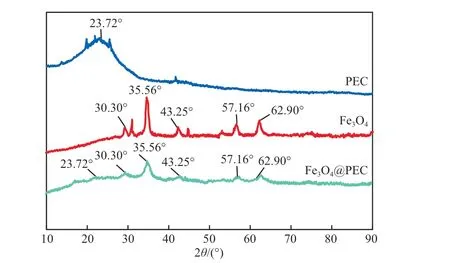
图2 PEC、Fe3O4和Fe3O4@PEC的XRD谱图
2.1.3 SEM
Fe3O4@PEC的SEM照片见图3。由图3a可见,赋磁化对PEC表面影响较大,在Fe3O4@PEC表面能看到许多小颗粒物,可能为Fe3O4,表明Fe3O4成功负载于PEC上;进一步放大后(见图3b)发现,Fe3O4@PEC具有蜂窝状的表面和较多的孔隙结构,有利于其对染料的吸附。

图3 Fe3O4@PEC的SEM照片
2.1.4 比表面积和孔结构
Fe3O4@PEC的N2吸附-脱附等温线和孔径分布曲线见图4。由图4a可见,Fe3O4@PEC的N2吸附-脱附等温线为经典的Ⅳ型,具备经典的H3滞后回线[14],表明Fe3O4@PEC为介孔结构。由图4b可见,Fe3O4@PEC的孔径分布集中在19 nm左右,这充分证实了Fe3O4@PEC的结构为介孔状。Fe3O4@PEC的比表面积为402.978 m2/g;总孔体积为0.567 3 cm3/g。这说明经过Fe3O4磁化后的Fe3O4@PEC具有较大的比表面积和孔体积,能够提供较多的吸附位点,具有较好的吸附性能。
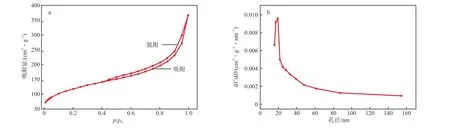
图4 Fe3O4@PEC的N2吸附-脱附等温线(a)及孔径分布曲线(b)
2.1.5 Fe3O4@PEC的磁分离性能
Fe3O4@PEC的磁分离照片见图5。由图5可见:无磁场时Fe3O4@PEC颗粒在水中均匀分散;有磁场时Fe3O4@PEC迅速在磁铁一侧聚集,表明Fe3O4@PEC具备良好的磁分离性能,能够回收利用。

图5 Fe3O4@PEC的磁分离照片
2.2 Fe3O4@PEC超声吸附孔雀石绿染料的性能
2.2.1 溶液pH对吸附性能的影响
在孔雀石绿质量浓度为40 mg/L、Fe3O4@PEC加入量为0.4 g/L、超声功率为350 W、超声温度为30 ℃、超声吸附时间为10 min的条件下,溶液pH对 Fe3O4@PEC吸附孔雀石绿性能的影响见图6。由图6可见:随着溶液pH升高,吸附率呈现先升高后降低的趋势。碱性条件下吸附率高于酸性条件下,这可能是因为孔雀石绿是阳离子染料,酸性较强时,过多的H+会和孔雀石绿阳离子争夺吸附位点,导致吸附率降低;随着pH升高,溶液中OH-含量增加,OH-使Fe3O4@ PEC表面去质子化,增强了吸附效果;溶液pH为6.5时吸附率最高,pH过高也不利于吸附。这可能是因为碱性较强时,溶液中的OH-会与孔雀石绿分子的氨基结合[15],或是OH-与孔雀石绿阳离子间形成氢键抑制其被吸附。故本实验选择溶液pH为6.5。
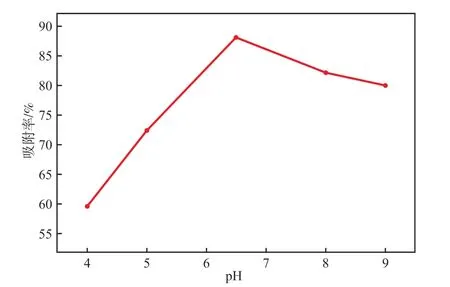
图6 溶液pH对Fe3O4@PEC吸附性能的影响
2.2.2 Fe3O4@PEC加入量对吸附性能的影响
在孔雀石绿质量浓度为40 mg/L、超声功率为350 W、超声温度为30 ℃、溶液pH为6.5、超声吸附时间为10 min的条件下,Fe3O4@PEC加入量对其吸附性能的影响见图7。由图7可见:随着Fe3O4@PEC加入量的增加,吸附率升高,这是因为随着吸附剂加入量的增加,会提供更大的吸附表面积及更多的表面官能团;随Fe3O4@PEC加入量增加,吸附量降低是因为在孔雀石绿浓度固定的情况下,过多的吸附位点得不到充分利用,或者是活性位点的重叠降低了孔雀石绿的有效接触面积所导致的[16]。当Fe3O4@PEC加入量为0.4 g/L时,吸附率为88.12%,此时也有较好的吸附量。基于高吸附率和吸附量的保障以及节约吸附剂的综合考虑,本实验选择Fe3O4@PEC加入量为0.4 g/L。
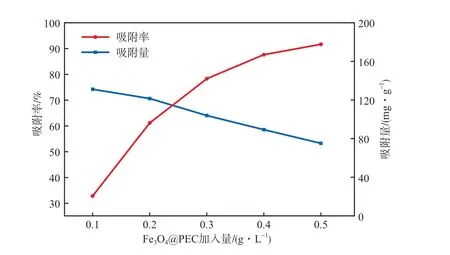
图7 Fe3O4@PEC加入量对其吸附性能的影响
2.2.3 超声吸附时间对吸附性能的影响
在孔雀石绿质量浓度为40 mg/L、Fe3O4@PEC加入量为0.4 g/L、超声功率为350 W、超声温度为30 ℃、溶液pH为6.5的条件下,超声吸附时间对吸附性能的影响见图8。
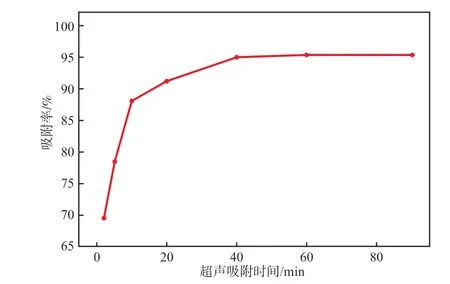
图8 超声吸附时间对Fe3O4@PEC吸附性能的影响
由图8可见:随着超声吸附时间的延长,吸附率升高;0~10 min为吸附初期,吸附速率快,吸附率突增,该时段为孔雀石绿分子的膜扩散过程;10~40 min为吸附中期,吸附率增加较慢,该时段为孔雀石绿分子孔隙扩散的过程;40 min后为吸附后期,吸附基本达到平衡,吸附率变化不明显。故本实验选择超声吸附时间为40 min。
2.2.4 超声功率对吸附性能的影响
在孔雀石绿质量浓度为40 mg/L、Fe3O4@PEC加入量为0.4 g/L、超声温度为30 ℃、超声吸附时间为40 min、溶液pH为6.5的条件下,超声功率对吸附性能的影响见图9。由图9可见:随着超声功率的升高,吸附率呈现上升趋势,这是因为超声功率升高,加快了孔雀石绿分子的运动活性,导致其与Fe3O4@PEC的碰撞速率加快,提高了分子间的接触效率,从而使吸附率逐渐升高[17];当超声功率大于350 W后,吸附率稍有下降,可能是因为过高的超声功率会将吸附剂上的染料部分解吸出来,故本实验选择超声功率为350 W。
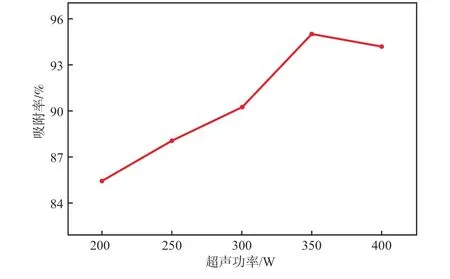
图9 超声功率对Fe3O4@PEC吸附性能的影响
2.2.5 超声温度对吸附性能的影响
在孔雀石绿质量浓度为40 mg/L、Fe3O4@PEC加入量为0.4 g/L、超声功率为350 W、超声吸附时间为40 min、溶液pH为6.5的条件下,超声温度对吸附性能的影响见图10。由图10可见:随着超声温度的升高,吸附率升高,但总体影响不大;超声温度由20 ℃升至30 ℃时,吸附率明显升高,这是因为超声温度升高,一方面可以加快孔雀石绿分子的运动,增加其与Fe3O4@PEC接触的概率,另一方面可以使孔雀石绿溶液黏度降低,加快孔雀石绿从Fe3O4@PEC表层到孔径内部的扩散,使吸附率升高;当超声温度高于30 ℃后,吸附率趋于稳定。故本实验选择超声温度为30 ℃。
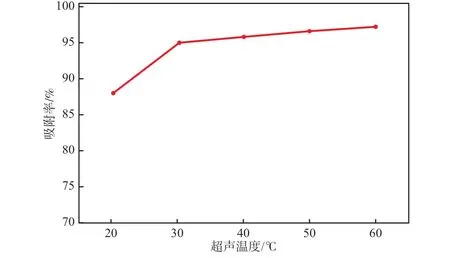
图10 超声温度对Fe3O4@PEC吸附性能的影响
2.2.6 小结
综上所述,采用Fe3O4@PEC超声吸附处理孔雀石绿染料废水的最佳工艺条件为孔雀石绿质量浓度40 mg/L、溶液pH 6.5、吸附剂Fe3O4@PEC加入量0.4 g/L、超声吸附时间40 min、超声温度30 ℃、超声功率350 W。最佳条件下对孔雀石绿的吸附率高达95.01%。
2.3 Fe3O4@PEC的重复利用性能
将吸附过孔雀石绿的Fe3O4@PEC利用磁场进行回收,用体积比为1∶10的冰醋酸和甲醇混合液浸泡2 h,并于超声仪中超声洗脱10 min,重复2~3次,再用蒸馏水洗至中性,烘干后重复用于孔雀石绿的吸附实验,Fe3O4@PEC的重复利用性能见图11。
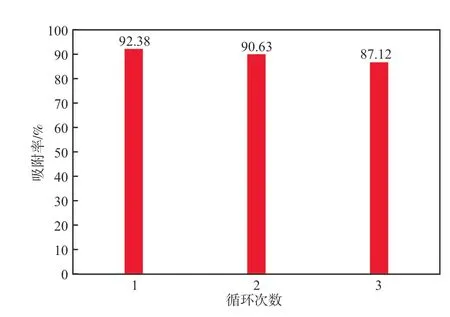
图11 Fe3O4@PEC的重复利用性能
由图11可见,随着重复使用次数增加,吸附率略有降低,但仍具有较强的吸附作用。循环使用3次后吸附率仍可达87.12%,显示Fe3O4@PEC具有一定的回收利用价值。
2.4 吸附动力学模型
为阐明Fe3O4@PEC对孔雀石绿的吸附动力学过程,采用准一级和准二级动力学模型拟合动力学数据,拟合结果见表1。R2数值表明,Fe3O4@PEC对孔雀石绿的吸附符合准二级动力学模型,表明该吸附过程以吸附剂与染料分子间配位交换及静电吸引等反应的化学吸附为主[18]。

表1 动力学模型的拟合结果
2.5 等温吸附模型
采用Langmuir和Freundlich等温吸附模型拟合等温吸附数据(298.15 K),拟合结果见表2。Langmuir模型的R2高于Freundlich模型,表明吸附过程属于单分子层吸附机理[19]。
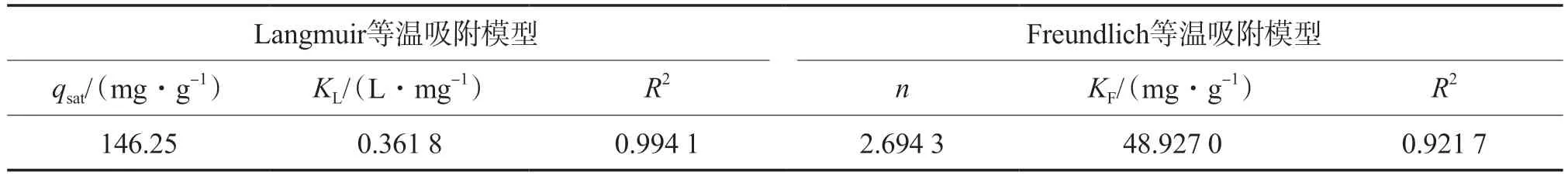
表2 等温吸附模型的拟合结果
3 结论
a)采用共沉淀法制备了Fe3O4@PEC,对其进行结构表征,验证了其磁性分离性能。
b) 采用Fe3O4@PEC超声吸附处理孔雀石绿染料废水的最佳工艺条件为孔雀石绿质量浓度40 mg/L、溶液pH 6.5、吸附剂Fe3O4@PEC加入量0.4 g/L、超声吸附时间40 min、超声温度30 ℃、超声功率350 W。最佳条件下对孔雀石绿的吸附率高达95.01%。
c) 重复利用3次后,Fe3O4@PEC对孔雀石绿的吸附率仍可达87.12%。
d) Fe3O4@PEC对孔雀石绿的吸附符合准二级动力学模型,表明该吸附过程以吸附剂与染料分子间配位交换及静电吸引等反应的化学吸附为主。等温吸附模型更符合Langmuir模型,表明吸附过程属于单分子层吸附机理。

