儿童急性淋巴细胞白血病的代谢组学及外显子组学研究
王 翔,徐煜皓,孙 宇,陆 超
南京医科大学第一附属医院儿科,江苏 南京 210029
急性淋巴细胞白血病(acute lymphoblastic leu-kemia,ALL)是儿童最常见的癌症类型,占所有白血病的70%~80%,约占儿童癌症的27.3%[1]。ALL 以未成熟前体细胞克隆性增殖为特征,进展迅速,通常出现时无明显前驱症状[2]。ALL是在多种因素共同作用下发生的。目前的研究大多集中在蛋白质成分上,对微环境代谢组如何影响肿瘤存活知之甚少[3]。
代谢组学是对细胞、生物体液、组织或生物体内低分子量(<1 kDa)的内源性小分子(通常称为代谢物)的大规模研究。代谢组学与基因组学、转录组学和蛋白质组学一起,在生理和病理过程中推动基因型和表型之间的联系,成为生物标志物发现、药物开发和个性化医疗的有力工具[4]。代谢组学研究诊断许多疾病的重要性已经被证明,如白血病、卵巢癌、食管癌、口腔癌、乳腺癌和前列腺癌等[5]。本研究拟利用广泛靶向代谢组学技术和外显子测序技术分析,找到ALL 患者血清代谢组学的改变,寻找与ALL 相关的潜在代谢生物标志物及基因改变以指导临床。
1 对象和方法
1.1 对象
选取2021年9月—2022年5月首次在南京医科大学第一附属医院儿科就诊的初发且未经治疗的ALL 患儿4 例为ALL 组,选取同期在本院进行体检的健康儿童4例为对照组。由于代谢产物受多种因素的影响,除疾病本身外,如患者饮食习惯、合并症和药物使用情况等均可能对实验结果产生影响,在选取病例时参照以下标准:①ALL患儿为初发患者,尚未接受化疗药物治疗;②无代谢性疾病及其他血液性疾病;③无长期服用药物病史。本研究通过南京医科大学第一附属医院伦理委员会审核(2017-SRFA-091),在研究对象签署知情同意书的基础上,进行血样的采集。
乙腈、甲醇、Formic acid(Millipore 公司,美国);氨水(Merck 公司,美国);乙酸铵(Sigma 公司,美国)。质谱仪(AB SCIEX公司,美国);超高压液相色谱仪(Shimadzu公司,日本);色谱柱(Waters公司,美国);超声波系统(Diagenode 公司,比利时);真空离心浓缩仪、离心机(Eppendorf公司,德国);可见紫外分光光度计(Thermo公司,美国)。
1.2 方法
1.2.1 血清代谢物提取
收集血清样本,每个样本各取100 μL,加入100 μL 预冷的水和800 μL 甲醇/乙腈(2∶2,V/V),涡旋混合,冰浴中超声30 min,-20 ℃静置过夜,16 000g4 ℃离心30 min,取上清,上清在高速真空浓缩离心机挥干,样本复溶于100 μL 50%甲醇水溶液中,20 000g4 ℃离心30 min,取上清液以备质谱进样分析。
1.2.2 LC-MS检测
整个分析过程中样品置于4 ℃自动进样器中,样品采用Shimadzu Nexera X2 LC-30AD 超高效液相色谱系统(UHPLC)使用HSS T3 色谱柱进行分离。其中进样量5 μL,柱温40 ℃,流速0.2 mL/min;色谱流动相A为0.1%甲酸水溶液,B为乙腈。
每例样品分别采用电喷雾电离(electrospray ionization,ESI)进行正离子(+)和负离子(-)模式检测。样品经UPLC 分离后用QTRAP 5500 质谱仪进行质谱分析,使用HESI 源进行离子化。采用MRM模式检测待测离子对。
1.3 统计学方法
两组间数据利用多元变量统计分析,包括主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares discrimination analysis,PLS-DA)、正交偏最小二乘判别分析(OPLS-DA)和单变量统计分析(Student’s-t检验和火山图)进行联合分析,本项目使用的卡值标准为P<0.05,同时OPLS-DA 模型第一主成分的变量投影重要度(variable Importance for the projection,VIP)>1。以倍数变化(fold change,FC)代表ALL 组与对照组的代谢物含量比值,选取FC≥1.5或FC≤0.5变化水平的差异代谢物,然后根据京都基因和基因组百科全书数据库(Kyoto encyclopedia of genes and genomes,KEGG)进行差异代谢物通路分析以确定显著变化的代谢途径。
2 结果
2.1 标本质量检测
广泛靶向代谢组学标准品正负离子模式下提取离子流色谱图(extracted ion chromatogram,EIC 或XIC),从图中可见各代谢物色谱峰分离较好,峰形尖锐对称,能够对各代谢物进行质谱定量(图1)。
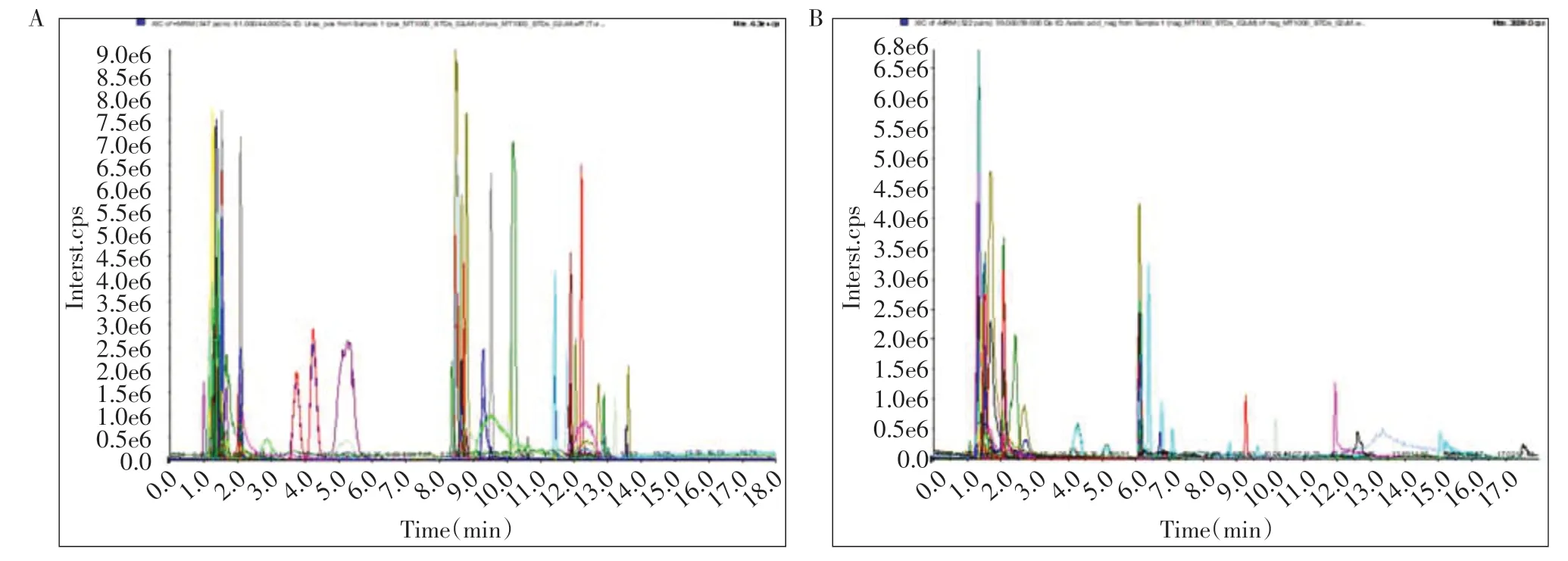
图1 标准品混合物XIC图谱Figure 1 XIC pattern of standard mixtures
2.2 代谢组学分析
2.2.1 PCA、PLS-DA和OPLS-DA分析
将ALL 组和对照组的血清代谢物进行PCA 分析。结果显示(图2),第一主成分(PC1)的贡献率为29.92%,第二主成分(PC2)的贡献率为15.58%,两组样本表现出明显的分离趋势。图3A 为比对组的PLS-DA得分图,两组间差异明显,图3B为比对组的PLS-DA 置换检验图,200 次置换检验未发生拟合。模型评价参数见表1。比对组的R2X 为0.605,R2Y为1,Q2 为0.958,表明本次质谱检测模型的稳定性及预测能力均较好。图3C、D为OPLS-DA的模型验证,进行200次置换检验,实验数据建立的OPLS-DA模型未发生过拟合,代表模型非常可靠。上述结果表明,ALL和对照组的模型稳定性和预测性较好,可用于后续差异代谢物的筛选。

表1 比对组的PLS-DA模型参数Table 1 Parameters of PLS-DA model in each group

图2 比对组PCA得分图Figure 2 PCA score plot of each group

图3 比对组的PLS-DA和OPLS-DA得分图和置换检验图Figure 3 PLS-DA and OPLS-DA score plots and permutation test of OPLS-DA of each group
2.2.2 代谢差异物的筛选
结果发现,与对照组相比,ALL 组中共筛选出61种差异性代谢物(图4)。37种代谢物在ALL中表达上升,24种代谢物在ALL中表达降低。这些代谢物来自13个亚组,如氨基酸、多肽和类似物、酰基肉碱、鞘脂、类固醇、激素和脂肪酸等(图4B、D)。热图分析示ALL 组氨基酸、脂质、核苷酸等代谢物改变明显(图4A)。ALL 组表达量上升最显著的10 种差异代谢物是对甲酚、脱氧胆酸、12-酮石胆酸、7-酮石胆酸、DG(20∶0/20∶0)、24-OH 胆固醇、焦谷氨酰异亮氨酸、莽草酸、硫酸吲哚酯、肉碱-C16OH,表达量下降最显著的10种差异代谢物是1-吡咯啉-5-羧酸、5-羟色胺,PE(O-18:0/22:5)、PG(16:0/18:1)、SM(34:2;3)、γ-谷氨酰半胱氨酸、亮氨酸、叶酸、SM(40:2;3)、肉碱-C(18:2)(图4C)。
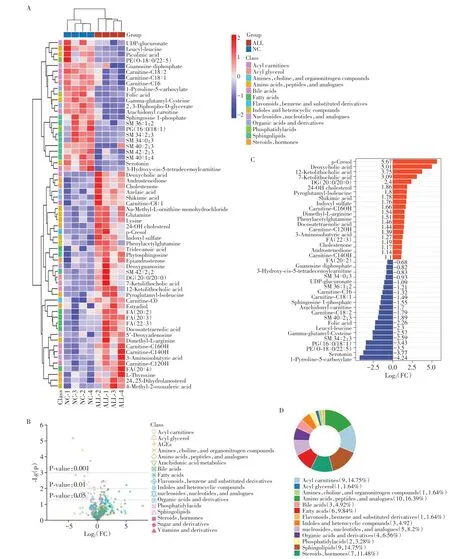
图4 差异代谢物分析图Figure 4 Differential metabolite analysis plot
2.2.3 代谢通路的富集分析
将鉴定出的差异代谢物通过KEGG进行通路分析(图5)。研究发现ALL 组的通路富集于细胞过程、环境信息处理、人类疾病、代谢、生物体系统等一级通路。其中细胞过程富集于缝隙连接等二级通路,环境信息处理富集于鞘脂信号通路、Ras信号通路、Rap1信号通路、磷脂酶D信号通路、神经活性配体-受体的相互作用、cAMP 信号通路、钙信号通路、Apelin信号通路等二级通路,人类疾病通路富集于前列腺癌、癌症的途径、内分泌抵抗、EGFR 酪氨酸激酶抑制剂耐药性、化学致癌作用-受体激活等二级通路,代谢通路富集于鞘脂代谢、嘌呤代谢、氨基酸的生物合成,丙氨酸、天冬氨酸和谷氨酸的代谢等二级通路,生物体系统通路富集于甲状腺激素合成、甲状腺激素信号通路、生热作用、蛋白质消化吸收、催乳素信号通路、卵巢类固醇生成、GnRH分泌、谷氨酸能突触、FcγR-介导的吞噬作用、雌激素信号通路、内分泌和其他因子-调节钙的重吸收、胆汁分泌等二级通路。

图5 ALL与对照组的差异代谢物参与的通路富集分析Figure 5 Pathway enrichment analysis with differential metabolite participation of ALL and control groups
2.3 外显子组学分析
2.3.1 测序数据质控结果
比例均达90%以上,说明碱基错误率较低。质控结果如表2 所示。原始测序数据下机后经过Fastp软件的处理,过滤掉因测序仪、测序试剂、样品等多个因素所导致的测序错误碱基,本研究8 个样本有效测序序列(reads)占比均为99%以上,说明测序效果较好,质量值大于Q20 的碱基占有效碱基的比例均为97%以上。
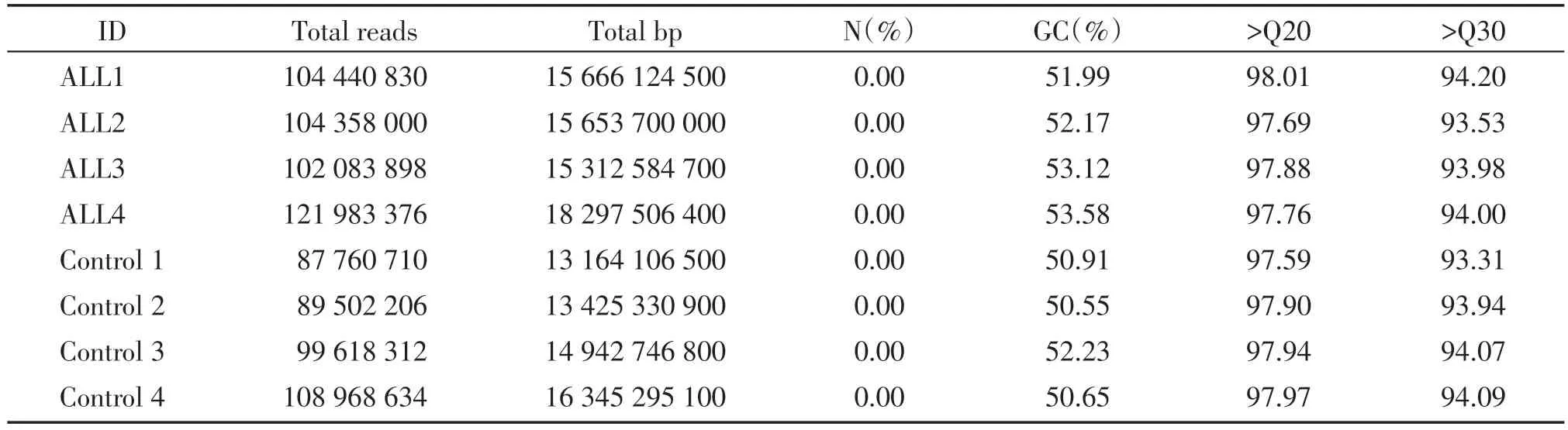
表2 样本测序质控结果统计汇总表Table 2 Summary of sample sequencing quality control results
2.3.2 变异检测
将Clean Reads 比对到参考基因组(GRCh37/hg19)上,一般情况下若比对率≥95%、深度>10X,该位点处检测出的突变可信度较高。本实验8例样本的比对率和覆盖度完全满足后续对比分析要求(表3)。
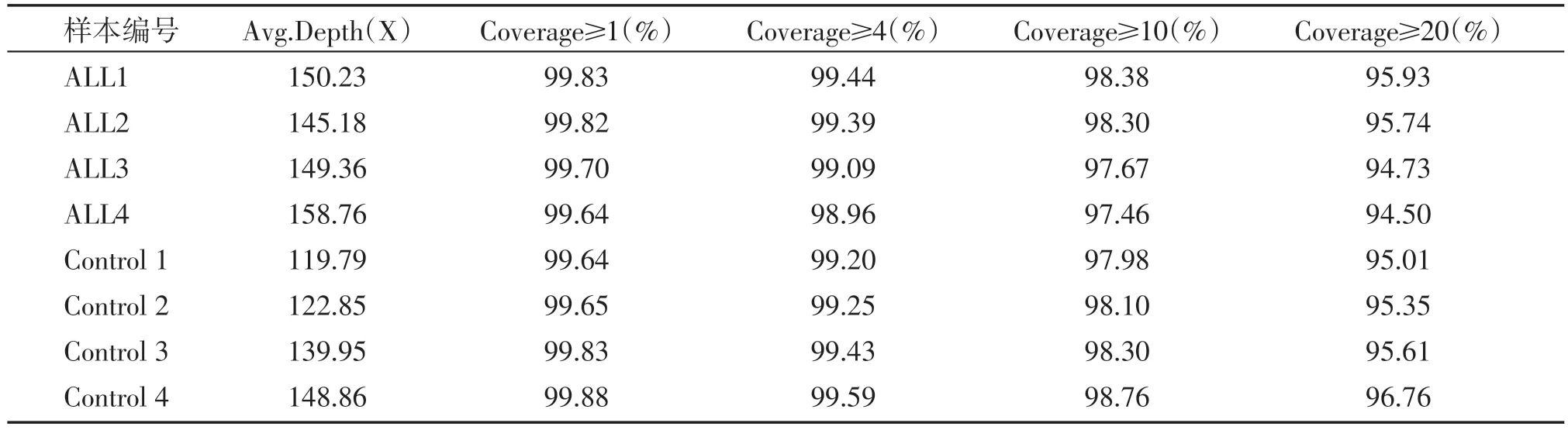
表3 比对信息统计表Table 3 Statisical information for ALL and control groups
单核苷酸多态性(single nucleotide polymorphism,SNP)主要是指在基因组水平上由单个核苷酸变异所引起的DNA序列多态性,包括单个碱基的转换、颠换等。InDel(insertion and deletion)是小型的插入和缺失的总称。编码区或剪接位点处发生的插入缺失都可能会改变蛋白的翻译。移码变异,其插入或缺失的碱基串的长度为3 的非整数倍,因此可能导致整个读框的改变;移码变异与非移码变异相比较,前者对基因功能的影响更大,同时受到更大的筛选压力。本实验8例样本各检测出的SNP及InDel位点数量如表4所示,合计共222 280个SNP变异位点以及12 610个InDel位点。

表4 变异类型数量统计Table 4 Statistics of the number of variant types for ALL and control groups(n)
2.3.3 变异筛选及与疾病相关性的预测
全外显子测序后得到的数据量极大,但大部分突变不具备致病性,故需要进一步筛选与疾病相关性更强的变异。根据保留满足ALL 组两位及两位以上受试者共有并且未在健康对照组中出现的突变位点,8 位受试者共保留SNP 位点957 个,其中479 个为非同义突变,对应基因334 个;InDel 位点37个,对应28个基因。共有基因8个,分别是GOLGA8H、HOXB1、KIF20B、MUC16、MUC17、MUC4、TNRC6A、ZNF283。对354 个基因进行蛋白互作网络分析(PPI)(图6A)。然后利用Cytoscape 软件中的“cytohubba"算法筛选出互作关系前10的基因,分别 为MUC17、MUC12、MUC16、MUC4、B3GNT3、GCNT4、B3GNT4、GALNT12、GALNT15、GALNT5(图6B),可能为ALL的关键基因。

图6 差异基因的蛋白互作网络(A)和子网络图(B)Figure 6 Protein interaction networks(A)and subnetwork(B)diagrams of differential genes
3 讨论
ALL 是一种罕见的恶性血液病,儿童的发病率远高于成人,临床上ALL表现为骨髓、外周血、淋巴和非淋巴组织中恶性、未成熟的淋巴母细胞增殖和聚集,未经治疗的ALL患儿会在几个月内死亡[6]。本研究是基于LC-MS对ALL患儿的血液进行研究,找到ALL 患者血清代谢物的改变,寻找与ALL 相关的潜在代谢生物标志物以指导临床。新陈代谢改变越来越被认为是癌症的一个重要表现,因此是识别治疗靶点或标志物的潜在研究领域[7]。目前对白血病的治疗虽然已经取得了很大进展,但是很多患儿仍然达不到预期效果,甚至达不到缓解状态。近年血浆代谢方向在白血病中的研究颇多,文献报道血浆代谢组学检测诱导治疗后的ALL 患者脂质代谢发生了显著改变[8]。
本研究发现相比对照组,ALL 组的差异代谢物主要来源于氨基酸代谢、脂质代谢、三羧酸循环及核苷酸代谢等通路。氨基酸是蛋白质的基本组成单位,具有重要的生理功能,一些氨基酸,如酪氨酸、色氨酸、天冬氨酸、谷氨酰胺和甘氨酸分别是合成某些激素、神经递质及核苷酸等含氮物质的底物,一些氨基酸,如谷氨酸、精氨酸及天冬氨酸等可以转化为α-酮酸参与三羧酸循环产能等。在ALL组中谷氨酰胺含量显著升高,谷氨酰胺是3 种参与嘌呤核苷酸从头合成的酶和2种参与嘧啶核苷酸从头合成酶所需的底物。谷氨酰胺的表达量提高,可能是ALL 原始细胞合成并分泌谷氨酰胺,从而增加基质细胞的细胞外谷氨酰胺可用性[9]。相关文章报道起源组织、遗传学和肿瘤微环境都会影响癌细胞内谷氨酰胺的利用,由于谷氨酰胺合成酶的低表达,一些恶性肿瘤依赖于谷氨酰胺的外源性供应。因此,在谷氨酰胺酶的缺失或抑制下,依赖外源性谷氨酰胺供应能量的恶性肿瘤将无法利用这种来源的营养物质[10]。
ALL 组中5-羟色胺含量较对照组明显下降,5-羟色胺是一种分子,属于一类称为吲哚胺的化合物,存在于所有生物体中,作为单胺神经递质、生化信使和调节剂起作用。血清素能系统缺乏会导致抑郁症、强迫症、恐惧症、创伤后应激障碍、癫痫和广泛性焦虑等疾病。ALL 组的信号通路富集明显,可能与5-羟色胺相关。
ALL 组中叶酸含量较对照组明显下降,叶酸是维生素B家族的成员,主要被称为维生素B9。叶酸是人体制造DNA 和RNA 及细胞分裂所必需的。由于人类不能制造叶酸,因此它是饮食中必需的,ALL初期患儿体内核苷酸代谢旺盛,可能导致叶酸含量显著下降。
ALL 组胆汁酸表达量上升,当脱氧胆酸含量足够高时,脱氧胆酸可作为肝毒素、代谢肉毒毒素和癌代谢物。长期高水平的脱氧胆酸也与多种癌症有关,包括结肠癌、胰腺癌、食道癌等胃肠道癌症。
ALL 组差异代谢物富集于如Rap1 和Ras 等信号通路,Ras突变在B-ALL中有许多文献报道过,而Rap1 信号通路却相对较少[11]。丝裂原活化蛋白激酶(MAPK)途径(其中Ras 是关键调节因子)在细胞生长、分化和凋亡中起关键作用,并与多种恶性肿瘤(包括ALL 和急性髓系白血病)的发病机制有关。Ras/Raf/MEK/ERK通路基因突变是儿科ALL复发时最常见的突变之一[14]。
ALL组全外显子测序检测出的关键基因大多来自黏蛋白(mucoprotein,MUC)家族和多肽N-乙酰半乳糖胺基转移酶(polypeptide N-acetylgalactosaminlyltransferase,GALNT)家族。MUC 家族是一组高度糖基化的大分子,在哺乳动物上皮细胞中大量表达。MUC有助于黏液屏障的形成,因此对感染具有保护作用。有趣的是,一些MUC蛋白在癌细胞中异常表达,并参与肿瘤的发生和发展,包括细胞生长、增殖、凋亡抑制、化疗耐药、代谢重编程和免疫逃避[12]。GALNT 家族的成员作为催化蛋白质黏蛋白型O-糖基化的起始酶起作用,其表达失调可以改变癌细胞行为,例如肿瘤发生、增殖、迁移、转移和耐药性[13]。查阅资料后少见其在ALL 中的研究。未检测出KRAS、NOTCH1、NRAS 等经典突变,考虑可能是样本量不够多。部分基因在其他血液疾病中有过报道,如HOXB1在许多急性髓系白血病的原代细胞和细胞系中保持沉默,而在正常终末分化的外周血细胞中表达[15],ANKRD36 是早期慢性粒细胞白血病进展的潜在常见生物标志物和药物靶点[16]。
综上,本研究初步筛选了ALL 患者血清内源性小分子代谢物和代谢差异物所属代谢通路,外显子组学揭示了蛋白互作数量排名前10 的基因有MUC17、MUC4 等。由于本研究没有纳入ALL 初次诱导分化后的血清代谢组学分析,因此无法确认筛选出的61 种代谢物在ALL疾病发展过程中的意义。在今后的研究中,有望通过ALL初次就诊和ALL治疗后的儿童,分析其血清代谢组学特征,筛选出ALL患者特异的生物标志物,为未来的精准医学靶向治疗提供依据。

