心电图联合CK-MB、cTnI、copeptin在急性心肌梗死诊断中的应用价值
丁娅萍
浙江省台州市中医院心电图室 318000
急性心肌梗死(Acute myocardial infarction,AMI)是冠状动脉阻塞导致心肌供血不足、心脏功能受损的急性冠脉综合征,具有进展快、死亡率高的特点,是全球心血管死亡的主要原因。快速、准确地早期诊断AMI,既可防止药物误用,以免对心脏造成毒性,又可对心肌梗死迅速作出反应,以增加患者的生存机会[1]。由于AMI发病前通常无特定症状,预后较差,因此需要一种有效的早期诊断方法。心电图(ECG)是评估心脏最基本和最快速的方法之一,在胸部不适患者的早期诊断和评估中起重要作用。心电图作为AMI 诊断最常用的方法,具有成本低、安全性好且报告快速优点,临床应用广泛,但ECG易漏诊、误诊,仅有50%~57%的AMI患者可以得到准确诊断[2]。心肌肌钙蛋白(cTnI)、肌酸激酶同工酶(CK-MB)等指标是诊断AMI的常见生物标志物[3]。临床研究证实[4],心肌细胞损伤时CK-MB会显著升高,而cTnI更是唯一公认的可以影响急性冠脉综合征患者的生物标志物,但CK-MB和cTnI在AMI症状发作后3~6h开始升高,由于CK-MB和cTnI在心肌损伤早期缺乏敏感性,加入快速诊断AMI的标志物尤为重要。和肽素(copeptin)是一种新发现的心肌坏死标志物,临床研究证实,和肽素在各种急性病症中迅速升高,既可以克服其他生物标志物的延迟性,又可弥补心电图早期非典型改变的缺陷,可以快速进行AMI的早期诊断和预后评估。但有研究指出[5],虽然AMI患者copeptin显著升高,但由于缺乏敏感性,不应将其作为诊断AMI患者的单一生物标志物。基于此,本文将探究心电图联合CK-MB、cTnI、copeptin在AMI患者中的诊断效果,现报道如下。
1 资料与方法
1.1 一般资料 选取我院2019年5月—2022年5月收治的80例疑似AMI患者为观察对象。纳入标准:(1)所有患者均具有疑似AMI的临床症状,如胸闷、胸疼、恶心、呕吐等,且均行心电图和冠状动脉造影检查;(2)年龄≥18岁;(3)胸痛发作后3h内到医院就诊;(4)均为首次AMI治疗且无陈旧性心肌梗死。排除标准:(1)合并有血液系统疾病、免疫系统疾病、恶性肿瘤的患者;(2)合并有严重心律失常、慢性心衰、风湿性心脏病、心肌炎、先天性心脏病和心脏瓣膜器质性病变等心脏疾病;(3)心、肝、肾功能不全患者。根据冠状动脉造影结果分为AMI组和非AMI组。AMI组50例,男22例,女28例,年龄30~74岁,平均年龄(51.26±9.15)岁;非AMI组30例,男14例,女16例,年龄28~73岁,平均年龄(50.43±9.42)岁。两组基本资料比较差异无统计学意义(P>0.05)。本次研究获得本院伦理委员会批准。
1.2 方法
1.2.1 心电图检查:所有患者均进行18导联心电图(日本光电ECG-2550十八导联全自动分析心电图机)检测,ECG检测均由具有5年以上检查科医师实施,为了避免漏诊正后壁心肌梗死以及右室心肌梗死,全部加做V3R~V5R、V7~V9。连续测量3个波形并取平均值作为ST段的移动改变值,由2名以上医师采用盲法续测量和分析心电图分结果。
1.2.2 生物学指标检查:所有患者入院后即刻采集肘静脉血5ml,以3 000r/min离心10min,分离血清,-70℃保存待测。韩国i-CHROMA Reader免疫荧光分析仪上采用免疫荧光法检测cTnI水平(检测试剂盒购自德国罗氏公司),采用深圳迈瑞Bs-2000全自动生化分析仪行酶联免疫吸附试验检测copeptin水平(检测试剂盒购自美国凤凰制药公司),采用roche Cobas 601全自动化学发光仪行免疫化学发光法检测CK-MB水平(检测试剂盒购自深圳迈瑞公司)。
1.2.3 诊断标准:所有患者均接受冠状动脉造影(CAG),并作为诊断金标准,CAG 由经验丰富的介入心脏病专家使用标准Judkins方法进行,每条血管至少进行3次多位置曝光。
1.2.4 数据收集:所有数据将由2名助理单独收集,所有数据将单独存储和保存。对数据库的访问将仅限于该研究团队的研究人员。
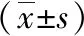
2 结果
2.1 心电图诊断结果 以CAG检查为金标准,心电图确诊AMI 40例,非AMI 14例,诊断AMI灵敏度为80.00%(40/50),特异度为46.67%(14/30),阳性预测值为71.43%(40/56),阴性预测值为58.33%(14/24),诊断准确度为67.50%(54/80),见表1。
2.2 两组患者血清CK-MB、cTnI、copeptin比较 AMI组患者血清CK-MB、cTnI、copeptin均明显高于非AMI组,差异具有统计学意义(P<0.05),见表2。
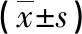
表2 两组血清CK-MB、cTnI、copeptin水平比较
2.3 心电图联合CK-MB、cTnI、copeptin诊断AMI效能分析 将患者心电图检测结果、血清CK-MB、cTnI、copeptin水平及Logistics回归分析预测概率作为检验变量,是否为AMI(AMI=0,非AMI=1)作为状态变量,绘制ROC曲线,结果显示心电图联合CK-MB、cTnI、copeptin联合检测诊断AMI的AUC明显高于各指标单独检测(Z心电图=4.197,ZCK-MB=3.125,ZcTnI=2.263,Zcopeptin=2.860,P<0.05),灵敏度、特异度分别为83.70%、96.80%,且AMI发作后血清CK-MB、cTnI、copeptin水平的最佳截断值分别为24.23U/L、0.61μg/ml、19.63pg/ml时,预测价值较为理想,见表3和图1。

图1 心电图联合血清CK-MB、cTnI、copeptin诊断AMI的ROC分析

表3 心电图联合CK-MB、cTnI、copeptin诊断AMI的效能分析结果
3 讨论
AMI发病急,病情危重,临床常表现为持续性的系统、循环功能异常及心律失常等,对患者身体健康造成严重威胁。临床治疗AMI的主要方向为维持心脏功能、缩小心肌的缺血范围,主要治疗方法为溶栓及介入治疗,早期治疗可显著提高治疗成功率及患者的生存质量,因此采取有效措施对患者进行诊断、并给予早期针对性的治疗至关重要。
心电图是诊断AMI最常用的影像学方法,操作方便,可反复检查,随时观察心脏周期产生的电活动变化。相关研究显示,AMI患者的心电图显示ST段抬高后30min内接受溶栓治疗或90min内接受手术治疗可显著降低患者的死亡率[6]。本文结果显示,心电图诊断AMI灵敏度为80.00%、特异度为46.67%、准确度为67.50%,可见心电图对于AMI具有一定的诊断价值。但部分AMI患者的心电图变化并不典型,如梗死面积较小、未出现异常的Q波,胸前导联R递增不良,最终导致心电图变化不明显[7]。因此,心电图单独诊断AMI易出现误诊漏诊的情况,需联合其他手段进行诊断。
CK-MB是在心肌中起到重要作用的能量调节酶,在AMI发病4~6h后,人体内的CK-MB即可高于正常水平,于发病24h左右达到峰值,于发病48~72h左右恢复正常[8]。因此,CK-MB水平可对心肌梗死的程度予以准确反映。本研究结果显示,CK-MB诊断AMI的灵敏度及特异度分别为89.80%及56.10%。但CK-MB不仅存在于心肌组织中,也存在于非心肌组织中,肌肉及骨骼创伤、乙醇重度及血糖异常升高等均会导致CK-MB的升高,因此CK-MB诊断AMI的特异度较低。cTnI是心肌纤维中专有的收缩蛋白,不会出现在正常的血液循环中,是特异性的心肌损伤标志。在AMI发病后的24~36h后,肌钙蛋白从细胞池释放,引起cTnI的水平升高;发病后的2~4d,机体释放结构蛋白,导致cTnI第二次释放,特异性较高[9]。本文结果显示,cTnI诊断AMI的灵敏度及特异度分别为83.70%及77.40%。但cTnI诊断AMI的敏感性较低。copeptin是由神经垂体与精氨酸加压素等量释放,在血液中具有良好的稳定性,检测较为方便快捷,在AMI发病后在血液中的水平显著升高[10]。本文结果显示,copeptin诊断AMI的灵敏度及特异度分别为75.50%及90.30%。心电图联合三种指标在AMI的诊断中均具有灵敏度或特异度较低的缺陷。本文结果显示,心电图联合CK-MB、cTnI、copeptin诊断AMI的灵敏度及特异度分别为83.70%及96.80%,且四者联合诊断的AUC明显高于各指标单独检测,可见联合可优势互补,价值较高。
综上所述,在AMI诊断中,心电图联合血清CK-MB、cTnI、copeptin有利于提高临床诊断的准确率,为早期临床治疗提供重要的参考依据。

